急性心肌梗死患者抗心肌肌球蛋白重链抗体诱导心肌细胞凋亡*
邵 靓, 刘 坤, 汪 莉, 丁艳萍, 廖玉华, 王朝晖
(华中科技大学同济医学院附属协和医院心内科,湖北 武汉 430022)
·论著·
急性心肌梗死患者抗心肌肌球蛋白重链抗体诱导心肌细胞凋亡*
邵 靓, 刘 坤, 汪 莉, 丁艳萍, 廖玉华, 王朝晖△
(华中科技大学同济医学院附属协和医院心内科,湖北 武汉 430022)
目的探讨抗心肌肌球蛋白重链抗体(AMHCA)诱导心肌细胞凋亡的作用及其机制。方法从急性心肌梗死患者血清中提取AMHCA,研究其对成年大鼠心肌细胞凋亡的影响。DNA末端标记膜联蛋白-V/PI复染色法观察和测量心肌细胞凋亡。分别用免疫印迹、膜片钳和激光共聚焦法检测凋亡相关蛋白P53和Bcl-2以及第二信使钙离子的表达和浓度。结果AMHCA诱导的心肌细胞凋亡具有剂量依赖性。在此过程中,促凋亡的核蛋白P53促进心肌细胞凋亡,而抑凋亡的胞质蛋白Bcl-2 抑制心肌细胞凋亡。同时,胞内钙离子浓度升高,而L型钙通道则没有影响。结论急性心肌梗死患者体内的AMHCA可能是一种新的起动因子,可诱导心肌细胞凋亡。
心肌梗死; 心肌球蛋白重链; 细胞凋亡; 蛋白质P53; 蛋白质Bcl-2; 钙
急性心肌梗死是危害人类健康的重要疾病,也是导致心力衰竭的主要因素[1,2]。由急性心肌梗死向心衰的演变的过程中,神经体液因子发挥着重要的作用。血管紧张素Ⅱ、醛固酮、肾上腺素和去甲肾上腺素能够诱发心肌细胞肥大和凋亡,而这种不可逆的改变则是导致心力衰竭中心室重塑的重要原因[3]。在过去的十数年里,越来越多的证据表明炎症和免疫反应在心室重塑的过程中扮演着重要的角色。一些致炎细胞因子对心肌细胞产生各种病理学作用。例如,肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)能直接诱导心肌细胞凋亡[4]。
促凋亡基因或抑凋亡基因在心肌中的优势表达决定了心肌细胞凋亡的发生和发展。心肌细胞的凋亡也和细胞内钙离子浓度的增加密切相关。钙离子是一种与促凋亡基因和抑凋亡基因有关联的重要的第二信使,它们共同构成了细胞凋亡的信号途径[5]。
临床和实验研究表明,扩张型心肌病中心肌细胞自身抗体能对心功能和心脏结构产生损害[6]。既往的研究显示,抗β1肾上腺素能受体、抗ADP/ATP 载体抗体和抗心肌肌球蛋白重链抗体(anti-cardiac myosin heavy chain antibodies, AMHCA)能够促使心肌细胞内的钙离子超负荷[7]。我们和其他的研究者先后报道了针对心肌肌球蛋白的自身抗体在急性心肌梗死的患者中具有较高的检出率[8]。我们又进一步发现急性心肌梗死患者中AMHCA阳性患者的动脉瘤发生率和病死率较高。因此,心肌肌球蛋白重链抗体可能与急性心肌梗死的发病机制有关,而AMHCA可能在此过程中起到了重要作用。但AMHCA在急性心肌梗死时心肌细胞凋亡的过程中仅仅是一旁观者,还是发挥病理效应仍需进一步阐明。
本实验拟验证从急性心肌梗死患者血清中提取的AMHCA能否诱导心肌细胞凋亡,并研究凋亡相关的信号分子包括细胞核蛋白53(protein 53,P53)和胞浆蛋白B细胞瘤基因2(B-cell lymphoma gene 2,Bcl-2)的表达以及L-型钙离子通道和胞内钙离子浓度的改变。
材 料 和 方 法
1病例、抗体检测和纯化
根据2008年ACC/AHA急性心肌梗死诊断标准,采集40例患者诊断为急性心肌梗死。其中男25例,女15例,平均年龄(60±10)岁。经酶联免疫吸附法检测AMHCA,测定特定的抗原肽序列,如下:Glu-Ile-Glu-Arg-Lys-Leu-Ala-Glu-Lys-Asp;Val-Asp-Lys-Leu-Gln-Leu-Lys-Val;Ala-Lys-Ser-Arg-Asp-Ile-Gly-Ala-Lys-Gly-Leu-Asn-Glu。40例患者外周血中AMHCA为阳性。实验方案符合1963年《赫尔辛基宣言》所申明的原则和条款(1983年于威尼斯修改)。AMHCA阳性的血清(约10 mL全血)经亲和层析的方法提纯后备用(纯度约为98.8%)。
AMHCA的特异性经酶联免疫吸附法检测,并已为为其他研究的者所证实[9]。而AMHCA的纯度是经亲和层析的方法提纯所得,此方法是目前普遍采用的方法。
2成年大鼠心肌细胞的分离和实验分组
2.1试剂 (1)台氏液(mmo/L):NaCl 135, KCl 5.4, MgCl21.0, NaH2PO40.33, CaCl21.8, Hepes 10, 葡萄糖 10(NaOH调 pH 7.4);(2)无钙液(mmo/L): 台氏液去掉CaCl2;(3)KB液(mmo/L): MgCl25, KCl 40, KH2PO420,牛磺酸20, 谷氨酸50, EGTA 0.5, Hepes 10, 葡萄糖 10(KOH调 pH 7.4)。
2.2方法 于无菌条件下,酶解法分离250-300 g成年大鼠心肌细胞。实验大鼠均依照美国国立卫生研究所颁布的《实验动物饲养和使用指南》(NIH publication No. 23-85, 1996年修改)受到良好对待。快速游离大鼠心脏置于4 ℃台氏液中,稍作修饰后主动脉逆行插管, 通过Langendorff 37 ℃恒温灌流装置逆行灌流心脏。即先用无钙液冲洗5 min,再用含有0.2 g/L Ⅱ型胶原酶(Worthington), 0.02 g/L蛋白酶E(Sigma), 0.2 g/L牛血清白蛋白(BSA) (Sigma)的酶液循环灌流5 min, 最后用KB液冲洗3 min, 剪碎心室肌, 放入KB液温孵, 反复倾出上清液, 静置1 h备用。将新鲜分离的心肌细胞置含有10%胎牛血清(Invitrogen)的DMEM培养基中于37 ℃、5% CO2培养箱中静置培养24 h。加入不同浓度的AMHCA,观察其对心肌细胞凋亡的影响。未加AMHCA的心肌细胞作为对照组。
3抗体结合实验
通过免疫印迹法检测AMHCA与心肌肌球重链蛋白的结合。作为Ⅰ抗的AMHCA稀释度为1∶10 000,辣根过氧化物酶(HRP)标记的山羊抗人IgG作为Ⅱ抗,稀释度1∶7 500。通过免疫荧光法观察AMHCA与心肌细胞的结合。将新鲜分离的大鼠心肌细胞凃片后常规固定、封闭。继而将涂片与1∶100AMHCA 4 ℃孵育过夜。再加入1∶80 000异硫氰酸荧光素(FITC)标记的山羊抗人IgG(Sigma)37 ℃温育1 h。通过激光共聚焦显微镜(Olympus FV500)观察心肌细胞上荧光结合的情况。
Bradford法进行蛋白质定量。上样量20-30 μg,用10%SDS-聚丙烯酰胺凝胶进行电泳分离,转NC膜。5%脱脂奶封闭后,分别加入1∶1 000小鼠抗大鼠p53单克隆抗体(Abcam)和1∶1 000兔抗大鼠Bcl-2多克隆(PharMingen)抗体, 4 ℃孵育过夜,用含0.05%Tween-Tris缓冲盐溶液洗3次,加入HRP标记的Ⅱ抗。显色后,采用Gelwork凝胶图像分析系统对胶片扫描,以对照组的面积灰度值为100%与实验组进行比较和半定量分析。
实验中,分别设置阴性对照和空白对照。将与抗原肽预孵后的AMHCA液和PBS液分别作为阴性对照和空白对照实验的Ⅰ抗。
4凋亡检测
4.1TUNEL 应用脱氧核糖核酸末端转移酶介导的缺口末端标记法(TUNEL)观察单个心肌细胞的凋亡。TUNEL试剂盒购自Roche,按试剂盒说明书检测。
4.2Annexin V-FITC/PI双染法流式细胞术检测细胞凋亡 应用Annexin V-FITC/PI双染法标测凋亡的心肌细胞。Annexin V-FITC/PI凋亡检测试剂盒购自Becton Dickinson,按试剂盒说明书检测。通过流式细胞术和相应的软件,检测和计算凋亡的心肌细胞数。
5免疫印迹
收集心肌细胞、裂解,提取胞浆蛋白和核蛋白。 Bradford法进行蛋白质定量。上样量20-30 μg,用10%SDS-聚丙烯酰胺凝胶进行电泳分离,转NC膜。5%脱脂奶封闭后,分别加入1∶1 000小鼠抗大鼠p53单克隆抗体(Abcam)和1∶1 000兔抗大鼠Bcl-2多克隆(PharMingen)抗体, 4 ℃孵育过夜,用含0.05%Tween-Tris缓冲盐溶液洗3次,加入HRP标记的Ⅱ抗。用ECL显色并曝光于X胶片。采用Gelwork凝胶图像分析系统对胶片扫描,以对照组的面积灰度值为100%与实验组进行比较和半定量分析。
6膜片钳记录
心肌细胞台氏液复钙后通过EPC-9膜片钳放大器(HEKA)在全细胞模式下记录ICa-L。电极经两步法拉制后,充以ICa-L电极内液(mmo/L): CsCl 120, CaCl21.0, MgCl25, MgATP5,EGTA 11, Hepes 10,葡萄糖 11(CsOH调 pH 7.3)。保持电位-80 mV,先给予100 ms,-40 mV的去极化脉冲灭活钠通道和T型钙通道,再给予300 ms、0 mV的去极化脉冲可记录到ICa-L。给予阶跃10 mV,-40~+60 mV系列去极化脉冲,可记录不同钳制电压下的ICa-L。数据采集及分析处理由Pulse 和Pulsefit软件(HEKA)完成。
7胞内Ca2+浓度测定
新鲜分离的心肌细胞用10 mg/L Fluo-3AM和0.03% pluronic F-127(Sigma)37 ℃避光负载30 min。与Ca2+结合的Fluo-3可被488 nm的氩离子激光激发,发射波长526 nm,细胞内荧光强度(fluorescent intensity,FI)变化可指示加入AMHCA前后细胞内游离Ca2+浓度[Ca2+]i的相对变化。于激光共聚焦显微镜(Olympus FV500)下连续动态扫描。
8统计学处理
结 果
1AMHCA与心肌细胞的结合
免疫印迹结果显示,急性心肌梗死患者外周血中纯化的AMHCA能识别心肌细胞200 kD的蛋白质分子,见图1A。免疫荧光结果显示,加入AMHCA的玻片上能观察到沿杆状心肌细胞分布的绿色荧光,见图1B。而对照组观察不到绿色荧光和蛋白条带。
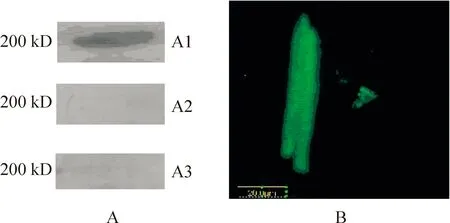
Figure 1. AMHCA binding to cardiomyocytes.A: A1, 200 kD protein band recognized by the purified AMHCA in sera from patients with AMI;A2, 200 kD protein band didn’t recognize by AMHCA which was pre-incubated with peptide(negative control experiment);A3, 200 kD protein band didn’t recognize by PBS(control experiment).B: cardiomyocyte membrane stained by immunofluorescence(×400).
2AMHCA诱导心肌细胞凋亡
通过TUNEL法(图2)和Annexin V-FITC/PI双染法(图3)观察AMHCA诱导的心肌细胞凋亡。与1.0×1010mmol/L AMHCA孵育24 h后,观察到TUNEL染色阳性的凋亡心肌细胞,见图2B。Annexin V-FITC/PI双染法流式细胞术可定量测定心肌细胞凋亡比例。AnnexinV+/PI-染色的凋亡心肌细胞位于右下象限,见图3B。AMHCA诱导的心肌细胞凋亡比例显著增加(P<0.01)。AMHCA诱导心肌细胞凋亡比例呈浓度依赖性。1.0×102mmol/L、 1.0×106mmol/L和1.0×1010mmol/L的AMHCA分别致心肌细胞凋亡比例为3.57%±0.13%、14.96%±4.60%和19.49%±3.27%。
3P53蛋白表达上调和Bcl-2蛋白表达下调
与对照组相比,1.0×1010mmol/L AMHCA显著增加P53核蛋白的表达,下调Bcl-2胞浆蛋白的表达,见图4。
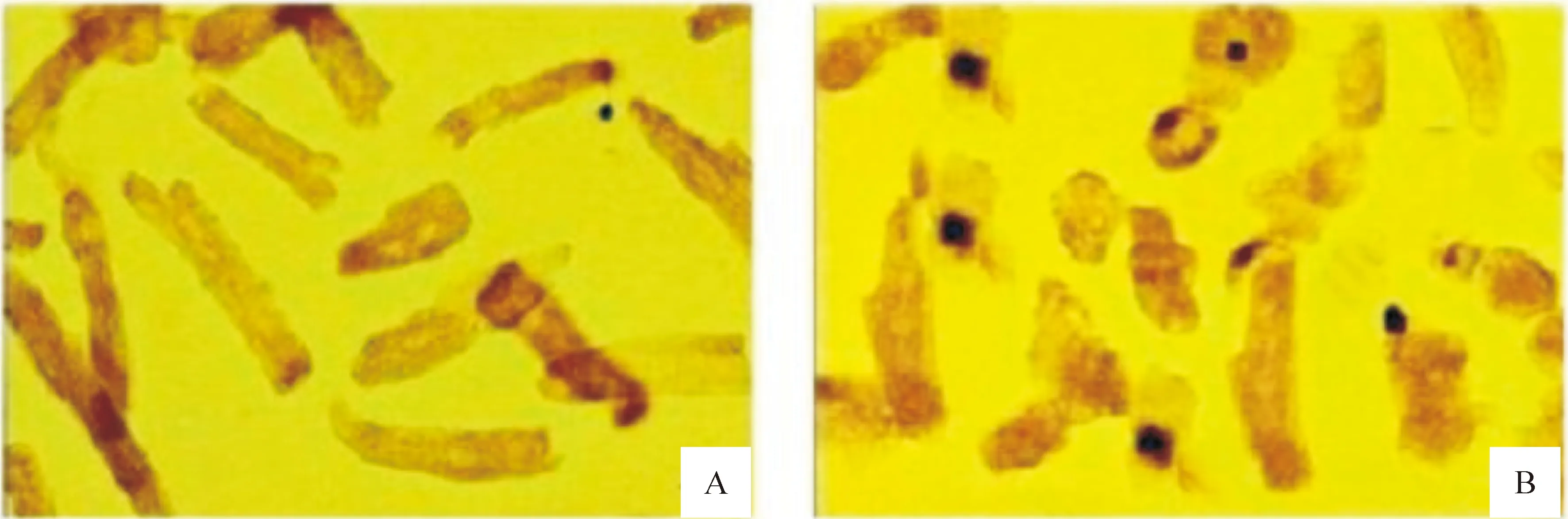
Figure 2. Cardiomyocyte apoptosis detected by TUNEL(×400).A: cardiomyocytes in the absence of AMHCA as a control; B: apoptotic cardiomyocytes in the the presence of AMHCA. The nuclei of apoptotic cardiomyocytes were stained with brown color.
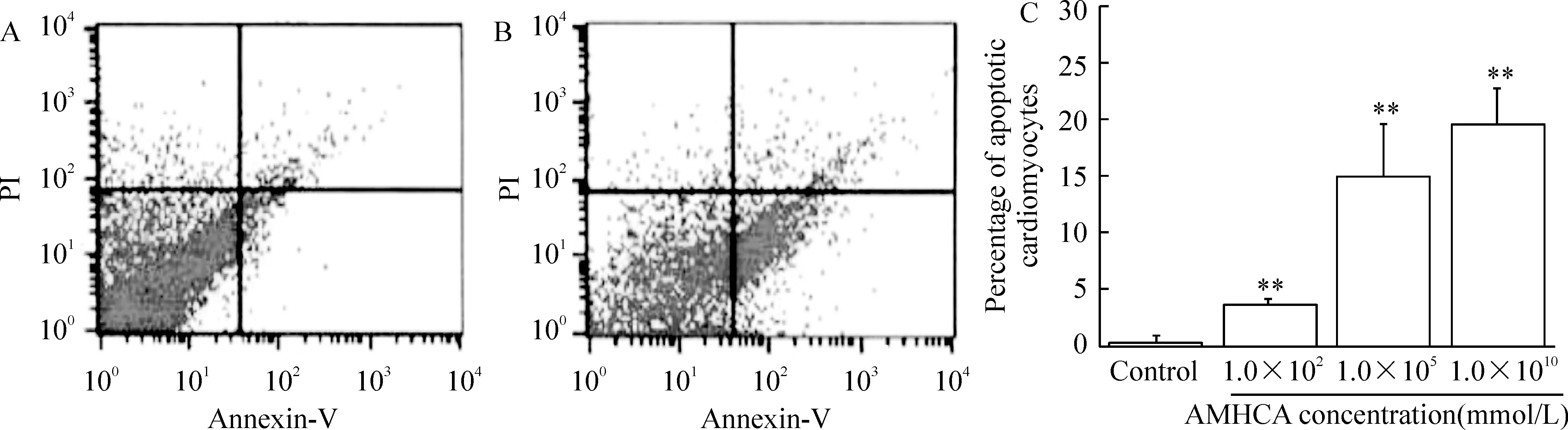
Figure 3. The percentage of apoptotic cardiomyocytes assayed by Annexin-V/PI double-staining flow cytometry.A and B: the number of AnnexinV+/PI- staining cells at lower right quadrant represents the percentages of apoptotic cardiomyocytes in the absence(A) or presence(B) of 1.0×1010 mmol/L AMHCA; C: the percentages of apoptotic cardiomyocytes in the presence of AMHCA increased in a concentration-dependent manner.±sE.n=4.**P<0.01 vs control.
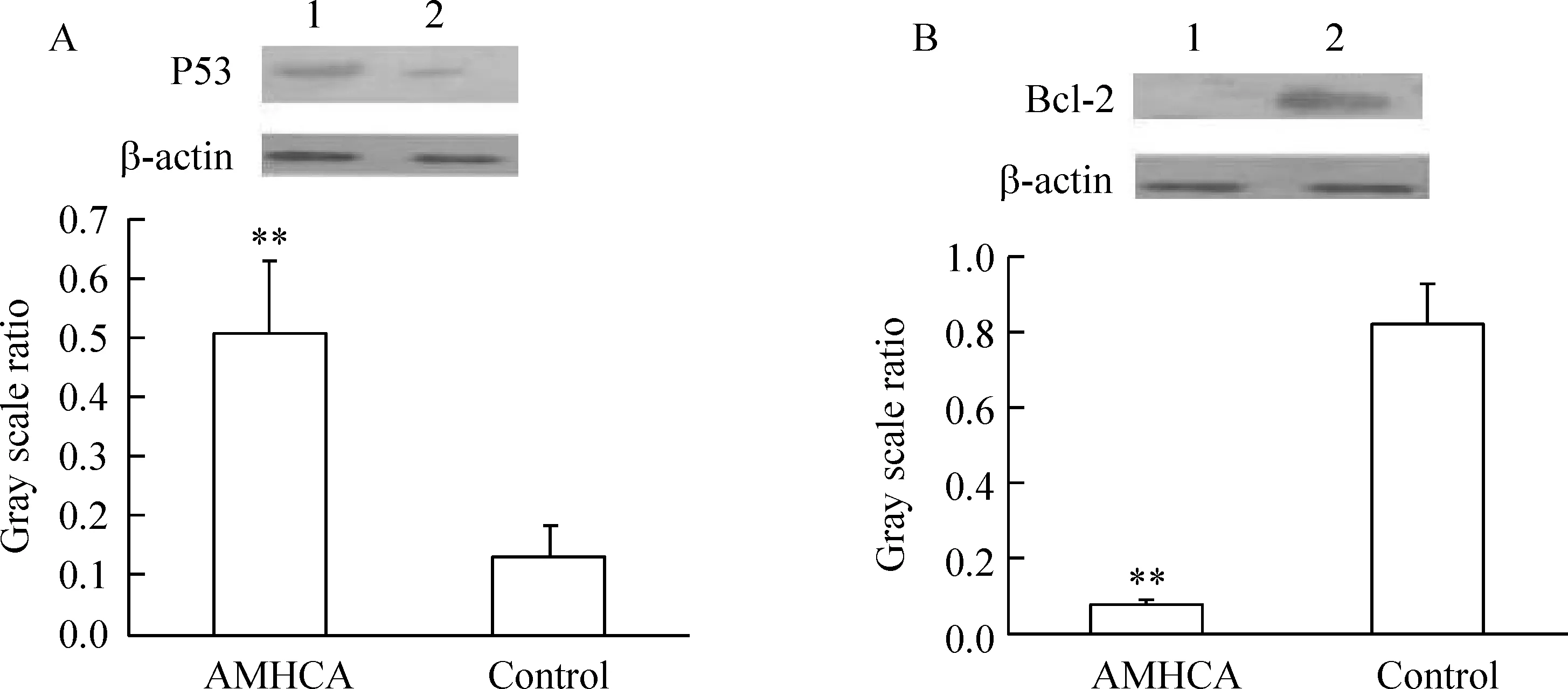
Figure 4. Effects of AMHCA on the expression of P53 nucleoprotein and cytoplasmic protein Bcl-2 in cardiomyocytes.A: P53 nucleoprotein expression of cardiomyocytes in the presence(1) and the absence(2) of 1.0×1010 mmol/L AMHCA; B:cytoplasmic protein Bcl-2 expression of cardiomyocytes in the presence(1) and the absence(2) of 1.0×1010 mmol/L AMHCA. ±sE. n=4.**P<0.01 vs control.
4AMHCA对ICa-L的影响
比较AMHCA对-40 mV~+60 mV测试电压下心肌细胞ICa-L电流密度的影响。如图5所示,1.0×1010mmol/L AMHCA不增加或减少ICa-L的电流密度(n=6,P>0.05)。这提示AMHCA对细胞上L-型钙通道没有影响,不是通过该途径对胞内钙浓度进行调节。
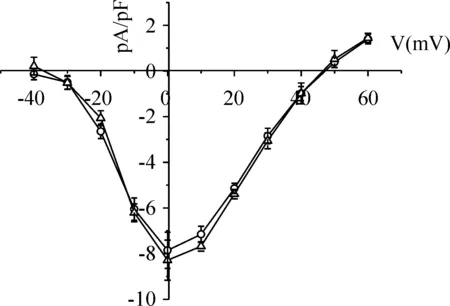
Figure 5. Effect of AMHCA on I-V relationship of ICa-L.Circle dot and triangle mark respectively represent current densities of ICa-L before and after the addition of 1.0×1010 mmol/L AMHCA.
5AMHCA对[Ca2+]i的影响
通过测定心肌细胞内FI,观察AMHCA对心肌细胞[Ca2+]i的影响。加入1.0×1010mmol/L AMHCA后,FI增加141.0%±10.56%(n=7,P<0.01),提示AMHCA能增加心肌细胞[Ca2+]i,见图6。
讨 论
本研究显示,AMHCA在急性心肌梗死的患者中不仅仅作为免疫标志物,且还能发挥病理学效应。AMHCA可以通过上调核蛋白P53、下调胞浆蛋白Bcl-2的表达来诱导大鼠心肌细胞凋亡,同时AMHCA也可以导致细胞内钙离子浓度的增加。
越来越多的证据表明,针对心肌肌球蛋白的细胞和体液免疫应答与自身免疫性心肌病及扩张型心肌病密切相关[10]。心肌炎时,由于病毒感染致心肌肌球蛋白暴露,从而使其成为一种自身抗原启动免疫应答。细胞免疫是自身免疫性心肌病及扩张型心肌病的一种重要的致病因素,而抗心肌肌球蛋白抗体也发挥了重要的作用。业已证明,抗心肌肌球蛋白抗体与慢性心肌炎和心肌病患者心功能的恶化相关[11]。此外,免疫吸附这些患者循环中的自身抗体可以改善扩张型心肌病患者的心功能。进一步的动物实验阐明了抗心肌球蛋白自身抗体在自身免疫性心脏病和扩张型心肌病中的作用。将抗心肌球蛋白单克隆抗体转输给特定品系的小鼠可导致扩张型心肌病的发生[12]。同时也观察到循环中抗心肌肌球蛋白自身抗体和IgG在心肌组织中沉积。抗心肌肌球蛋白单克隆抗体可以和β肾上腺素能受体产生交叉反应,并激动β肾上腺素能受体致心肌细胞内钙超负荷[13]。
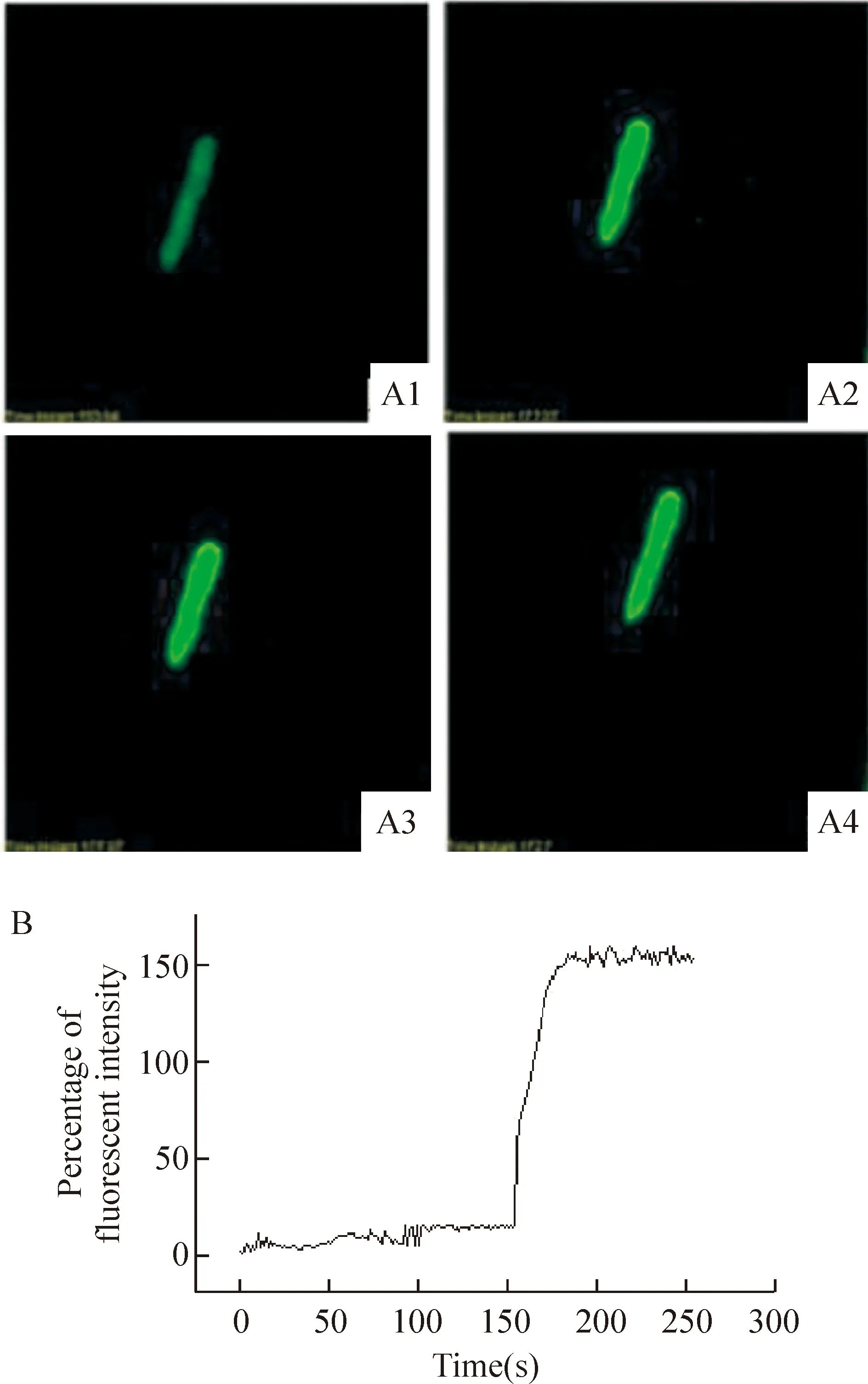
Figure 6. Effect of AMHCA on fluorescent intensity.A1: fluorescent imaging before the addition of 1.0×1010 mmol/L AMHCA; A2-A4: fluorescent imaging after the addition of 1.0×1010 mmol/L AMHCA with a scanning interval of 10 s;B: fluorescent intensity alteration curve before and after the addition of 1.0×1010 mmol/L AMHCA.
如同心肌炎和扩张型心肌病患者抗心肌肌球蛋白自身抗体的产生,急性心肌梗死的患者心肌坏死后,心肌球蛋白重链暴露诱导产生AMHCA。由于心肌球蛋白重链和β1-肾上腺素能受体分子氨基酸序列具有相似性,因此AMHCA能与β1-肾上腺素能受体结合。
心肌细胞凋亡是急性心肌梗死、心室重塑的重要病理改变,是导致心肌细胞减少的主要原因,从而造成心肌功能和结构的损害。而促凋亡基因p53表达和抑凋亡基因bcl-2表达的平衡则决定了细胞凋亡与否[14]。多种细胞内由P53激活的信号途径可以阐明依赖于P53的细胞凋亡。转录因子P53调节它的靶基因通过结合DNA共有序列和激活共有序列下游基因(包括c-myc、ICE、fas和bax)启动因子。新生大鼠心肌细胞受缺氧干预时, P53激活的p21/WAF-1/CIP-1的表达导致了细胞凋亡[15]。P53的表达也有促使细胞内钙离子增加的趋势。因此p53基因及其蛋白能加速心肌细胞凋亡。与此相反,bcl-2基因及其蛋白则有可能通过抑制P53的表达而减缓心肌细胞凋亡。大量证据表明bcl-2基因及其蛋白调节内质网的钙溢出和细胞内cGMP的浓度从而实现它的抗凋亡作用[16]。而胞浆内钙离子浓度也可调节细胞凋亡。我们的实验结果提示,AMHCA可以增加心肌细胞内钙离子浓度,从而导致细胞凋亡。本研究提示了AMHCA引起心肌细胞凋亡的一种可能机制。
总之,急性心肌梗死患者体内的AMHCA作为一种新的触发因素,可诱导心肌细胞凋亡。该研究合理地阐明了AMHCA在急性心肌梗死后的心肌凋亡中的作用和机制。这有助于阐释AMHCA阳性的急性心肌梗死患者的临床症状较重,也为在急性心肌梗死患者中检测AMHCA及以AMHCA为干预的靶点提供了实验依据。
[1] Spencer FA, Meyer TE, Goldberg RJ, et al. Twenty year trends(1975-1995) in the incidence, in-hospital and long-term death rates associated with heart failure complicating acute myocardial infarction[J]. J Am Coll Cardiol, 1999, 34(5):1378-1387.
[2] 裴汉军,宋光远,吴永健,等.糖尿病在糖尿病大鼠心肌梗死后心力衰竭形成中的效应[J].中国病理生理杂志,2009,25(6):1051-1058.
[3] Wedel H, McMurray JJV, Lindberg M, et al. Predictors of fatal and non-fatal outcomes in the controlled rosuvastatin multinational trial in heart failure(CORONA): incremental value of apolipoprotein A-1, high-sensitivity C-reactive peptide and N-terminal pro B-type natriuretic peptide[J]. Eur J Heart Fail, 2009, 11(3): 281 - 291.
[4] Feldman AM, McNamara DM. Medical progress: Myocarditis[J]. N Engl J Med, 2000, 343(19): 1388-1398.
[5] Huang K, Huang D, Fu S, et al. Abnormal calcium “Sparks” in cardiomyocytes of post-myocardial infarction heart[J]. J Huazhong Univ Sci Technolog Med Sci,2008, 28(4):401-408.
[6] Caforio AL, Tona F, Bottaro S, et al. Clinical implications of anti-heart autoantibodies in myocarditis and dilated cardiomyopathy[J]. Autoimmunity, 2008, 41(1):35-45.
[7] Warraich RS, Griffiths E, Falconar A, et al. Human cardiac myosin autoantibodies impair myocyte contractility: a cause-and-effect relationship[J]. FASEB J,2006,20(6):651-660.
[8] Pang H, Liao Y, Wang Z, et al. Effect of anti-cardiac myosin antibody on prognosis of patients with acute myocardial infarction[J]. J Tongji Med Univ, 2000, 20(1):46-48.
[9] Caforio AL, Grazzini M, Mann JM, et al. Identification of alpha- and beta-cardiac myosin heavy chain isoforms as major autoantigens in dilated cardiomyopathy[J]. Circulation, 1992, 85(5):1734-1742.
[10]Kania G, Blyszczuk P, Valaperti A, et al. Prominin-1+/CD133+bone marrow-derived heart-resident cells suppress experimental autoimmune myocarditis[J]. Cardiovasc Res, 2008, 80(2):236-245.
[11]Kuan AP, Zuckier L, Liao L, et al. Immunoglobulin isotype determines pathogenicity in antibody-mediated myocarditis in naive mice[J]. Circ Res, 2000, 86(3): 281-285.
[12]Neumann DA, Lane JR, Wulff SM, et al.Invivodeposition of myosin-specific autoantibodies in the hearts of mice with experimental autoimmune myocarditis[J]. J Immunol, 1992, 148(12): 3806-3813.
[13]Li Y, Heuser JS,Cunningham LC, et al. Mimicry and antibody-mediated cell signaling in autoimmune myocarditis[J]. J Immunol, 2006, 177(11): 8234-8240.
[14]Moll UM, Wolff S, Speidel D, et al. Transcription-independent pro-apoptotic functions of P53[J]. Curr Opin Cell Biol, 2005, 17(6):631-638.
[15]Logan IR, McNeill HV, Cook S, et al. Heat shock factor-1 modulates P53 activity in the transcriptional response to DNA damage[J]. Nucleic Acids Res, 2009, 37(9): 2962-2973.
[16]Cheng EHY, Kirsch DG, Clem RJ, et al. Conversion of Bcl - 2 to a bax- like death effector by caspases[J]. Science, 1997, 278(5345):1966 - 1968.
Anti-cardiacmyosinheavychainantibodiesisolatedfrompatientswithacutemyocardialinfarctioninduceratcardiomyocyteapoptosis
SHAO Liang, LIU Kun, WANG Li, DING Yan-ping, LIAO Yu-hua, WANG Zhao-hui
(DepartmentofCardiology,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China.E-mail:wwwzh@public.wh.hb.cn)
AIM: To study the effect of human anti-cardiac myosin heavy chain antibodies(AMHCA) on rat cardiomyocyte apoptosis.METHODSRat cardiomyocytes were isolated by the method of enzymolysis. Apoptosis of the cardiomyocytes was observed and measured by DNA end labelling and Annexin-V/PI double-staining assay. The proteins levels of apoptosis related P53 and Bcl-2 and the second messenger calcium were measured by Western blotting, patch clamp and confocal calcium imaging, respectively.RESULTSAMHCA was able to induce cardiomyocyte apoptosis in a dose dependent manner. In the presence of AMHCA, apoptosis-accelerating nucleoprotein P53 promoted myocardial apoptosis, while apoptosis-inhibiting cytoplasmic protein Bcl-2 inhibited myocardial apoptosis. Meanwhile, the concentration of cytoplasmic calcium was elevated. No effect of AMHCA on L-type calcium currents was observed.CONCLUSIONAs a novel triggering factor, AMHCA isolated from the patients with AMI induces cardiomyocyte apoptosis.
Myocardial infarction; Cardiac myosin heavy chain; Apoptosis; Protein P53; Protein Bcl-2; Calcium
R541.4
A
10.3969/j.issn.1000-4718.2011.02-001
1000-4718(2011)02-0209-06
2010-08-27
2010-10-21
国家973重点基础研究发展规划基金资助项目(No.2007CB512000;子课题No.2007CB512005)
△通讯作者 Tel:027-85726209;E-mail: wwwzh@public.wh.hb.cn

