α-硫辛酸对急性坏死性胰腺炎合并肺损伤的保护作用
孙楹 杨淑丽 叶建新 祝建红 陈卫昌
·短篇论著·
α-硫辛酸对急性坏死性胰腺炎合并肺损伤的保护作用
孙楹 杨淑丽 叶建新 祝建红 陈卫昌
重症急性胰腺炎(SAP)并发肺损伤的病理机制尚未完全阐明。目前研究认为核因子κB(NF-κB)在SAP发病过程中扮演重要角色[1]。α-硫辛酸(α-lipoic acid, ALA)属于维生素B的一类化合物,是已知抗氧化剂中作用比较广泛的一种,具有抑制NF-κB的作用,在改善人的体质、抗氧化,治疗糖尿病并发症和其他多种疾病方面备受关注[2]。本实验应用ALA干预急性坏死性胰腺炎(ANP)大鼠,观察其对ANP并发肺损伤的保护作用,探讨其可能的作用机制。
一、材料和方法
1.材料:健康Sprague-Dawley(SD)大鼠54只,清洁级,体重200~250 g,由苏州大学医学院实验动物中心提供。牛磺胆酸钠(95% )、α-硫辛酸购自美国Sigma公司,TNF-α、ICAM-1试剂盒购自上海西唐生物科技有限公司,髓过氧化物酶(myelopercxidase,MPO)试剂盒购自南京建成生物工程研究所,兔抗鼠NF-κB p65多克隆抗体购自美国Bioworld公司。
2.实验分组及模型制备:54只SD大鼠按完全随机法分为对照组、ANP组和ALA组,各18只。参照Aho等[3]的方法,采用胰胆管逆行注入5%牛磺胆酸钠(0.1 ml/l00 g体重,0.1 ml/min)制备ANP大鼠模型。ALA组在ANP造模前1 h腹腔内注射ALA(0.1 g/kg体重)。对照组开腹后仅翻动胰腺即关腹。术后3、6、12 h分批经左心室抽血,离心分离血清。将大鼠处死,分别取肺、胰腺组织,部分用10%甲醛固定,部分液氮保存。
3.观察指标和检测方法:固定的肺、胰腺组织经石蜡包埋、切片,光镜下观察组织病理学改变。应用常规免疫组化法检测肺组织NF-κB表达。每组选取5张切片,每张切片选取5个高倍视野,计数阳性细胞数。采用ELISA方法检测血清TNF-α、ICAM-1水平,严格按照试剂盒说明书操作。检测肺组织匀浆的MPO,按照试剂盒说明书操作。
二、结果
1.胰腺、肺组织病理改变:对照组大鼠胰腺及肺组织无明显变化 (图1a)。ANP组大鼠胰腺出血坏死,腹腔内有大量血性或黄色混浊腹水,大网膜及胆总管处见皂化斑(图1b)。
镜下见ANP组胰腺腺泡水肿,腺泡结构消失,叶间隔、小叶间隔及腺泡间隔显著增宽,间质内大量红细胞渗出和炎症细胞浸润,腺泡细胞呈不同程度变性、坏死,胰周出血,且随时间的延长进行性加重(图2上b);肺组织肺泡及肺间质水肿,间质内红细胞和炎性细胞渗出,随时间延长,肺泡壁破裂,肺泡塌陷实变(图2上c)。ALA组胰腺、肺组织病理变化同ANP组,但炎性细胞浸润和红细胞渗出减轻(图2下b、c)。

图1 对照组(a)和ANP组(b)胰腺的大体标本
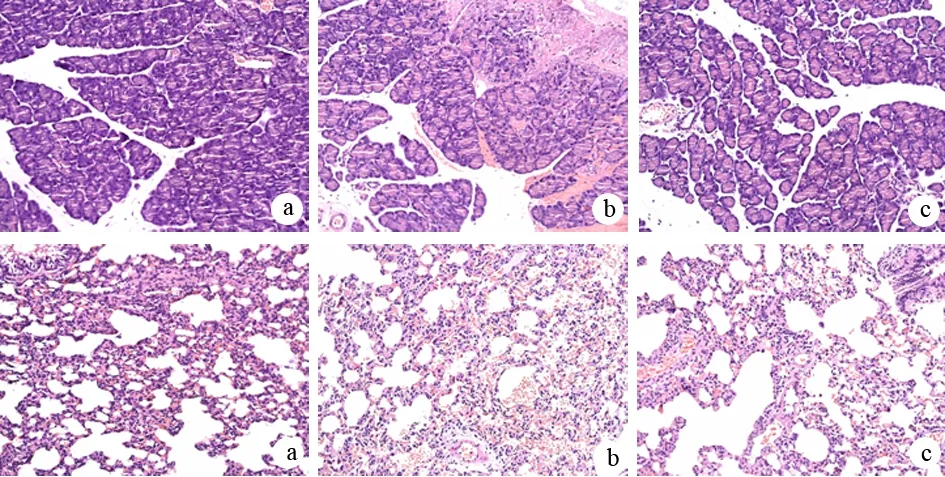
图2对照组(a)、ANP 组(b)、ALA组(c)大鼠胰腺(上)和肺组织(下)病理变化(HE ×100)
2.肺组织NF-κB表达:细胞胞质及胞核内出现均匀棕黄色细颗粒状为阳性表达。对照组肺组织仅有极少量肺泡间质细胞表达NF-κB(图3a)。ANP组肺组织NF-κB表达均较对照组明显增加,6 h达高峰,12 h仍保持较高水平。阳性染色主要位于支气管黏膜上皮细胞(图3b)。ALA组阳性细胞数低于ANP组 (图3c,表1)。
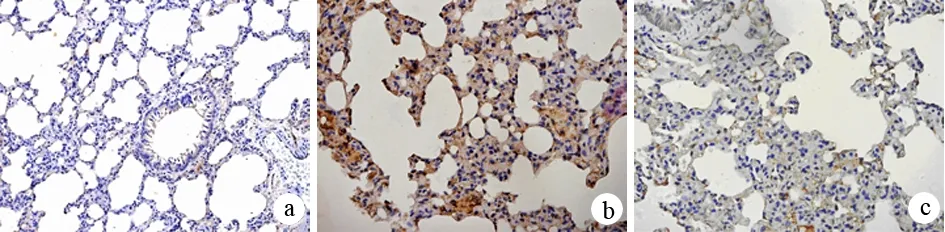
图3对照组(a)、ANP 组(b)、ALA组(c)大鼠肺组织NF-κB表达(免疫组化 ×200)
3.血TNF-α、ICAM-1水平:ANP组血TNF-α、ICAM-1水平均较对照组明显增高;ALA组血TNF-α、ICAM-1水平较ANP组显著降低(表1)。血清TNF-α、ICAM-1水平与NF-κB表达密切相关(r分别为0.629、0.834,P<0.05)。
4.肺组织MPO水平:ANP组6、12 h肺组织MPO水平明显高于对照组(P<0.05),但3 h时MPO水平与对照组无显著性差异(P=0.07),ALA组3、6、12 h肺组织MPO水平均较ANP组明显降低(P<0.05,表1)。
表1 血清TNF-α、ICAM-1及肺组织MPO、NF-κB的变化
注:与对照组比较,aP<0.05;与ANP组比较,bP<0.05
讨论研究发现,SAP时胰腺及肺组织内NF-κB激活并伴有过度活化的炎症细胞,后者可释放多种炎症介质,如TNF-α、IL-1、IL-6、细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)、氧自由基(ROS)、血小板活化因子(PAF)及P-、E-选择素等。NF-κB被激活后,进入细胞核与DNA特定的κB序列结合,使上述炎症介质和细胞因子基因转录增强,通过细胞外正反馈途径导致炎症信号进一步放大,引起细胞因子“瀑布样”级联反应,使得炎症不断扩散,胰腺及肺组织损伤加重[4]。本结果显示,ANP大鼠发病早期即观察到NF-κB的明显激活,发病6 h达峰值,与Gukovsky等[5]报道的结果一致。
MPO存在于中性粒细胞的嗜天青颗粒中,通过测定MPO的活力可推算中性粒细胞的数量,因此肺组织MPO活性常用来反映肺组织损伤的指标[6]。 本结果显示,ANP组大鼠肺组织MPO活性在造模后6 h明显增高,其后维持在高水平,提示ANP 6 h后中性粒细胞在肺组织聚集,引起肺组织损伤。
ALA是一种强抗氧化剂,能够阻断NF-κB的激活[7]。本实验应用ALA干预ANP大鼠,结果明显降低大鼠胰腺及肺组织的损伤程度,红细胞渗出及炎性细胞浸润减少,且肺组织NF-κB阳性细胞数明显减少,MPO水平亦明显下降。同时,血TNF-α、ICAM-1水平明显下降,且与NF-κB的活性呈正相关,提示ALA能阻断NF-κB的激活,减少炎症介质和细胞因子的释放,从而发挥对胰腺及肺损伤的保护作用,有望成为治疗急性胰腺炎肺损伤的新靶点。
[1] 张喜平, 陆贝.核因子-κB在重症急性胰腺炎发病过程及MODS中的作用.医学研究杂志,2006,35:83-85.
[2] Sung MJ,Kim W,Anh SY,et al.Protective effect of alpha-lipoic acid in lipopolysaccharide-induced endothelial fractalkine expression.Circ Res,2005,97:880-890.
[3] Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol, 1980,15:411-416.
[4] 孙备,白雪巍,孟庆辉,等.核转录因子抑制剂对重症急性胰腺炎的影响.中华实验外科杂志,2006,23:179-181.
[5] Gukovsky I,Gukovskaya AS,Blinman TA,et al.Early NF-kappaB activation is associated with hormoneinduced pancreatitis.Am J Physiol,1998,275:G1402-G1414.
[6] Li YQ,Zhang ZX,Xu YJ,et al.N-Acetyl-L-cysteine and pyrrolidine dithiocar-bamate inhibited nuclear factor-kappaB activation in alveolar macrophages by different mechanisms.Acta Pharmacol Sin,2006,27:339-346.
[7] Kaufmann P,Smolle KH,Brunner GA,et al.Relation of serial measurements of plasma-soluble intercellular adhesion molecule-1 to severity of acute pancreatitis.Am J Gastroenterol,1999,94:2112-2416.
2010-12-08)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2011.06.019
215006 苏州,苏州大学附属第一医院 消化科
陈卫昌,Email:weichangchen@126.com

