褪黑素对急性坏死性胰腺炎合并肾损伤的保护作用及机制研究
杨慧莹 唐国都 苏娟 覃蒙斌 梁志海 钟卫一
褪黑素对急性坏死性胰腺炎合并肾损伤的保护作用及机制研究
杨慧莹 唐国都 苏娟 覃蒙斌 梁志海 钟卫一
急性肾功能衰竭是重症急性胰腺炎(SAP)患者早期病死的主要原因之一。因此研究其发病机制并寻求有效的防治措施具有重要的临床价值。Ghrelin是生长激素促分泌物受体的内源性配体,它在急性胰腺炎(AP)发生发展中具有抑制炎症的作用。本研究应用褪黑素干预急性坏死性胰腺炎(ANP)大鼠,观察肾组织Ghrelin和NF-κB p65表达及肾组织中氧化应激相关指标的变化,探讨褪黑素对肾损伤的作用机制。
一、材料与方法
1.实验动物及分组:健康雄性SD大鼠72只,清洁级,由广西医科大学实验动物中心提供,体重180~250 g。按完全随机法分为对照组、ANP组和褪黑素干预组,每组24只。采用腹腔注射6% L-Arg溶液(1.5 g/kg体重)3次、间隔1 h的方法制备ANP模型。褪黑素组于首次注射L-Arg前30 min腹腔内注射1%褪黑素50 μg/kg体重。对照组腹腔注射等容积生理盐水。末次腹腔内注射后6、12、24 h分批处死大鼠。观察大鼠腹腔内各脏器的变化,留取胰腺及肾组织,部分用10%甲醛固定,部分置-80℃保存,取血分离血清,-20℃保存。
2.胰腺和肾组织病理学检查:由同一病理科医师光镜下观察胰腺及肾组织病理变化,分别参考Kusske等[1]和雷文章等[2]标准评分。
3.肾组织Ghrelin、NF-κB p65 mRNA表达检测:采用Trizol提取肾组织总RNA, RT-PCR检测Ghrelin、NF-κB p65 mRNA表达。依据Gene Bank设计引物。NF-κB p65引物:5′-AGCTCAAGATCTGCCGAGTA-3′,5′-GATCTGCCCAGGTGGTAACAC-3′,扩增片段556 bp,扩增条件: 94℃ 5 min,94℃ 30 s、60℃ 30 s、72℃ 45 s,共35个循环,72℃ 10 min;Ghrelin引物:5′-GTGTCTTCAGCGACTATCT-3′,5′-CCTGTCAGTGGTTACTTGTT-3′,扩增片段362 bp,扩增条件95℃ 5 min,94℃ 1 min、56℃ 40 s、72℃ 40 s,共35个循环, 72℃ 10 min;内参β-actin引物:5′-CCCATCTATGAGGGTTACGC-3′, 5′-TTTAATGTCACGCACGATTTC-3′,扩增片段150 bp。PCR产物经琼脂糖凝胶电泳后使用凝胶成像系统分析。
4.血清淀粉酶活性及IL-6水平测定:由全自动生化检测仪测定血清淀粉酶活性。应用ELISA试剂盒测定血清IL-6水平。
5.肾组织MDA、MPO、SOD含量测定:应用ELASA法测定丙二醛(MDA)、髓过氧化物酶(MPO)、超氧化物歧化酶(SOD)含量,按试剂盒说明书操作。

二、结果
1.胰腺及肾组织病理变化:对照组胰腺肉眼观无变化,镜下见胰腺腺泡结构完整。 ANP组胰腺外观为灰白色、水肿明显,部分有暗红色出血样改变;镜下见胰腺腺泡水肿,炎性细胞浸润, 腺小叶结构消失,灶性坏死、出血,病理变化随时间延长而加重。褪黑素组胰腺外观稍白,水肿,无出血样改变;镜下见腺泡轻度水肿,少量炎性细胞浸润,部分腺泡细胞坏死、出血。胰腺病理评分见表1。
对照组肾脏大体未见明显异常,镜下肾皮质、髓质结构清晰。ANP组肾脏体积略大, 12 h后外观呈暗紫色,24 h更明显;镜下见肾小球淤血,细胞肿胀,管腔扩大,部分小管上皮坏死,炎症细胞浸润,可见管型,病理变化随时间延长而加重。褪黑素组肾脏大体改变与ANP无明显差别;镜下见肾小管细胞肿胀,偶见小管上皮坏死及炎症细胞浸润。肾脏病理评分见表1。
2.血清淀粉酶及IL-6水平变化:ANP组大鼠血清淀粉酶及IL-6水平均较对照组显著升高(P值均<0.05);褪黑素组较同时点ANP组明显降低(P值均<0.05,表1)。
3.肾组织MDA、MPO、SOD含量变化:ANP组肾组织MDA、MPO含量较对照组显著升高(P值均<0.05),而SOD含量较对照组明显降低(P值均<0.05);褪黑素组肾组织MDA、MPO含量较同时间点ANP组明显降低(P值均<0.05),而SOD含量较ANP组明显升高(P值均<0.05,表1)。

表1 各组大鼠胰腺和肾脏病理评分、血清淀粉酶和IL-6含量及肾脏MDA、MPO、SOD含量变化
注:与对照组比较,aP<0.05;与ANP组比较,bP<0.05
4.肾脏Ghrelin、NF-κB p65 mRNA表达的变化: ANP组Ghrelin mRNA表达较对照组明显减少(P<0.05),且呈时间依赖性降低;褪黑素组Ghrelin mRNA表达较同时间点ANP组明显增加。ANP组NF-κB p65 mRNA表达较对照组明显增加,且呈时间依赖性;褪黑素组NF-κB p65 mRNA表达较同时间点ANP组明显降低(P<0.05,图1,表2)。
讨论目前认为细胞因子和炎症介质的持续过量释放是导致ANP持续发展并造成急性肾功能衰竭的重要原因[3]。IL-6是炎性刺激下多种细胞释放的介导急性时相反应的主要炎症因子,是早期评价AP严重程度的最佳指标[4]。NF-κB是一类主要参与机体炎性分子表达调控的转录因子,参与多种原因引起的组织损伤[5]。ANP发生后,NF-κB活化,可增强TNF-α、IL-1β等细胞因子转录,使其产生和释放增多,继而再次激活NF-κB,又使IL-6和IL-8产生和释放增多,放大最初炎症信号,产生瀑布式级联反应,造成肾脏结构及功能的损害。本实验结果显示,ANP大鼠血清IL-6大量产生,且肾脏NF-κB p65 mRNA表达也显著增加,提示IL-6及NF-κB p65参与ANP时对肾脏损伤作用的机制。
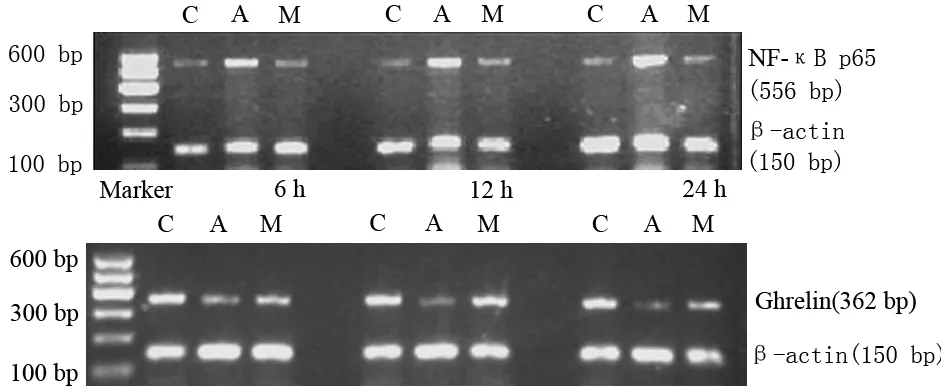
C:对照组;A:ANP组;M:褪黑素组


组 别只数时间NF⁃κBp65mRNAGhrelinmRNA对照组86h0.39±0.060.68±0.08812h0.39±0.080.66±0.06824h0.31±0.040.69±0.07ANP组86h0.57±0.06a0.48±0.05a812h0.75±0.06a0.34±0.04a824h0.79±0.04a0.29±0.04a褪黑素组86h0.47±0.04ab0.56±0.04ab812h0.58±0.07ab0.57±0.07ab824h0.45±0.05ab0.59±0.07ab
注:与对照组比较,aP<0.05;与ANP组比较,bP<0.05
MDA是脂质过氧化产物的降解产物,直接反映机体的脂质过氧化速率和强度;MPO是中性粒细胞的功能标志和激活标志,其表达水平代表着嗜中性多形核白细胞的功能和活性状态[6]。而SOD是一种重要的氧自由基清除剂[7]。ANP发生时,肾组织微循环障碍、缺血缺氧,积存在肾小管内的大量脱落上皮细胞碎片及红细胞碎片趋化大量的中性粒细胞浸润,导致大量氧自由基产生,后者通过脂质过氧化和共价键结合等作用进一步损伤肾脏结构及功能[8]。本结果显示,随着ANP的进展,肾脏MDA、MPO含量逐渐升高,而SOD含量降低,考虑可能与ANP时肾组织大量中性粒细胞浸润和脂质过氧化作用增强剂氧自由基增多大量消耗SOD有关。
Ghrelin是大鼠胃组织中发现的一种多肽[9],分布在整个胃肠道、肝脏、胰岛、肾脏中。目前不少研究证实,外源性Ghrelin在AP合并胰外器官损伤时能发挥抗炎抗氧化的保护作用[10]。本结果显示,ANP组肾脏Ghrelin mRNA表达呈时间依赖性递减,可能为ANP时大量炎症介质产生的瀑布式级联反应及脂质过氧化作用等导致了肾脏损伤,使肾脏ghrelin mRNA合成受阻。
褪黑素是松果体分泌的主要激素,能有效地清除多种氧自由基[11],抑制各种炎症介质和细胞因子的生成[12]。本结果显示,外源性给予褪黑素后ANP大鼠的肾脏病理损伤减轻,肾脏NF-κB p65 mRNA表达减少,Ghrelin mRNA表达增加,MDA、MPO含量降低,SOD含量增加,提示外源性褪黑素可能通过抑制NF-κB p65的表达,减少炎症介质和细胞因子的生成和释放,并可能通过增加Ghrelin mRNA表达,清除多种氧自由基,发挥抗氧化作用,从而减轻肾损伤。
[1] Kusske AM, Rongione AJ, Ashley SW, et al. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery, 1996,120: 284-288.
[2] 雷文章,韦靖江,沈文律,等.实验性坏死性胰腺炎多器官损害与内毒素血症的关系.中华实验外科杂志,1995,12:131-132.
[3] Makhija R, Kingsnorth AN. Cytokine storm in acute pancreatitis.J Hepatobiliary Pancreat Surg,2002, 9:401-410.
[4] Triester SL,Kowdley KV.Prognostic factors in acute pancreatitis.J Clin Gastronterol,2002,34:167-176.
[5] Antonelli A,Bianchi M,Crinelli R,et al.Modulation of ICAM-1 expression in ECV304 cells by macrophage-released cytokines.Blood Cells Mol Dis,2001,27:978-991.
[6] Sugiyama S,Kugiyama K,Aikawa M, et al. Hypochlorous acid,a macrophage product,induces endothelial apoptosis and tissue factor expression: involvement of myeloperoxidasemediated oxidant in plaque erosion and thrombogenesis.Arterioscler Thromb Vasc Biol,2004,24:1309-1314.
[7] Kushleika J,Checkoway H,Woods JS,et al.Selegiline and lymphocyte superoxide dismutase activities in Parkinson′s disease.Ann Neurol,1996,39:378-381.
[8] Closa D,Rosello-Catafau J,Martrat A,et al.Changes of systemic in prostacyclin and thromboxane A2 in sodium taurocholate and cerulein-induced acute pancreatitis in rats.Dig Dis Sci,1993,38:33-38.
[9] Kojima M, Hosoda H, Date Y,et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature,1999,402:656-660.
[10] Deboer MD, Zhu X, Levasseur PR, et al. Ghrelin treatment of chronic kidney disease: improvements in lean body mass and cytokine profile. Endocrinology,2008,149:827-835.
[11] Poeggeler B, Saarela S, Reiter RJ,et al. Melatonina-highly potent endogenous radical scavenger and electron donor: new aspects of the oxidation chemistry of this indole accessed in vitro. Ann N Y Acad Sci, 1994,738: 419-420.
[12] Duelli D,Lazebnik Y.Cell fusion:a hidden enemy? Cancer Cell,2003,3:445-448.
2010-11-11)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2011.05.022
广西自然科学基金项目(桂科自0728107)
530021 广西南宁,广西医科大学第一附属医院消化内科
唐国都,Email:tguodu02@yahoo.com.cn

