胰岛β细胞参与急性胰腺炎后胰腺再生过程的研究
胡国勇 赵严 沈杰 杨丽娟 熊杰 万荣 郭传勇 王兴鹏
·论著·
胰岛β细胞参与急性胰腺炎后胰腺再生过程的研究
胡国勇 赵严 沈杰 杨丽娟 熊杰 万荣 郭传勇 王兴鹏
目的探讨胰岛β细胞在实验性急性胰腺炎(AP)后胰腺再生过程中的作用。方法SD大鼠87只,按数字表法随机分为对照组(15只)、糖尿病组(24只)、AP组(24只)和糖尿病+AP组(24只)。采用腹腔注射链脲佐菌素(STZ,60 mg/kg体重)或左旋精氨酸(L-Arg,2.5 g/kg体重,2次)方法分别建立糖尿病和AP模型。术后1、3、5、7 d分批处死大鼠。检测血淀粉酶和血糖水平;计算胰腺湿重比;胰腺组织常规病理学检查,计算胰腺坏死面积百分比和组织转化区域百分比;免疫荧光检测胰岛β细胞的再生基因(Reg4)和胰岛素的表达。结果注射STZ后,大鼠血糖明显升高,注射L-Arg后大鼠胰腺组织水肿、坏死、炎细胞浸润,血淀粉酶明显升高,表明制模成功。制模后第3天糖尿病+AP组的胰腺坏死面积为(71.6±6.0)%,显著大于AP组的(42.3±4.0)%;第7天的组织转化面积为(45.6±5.4)%,显著小于AP组的(78.5±6.4)%。糖尿病+AP组胰岛β细胞的Reg4和胰岛素表达均较AP组明显减少。结论STZ破坏了胰岛β细胞,加重精氨酸诱导的AP的损伤,并抑制胰腺的再生过程。
急性胰腺炎; 胰岛β细胞; 胰腺再生; 再生基因4
腺泡细胞的死亡是急性胰腺炎的重要特征,在胰腺炎的发生、发展过程中起关键作用[1-2]。精氨酸诱导的急性胰腺炎(AP)腺泡细胞大量坏死,然而胰岛和胰岛周围的腺泡细胞却保留完整,提示胰岛和(或)胰岛周围的腺泡细胞具有某种机制使其免于胰腺炎引起的损伤。此外,人类慢性胰腺炎时的胰腺腺泡细胞损伤较为严重,而胰岛相对保留完整[3]。上述现象均提示胰岛参与了胰腺炎后的抗损伤和修复过程。本研究旨在观察胰岛β细胞在急性胰腺炎后的抗损伤和修复过程中的作用。
材料与方法
一、实验动物及分组
SD大鼠87只,SPF级,200~250 g, 8~9周龄,购自上海斯莱克实验动物有限公司,适应性饲养1周。实验前禁食16~18 h,自由饮水。按数字表法随机分为对照组(15只)、糖尿病组(24只)、AP组(24只)和糖尿病+AP组(24只)。以左旋精氨酸(L-Arg,Sigma公司)2.5 g/kg体重腹腔注射两次、间隔1 h的方法制备AP模型[4]。以链脲佐菌素(STZ,Sigma公司)60 mg/kg体重腹腔注射一次方法建立糖尿病模型。根据文献报道[5],STZ注射3 d后,大鼠出现糖尿病,因此糖尿病+AP组大鼠在STZ注射3 d后再注射L-Arg,故糖尿病组和糖尿病+AP组以STZ注射后第3天为制模当天。分别于制模后第1、3、5、7天称取大鼠体重,然后用3%戊巴比妥钠麻醉大鼠,心脏穿刺采血,离心分离血清;完整取出胰腺,去除血管、脂肪和肠系膜等结缔组织后,称取胰腺湿重,再置4%多聚甲醛中固定。
二、血清淀粉酶和血糖的检测
血清淀粉酶检测采用全自动生化仪(Roche公司);应用快速血糖仪检测即刻血糖水平。
三、胰腺组织湿重比
根据处死前大鼠体重和处死后的胰腺湿重,计算胰腺湿重百分比。
四、胰腺组织病理检查
将固定的胰腺组织常规脱水、包埋、石蜡切片、HE染色,光镜下检查。参考文献[6]计算胰腺坏死面积百分比,参考文献[7]计算组织转化区域百分比。
五、Reg4、胰岛素蛋白检测
采用免疫荧光方法检测。兔抗胰岛素单抗和羊抗Reg4多抗购自Santa Cruz公司,工作浓度分别为1∶200和1∶50。DyLight549-驴抗羊IgG和DyLight488-驴抗兔IgG购自Jackson Immuno Research公司,工作浓度1∶200。最后荧光显微镜观察、摄片。
六、统计学分析
结 果
一、血糖的变化
对照组和AP组大鼠实验制模当天的血糖水平分别为(8.1±1.7)、(8.3±1.2)mmol/L,两组间差异无统计学意义。糖尿病组及糖尿病+AP组的血糖水平均较对照组和AP组显著升高(P<0.01),且始终维持在高水平,其中制模后第1天的血糖水平最高(表1)。
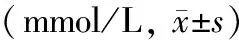
表1 各组大鼠制模后血糖的变化
注:与对照组或AP组比较,aP<0.01
二、血清淀粉酶的变化
制模后第1、3、5、7天对照组血淀粉酶水平分别为(2825±1030)、(2965±108)、(2605±91)、(2600±95)U/L;AP组为(8288±100)、(2751±114)、(2567±91)、(2523±102)U/L;糖尿病组为(2221±113)、(2370±95)、(2150±64)、(2305±107)U/L;糖尿病+AP组为(6777±65)、(1955±161)、(1817±90)、(2098±142)U/L。AP组于制模后第1天显著高于对照组(P<0.01),第3、5、7天与对照组无统计学差异;糖尿病组在每个时间点均显著低于对照组(P值均<0.05);糖尿病+AP组制模后第1天显著高于对照组(P<0.01),同时亦显著低于AP组(P<0.05),第3、5、7天显著低于对照组(P值均<0.05)。
三、胰腺湿重比
制模后第1、3、5、7天对照组的胰腺湿重比分别为(0.498±0.052)%、(0.518±0.047)%、(0.538±0.052)%、(0.569±0.032)%;糖尿病组为(0.424±0.053)%、(0.431±0.045)%、(0.462±0.029)%、(0.456±0.036)%,均显著低于对照组(P<0.05);AP组为(0.785±0.092)%、(0.509±0.042)%、(0.524±0.062)%、(0.537±0.049)%,第1天时显著高于对照组(P<0.01),以后与对照组无显著差异;糖尿病+AP组为(0.613±0.062)%、(0.389±0.037)%、(0.358±0.032)%、(0.392±0.040)%,第1天时显著高于对照组(P<0.01),第3、5、7天时显著低于对照组(P值均<0.05)。
四、胰腺病理变化
对照组大鼠胰腺组织内可见多个胰岛细胞团,胰岛边缘规整,细胞排列整齐,核呈圆形或椭圆形,染色质丰富均匀。糖尿病组和糖尿病+AP组依稀可见1~2 个胰岛细胞团,胰岛边缘不规整,细胞排列紊乱,胞核固缩、碎裂,呈多边形,染色质不均匀,有凋亡征象。AP组第1、3天时可见腺泡细胞坏死和炎性细胞浸润,随后出现导管复合体,第7天时导管复合体逐渐被腺泡细胞所取代;而糖尿病+AP组第1、3天时胰腺腺泡细胞坏死和炎性细胞浸润较AP组明显加重,第7天时纤维组织沉积,分割胰腺小叶,小叶内大量导管复合体持续存在(图1)。对照组及糖尿病组胰腺坏死面积为3%~4%,无组织转化。AP组1、3 d的的坏死面积为(54.3±4.6)%和(42.3±4.0)%;5、7 d的组织转化面积为(38.5±4.3)%和(78.5±6.4)%。糖尿病+AP组1、3 d的坏死面积为(65.1±7.0)%和(71.6±6.0)%,显著大于AP组(P值均<0.05);5、7 d的组织转化面积为(15.3±2.4)%和(45.6±5.4)%,显著小于AP组(P值均<0.05)。
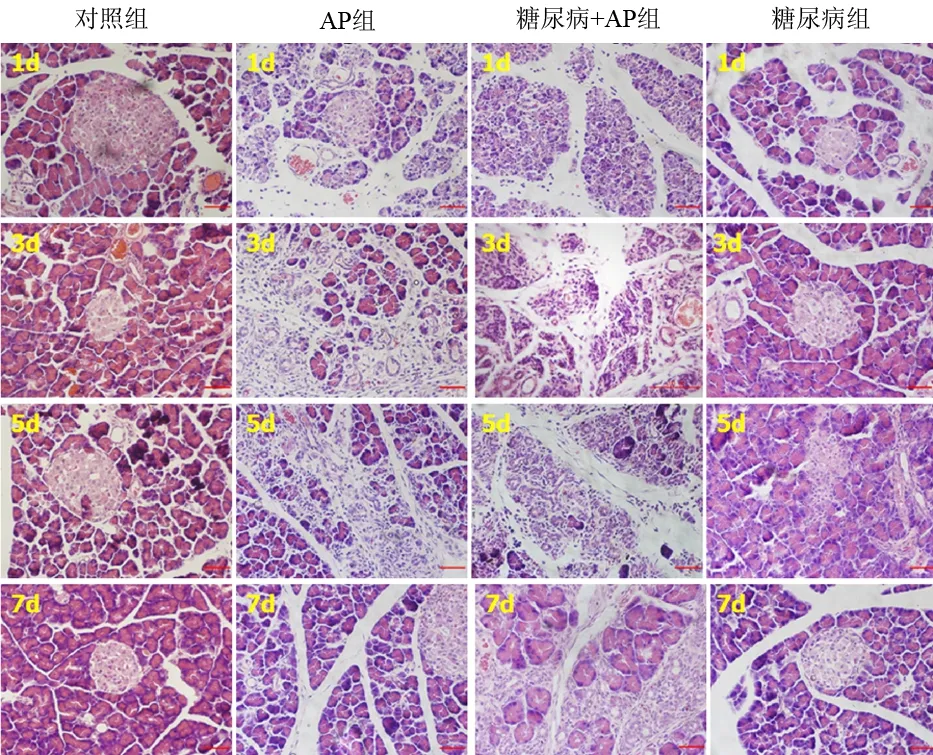
图1 各组胰腺组织病理学改变(HE ×100)
五、胰岛β细胞胰岛素及Reg4表达的变化
糖尿病大鼠胰腺胰岛细胞的胰岛素表达明显减少;AP组胰岛细胞胰岛素的表达无明显改变,且同时表达Reg4和胰岛素;糖尿病+AP组胰岛细胞中Reg4和胰岛素均明显减少(图2)。
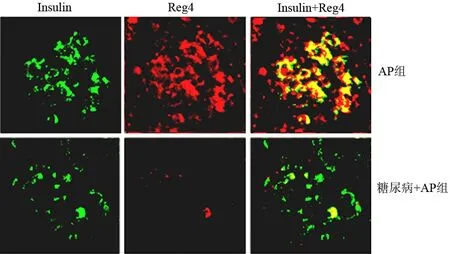
图2AP组和糖尿病+AP组大鼠的胰岛Reg4和胰岛素表达(免疫荧光 ×200)
讨 论
许多研究表明,精氨酸能够诱导胰腺腺泡细胞的坏死和炎性细胞浸润,然而胰岛和胰岛周围的腺泡细胞却保留完整[6-8]。本研究也发现相似的现象,同时精氨酸诱导胰腺腺泡细胞损伤后,出现了一个胰腺自身修复和再生过程,即大量导管复合体的短暂形成,随后导管复合体迅速消失,并被再生的腺泡细胞逐渐取代。Hegyi等[9]研究发现,CCK(cholecystokinin)类似物能够促进胰腺的再生过程。Takacs等[10]研究也发现CCK-8能够加速精氨酸诱导的胰腺炎后的再生过程,但不能促进糖尿病大鼠胰腺炎后胰腺的再生过程,提示CCK-8促进胰腺的再生需要胰岛素来介导。以上结果提示,胰岛细胞可能在精氨酸诱导的胰腺炎后的再生过程中起了重要的作用。
本实验应用链脲佐菌素(STZ)选择性破坏胰岛的β细胞后,大鼠血糖明显上升,血清淀粉酶低于正常对照组,而且胰腺重量明显低于对照组,提示胰岛细胞分泌的激素参与了胰腺腺泡细胞的生长以及胰酶的合成。尽管AP组大鼠在第1天时淀粉酶高于糖尿病+AP组,但病理损伤较该组有所减轻,可能由于胰岛素表达降低而导致淀粉酶的合成减少。在正常胰腺组织中,Reg4仅表达于胰岛细胞中,而在STZ诱导的糖尿病大鼠中,不仅胰岛素在胰岛中的表达明显下降,而且Reg4在胰岛中的表达也明显减少,提示Reg4可能由胰腺的β细胞所产生。Reg1是最早发现的Reg家族成员,特异性表达于再生的胰岛中[11]。随后研究发现[12-13],Reg1蛋白能够促进β细胞的增殖从而降低90%胰腺切除和NOD糖尿病模型鼠的血糖水平。Reg4与Reg1为同一家族成员,是否有相似的作用有待于进一步的研究。
本研究还发现,STZ诱导的糖尿病大鼠加重了精氨酸诱导的胰腺损伤,同时也抑制了AP后胰腺自身的修复和再生过程。由于胰岛素能够促进腺泡细胞的生长和胰酶的合成[14],因此其机制可能部分与胰岛素的分泌减少有关。此外,除胰岛素外,胰岛β细胞还可能分泌其他的因子(如可能包含Reg4),这些因子也可能参与了AP后胰腺的修复和再生过程。结合我们以前的研究结果[15],重组Reg4蛋白能够减轻精氨酸诱导的胰腺损伤,提示胰岛β细胞通过分泌Reg4参与了胰腺炎后的抗损伤和修复过程。由于胰岛细胞能够分泌多种因子,因此胰岛/Reg4轴在AP后胰腺再生过程中的作用有待进一步的研究。
[1] Gukovskaya AS, Pandol SJ. Cell death pathways in pancreatitis and pancreatic cancer. Pancreatology, 2004, 4: 567-586.
[2] Pandol SJ, Saluja AK, Imrie CW, et al. Acute pancreatitis: bench to the bedside. Gastroenterology, 2007, 132: 1127-1151.
[3] Bateman AC, Turner SM, Thomas KS, et al. Apoptosis and proliferation of acinar and islet cells in chronic pancreatitis: evidence for differential cell loss mediating preservation of islet function. Gut, 2002, 50: 542-548.
[4] Toma H, Winston J, Micci MA, et al. Nerve growth factor expression is up-regulated in the rat model of L-arginine-induced acute pancreatitis. Gastroenterology, 2000, 119: 1373-1381.
[5] Karunanayake EH, Hearse DJ, Mellows G. The metabolic fate and elimination of streptozotocin. Biochem Soc Trans, 1975, 3: 410-414.
[6] Tani S, Itoh H, Okabayashi Y, et al. New model of acute necrotizing pancreatitis induced by excessive doses of arginine in rats. Dig Dis Sci, 1990, 35: 367-374.
[7] Mizunuma T, Kawamura S, Kishino Y. Effects of injecting excess arginine on rat pancreas. J Nutr, 1984, 114: 467-471.
[8] Dawra R,Sharif R,Phillips P,et al.Development of a new mouse model of acute pancreatitis induced by administration of L-arginine. Am J Physiol Gastrointest Liver Physiol,2007,292:G1009-G1018.
[9] Hegyi P, Takacs T, Jarmay K, et al. Spontaneous and cholecystokinin-octapeptide-promoted regeneration of the pancreas following L-arginine-induced pancreatitis in rat. Int J Pancreatol, 1997, 22: 193-200.
[10] Takacs T, Hegyi P, Jarmay K, et al. Cholecystokinin fails to promote pancreatic regeneration in diabetic rats following the induction of experimental pancreatitis. Pharmacol Res, 2001, 44: 363-372.
[11] Terazono K, Yamamoto H, Takasawa S, et al. A novel gene activated in regenerating islets. J Biol Chem, 1988, 263: 2111-2114.
[12] Gross DJ, Weiss L, Reibstein I, et al. Amelioration of diabetes in nonobese diabetic mice with advanced disease by linomide-induced immunoregulation combined with Reg protein treatment. Endocrinology, 1998, 139: 2369-2374.
[13] Watanabe T, Yonemura Y, Yonekura H, et al. Pancreatic beta-cell replication and amelioration of surgical diabetes by Reg protein. Proc Natl Acad Sci USA, 1994, 91: 3589-3592.
[14] Patel R, Singh J, Yago MD, et al. Effect of insulin on exocrine pancreatic secretion in healthy and diabetic anaesthetised rats. Mol Cell Biochem, 2004, 261: 105-110.
[15] Hu G, Shen J, Cheng L, et al. Reg4 protects against acinar cell necrosis in experimental pancreatitis. Gut, 2011, 60: 820-828.
2011-03-01)
(本文编辑:吕芳萍)
Involvementofpancreaticbetacellinpancreaticregenerationfollowingexperimentalacutepancreatitis
HUGuo-yong,ZHAOYan,SHENJie,YANGLi-juan,XIONGJie,WANRong,GUOChuan-yong,WANGXing-peng.
DepartmentofGastroenterology,ShanghaiTenthPeople′sHospital,SchoolofMedicine,TongjiUniversity,Shanghai200072,China
WANGXing-peng,Email:wangxp1965@yahoo.com.cn
ObjectiveTo investigate the role of pancreatic β cell on pancreatic regeneration following experimental acute pancreatitis.MethodsEighty-seven SD male rats were randomly divided into four groups: control group (n=15), STZ group (n=24), L-Arg group (n=24), STZ+Arg group (n=24). 60 mg/kg of STZ was administrated by intraperitoneal injection to induce the diabetes model. 2.5 g/kg body weight of L-Arg was administrated by intraperitoneal injection to induce the acute pancreatitis model. The rats were sacrificed 1, 3, 5, 7 d later and the serum levels of amylase and glucose were measured. Relative pancreatic weight (pancreatic weight/body weight) were measured. Pancreatic tissue underwent routine pathologic examination, and the percentage of area of necrosis and tissue transformation was calculated. The expression of Reg4 and insulin was performed by immunofluorescence.ResultsSerum level of glucose significantly increased after STZ injection. After L-Arg injection, serum level of amylase significantly increased, and there was pancreatic tissue edema, necrosis, infiltration of inflammatory cells, which suggested the successful model induction. The percentage of area of necrosis in STZ+L-Arg group was (71.6±6.0)% at the 3rd day, which were significantly higher than (42.3±4.0)% in L-Arg group; the percentage of area of transformation was (45.6±5.4)%, which were significantly lower than (78.5±6.4)% in L-Arg group. Expression of Reg4 in pancreatic islets of STZ+L-Arg group was significantly lower than those in L-Arg group.ConclusionsSTZ impairs pancreatic β cells, aggravates pancreatic damage following L-arginine induced pancreatitis and inhibits pancreatic regeneration.
Acute pancreatitis; Pancreatic beta Cells; Pancreatic regeneration; Reg4
10.3760/cma.j.issn.1674-1935.2011.05.018
教育部高等学校博士学科点专项科研基金(09DZ1906904);上海市科技创新行动计划重点项目(09JC412100)
200072 上海,同济大学附属第十人民医院 上海市第十人民医院消化内科(胡国勇、赵严、沈杰、杨丽娟、熊杰、万荣、郭传勇、王兴鹏)
王兴鹏,Email:wangxp1965@yahoo.com.cn

