整合素β1基因沉默对胰腺癌细胞PANC1体外侵袭能力的影响及机制研究
禹峰 步雪峰 李华 张拥军 王春友 崔静
·论著·
整合素β1基因沉默对胰腺癌细胞PANC1体外侵袭能力的影响及机制研究
禹峰 步雪峰 李华 张拥军 王春友 崔静
目的应用短发夹RNA(shRNA)沉默人胰腺癌细胞株PANC1的整合素β1(integrinβ1)基因表达,观察其对PNAC1细胞体外侵袭能力的影响,探讨其机制。方法构建靶向integrinβ1基因的shRNA真核表达质粒integrinβ1-shRNA及对照真核表达质粒c-shRNA,转染人胰腺癌PANC1细胞,以未转染质粒的细胞作为对照组。应用实时荧光定量PCR和蛋白质印迹法检测integrinβ1、MMP-2、MMP-9 mRNA和蛋白的表达水平,应用Transwell侵袭小室检测细胞体外侵袭能力。结果integrinβ1-shRNA组、c-shRNA组和对照组细胞integrinβ1 mRNA表达量分别为0.0029±0.0004、0.0131±0.0009、0.0138±0.0005; integrinβ1蛋白表达量为0.0159±0.0062、0.3215±0.0126、0.3107±0.0094。integrinβ1-shRNA组integrinβ1 mRNA和蛋白表达抑制率分别为(78.6±7.2)%和(92.9±3.2)%(P<0.01)。而c-shRNA组与对照组差异无统计学意义(P=0.2999)。integrinβ1-shRNA组穿膜细胞数由(52±5)个降低至(21±4)个(P<0.01);MMP-2和MMP-9 mRNA表达分别从0.592±0.073和0.847±0.069降低到0.102±0.034和0.273±0.071;MMP-2和MMP-9蛋白表达分别从0.225±0.046和0.416±0.081降低到0.059±0.013和0.106±0.022(P值均<0.05)。结论重组质粒integrinβ1-shRNA能有效地抑制PANC1细胞integrinβ1基因的表达,并可能通过下调MMP-2和MMP-9基因表达而抑制其体外侵袭能力。
胰腺肿瘤; 整合素β1; shRNA; 肿瘤侵润
胰腺癌早期发生局部播散和远处转移是影响预后的主要因素[1]。整合素β1(integrinβ1)是细胞黏附分子家族中的一员,在细胞间、细胞与细胞外基质间的黏附及信息传递中起到重要作用。近年研究发现,肿瘤细胞内integrin β1表达上调是影响肿瘤侵袭转移表型的分子学改变之一[1]。本实验构建靶向integrinβ1的shRNA真核表达质粒,观察其转染胰腺癌PANC1细胞后对细胞体外侵袭能力的影响,探讨其作用机制。
材料和方法
一、重组质粒构建与鉴定
真核表达质粒载体pGC-silencer-CRM30购于上海吉凯公司,含CMV启动子,编码GFP报告基因和neo抗性基因。靶向integrinβ1(NM_004763.3)的shRNA序列为5′-ATGGGACACGGGTGAAAATTT-3′(572-592),携带GFP的对照shRNA(c-shRNA)序列为5′-CTTACGCTGAGTACTTCGA-3′,均由上海吉凯公司合成。单链DNA片段经95℃退火5 min形成互补双链DNA,应用T4DNA连接酶(Promeg公司)连接至经BamHⅠ和Hind Ⅲ(TaKaRa公司)双酶切线性化的pGC-silencer-CRM30,转化感受态DH-5大肠杆菌,通过卡那霉素筛选扩增。抽提菌液中质粒DNA,BamHⅠ和HindⅢ双酶切及测序鉴定。
二、细胞培养和质粒转染
胰腺癌PANC1细胞株系本院普外科实验室保存,常规培养传代。取对数生长期细胞,以每孔2×105个细胞接种6孔板,培养24 h后分为对照组、c-shRNA质粒组和integrinβ1-shRNA质粒组。用250 μl OPTI-MEM培养基分别稀释10 μl Lipofecta-mineTM2000(Invitrogen公司)和4.0 g质粒,置室温5 min,两液混匀置室温20 min,均匀滴加于PANC1细胞。培养6 h后更换完全培养基。48 h后用含G418 600 g/ml的完全培养基筛选稳定转染细胞2周。稳转细胞分别命名为integrinβ1-shRNA细胞和C-shRNA细胞。对照组细胞常规培养。
三、细胞侵袭能力检测
采用Transwell侵袭小室(Chemicon公司)。将对照组、c-shRNA组和integrinβ1-shRNA组细胞分别用无血清培养基制成1×106/ml细胞悬液,分别加入上室,每室100 μl,下室加入600 μl完全培养基。孵育48 h后,用棉签擦尽上室细胞和基质胶,4%多聚甲醛固定,苏木素染色,400倍光镜下随机计数5个视野的平均穿膜细胞数。实验重复3次。
四、integrinβ1、MMP-2、MMP-9 mRNA表达检测
采用实时PCR法检测。应用Trizol提取三组细胞总RNA,逆转录成cDNA。integrinβ1上游5′-TGTTCAGTGCAGAGCCTTCA-3′,下游5′-CCTCAT-ACTTCGGATTGACC-3′,扩增片段452 bp;MMP-2上游5′-GGTGCCCAAGAATAGATG-3′,下游5′-GTG-AAGTCCGAGAAGAGGA-3′,扩增片段159 bp;MMP-9上游5′-GCCCGTGAGTGGAGATGA-3′,下游5′-GGAAGGATAGGGATAAGTGT-3′,扩增片段226 bp;内参GAPDH上游5′-TGTTGCCATCAATGACCCCTT-3′,下游5′-CTCCACGACGTACTCAGCG-3′,扩增片段202 bp。PCR反应条件:94℃ 5 min,94℃ 30 s、58℃ 30 s、72℃ 30 s, 45个循环,最后 72℃ 10 min,在延伸过程中搜集产物荧光信号。采用荧光PCR仪自带分析程序获取Ct值。目的基因mRNA相对表达量=2-ΔΔCt。
五、integrinβ1、MMP-2、MMP-9蛋白表达检测
以冰PBS洗涤细胞后收集细胞,加入预冷细胞裂解液,冰上静止10 min,4℃、离心取上清液,常规行蛋白质印迹法检测蛋白表达。兔抗人Integrinβ1多抗购自美国R&D公司;鼠抗GAPDH单抗,兔抗MMP-2、MMP-9多抗,辣根过氧化物酶(HRP)标记二抗均购自武汉博士德公司。最后ECL发光。扫描各条带灰度值。以各组目的蛋白与自身GAPDH灰度值比值作为蛋白的相对表达量。实验重复3次。
六、统计学方法
结 果
一、重组质粒鉴定与转染
抽提的菌液中重组质粒经BamHⅠ和HindⅢ双酶切后,得到900 bp左右DNA 片断,测序结果显示插入片断序列与实验设计寡核苷酸序列相符(图1),证实integrinβ1-shRNA和c-shRNA真核表达质粒构建成功。稳定转染c-shRNA和integrinβ1-shRNA的细胞在形态上与PANC1细胞无明显差异(图2)。
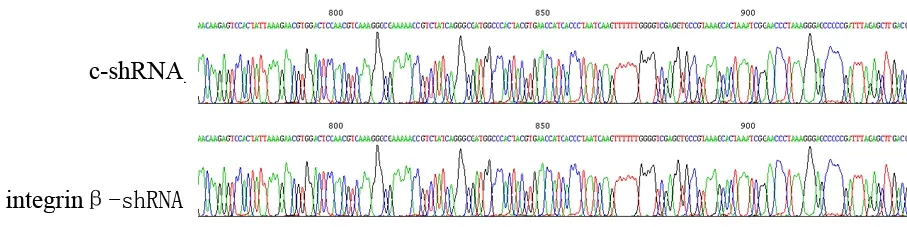
图1c-shRNA和integrinβ1-shRNA真核表达质粒测序结果

图2PANC1细胞和c-shRNA、integrinβ1-shRNA PANC1细胞在光镜(上)和荧光显微镜(下)下形态(×200)
二、PANC1细胞integrinβ1 mRNA和蛋白表达的变化
integrinβ1-shRNA组、c-shRNA组和对照组细胞
integrinβ1 mRNA表达量分别为0.0029±0.0004、0.0131±0.0009、0.0138±0.0005; integrinβ1蛋白表达量为0.0159±0.0062、0.3215±0.0126、0.3107±0.0094(图3)。integrinβ1-shRNA组细胞integrinβ1 mRNA和蛋白表达抑制率分别为(78.6±7.2)%和(92.9±3.2)%,与对照组的差异有统计学意义(P<0.01)。而c-shRNA组与对照组差异无统计学意义(P=0.2999)。

图3 PANC1细胞integrinβ1蛋白的表达
三、PANC1细胞体外侵袭能力的变化
integrinβ1-shRNA组、c-shRNA组和对照组的穿膜细胞数分别为(21±4)、(47±8)、(52±5)个,integrinβ1-shRNA组细胞侵袭力显著降低(P<0.01),而对照组与c-shRNA组间差异无统计学意义(P=0.2705)。
四、PANC1细胞MMP-2、MMP-9 mRNA和蛋白表达的变化
与对照组细胞相比,integrinβ1-shRNA组细胞的MMP-2和MMP-9的mRNA和蛋白表达水平均明显下降(P<0.05),而c-shRNA组细胞无显著变化(P=0.9285,表1)。

表1 各组细胞MMP-2、MMP-9 mRNA和蛋白的表达
注:与对照组比较,aP<0.05
讨 论
肿瘤侵袭转移是一个多因素、多步骤共同作用的连续过程,其中肿瘤细胞与细胞外基质(extracellular matrix,ECM)的黏附是发生侵袭转移的首要步骤[2]。整合素(integrins)作为ECM的受体,通过介导细胞与细胞、细胞与ECM间识别并结合,在肿瘤的侵袭转移过程中起到重要的作用。integrins是由α和β两个亚基组成的异二聚体,参与细胞的多种生理功能和病理过程[3]。其β1亚基可分别与α1、α5、αv等亚基组合构成相应的integrinβ1分子,与其配体Ⅳ型胶原蛋白、纤维黏素(FN)和层黏连蛋白(LN)等结合,调节多种细胞功能及肿瘤细胞的侵袭转移。integrinβ1高表达或活性增强可促进肿瘤细胞侵袭转移。Sawai等[4]报道,integrinβ1表达与胰腺癌的TNM 分期、肝转移及预后呈正相关。本实验将靶向integrin β1的shRNA插入到pGC-silencer-CRM30质粒,并转染人胰腺癌PANC1细胞,结果显示,integrinβ1-shRNA质粒转染的PANC1细胞的integrinβ1 mRNA及蛋白表达水平显著被抑制,细胞的侵袭能力显著下降。
MMP-2和MMP-9是MMPs家族重要成员之一,属锌离子依赖性明胶酶,参与ECM降解过程,其表达增高是肿瘤细胞迁移、浸润基质的前提,与肿瘤细胞侵袭性密切相关[5-6]。有研究发现[7],integrinβ1不仅能够增强MMP-2和MMP-9 mRNA的稳定性,而且能上调其表达;若失去integrinβ1的作用,其mRNA将很快降解,不能翻译成蛋白产物。本实验结果显示,转染后细胞的MMP-2和MMP-9表达水平显著降低,提示integrinβ1参与胰腺癌侵袭转移的过程可能与其下调MMPs的表达相关。
[1] Pawelek JM, Chakraborty AK. The cancer cell-leukocyte fusion theory of metastasis. Adv Cancer Res, 2008,101:397-444.
[2] Kerkelä E, Saarialho-Kere U. Matrix metalloproteinases in tumor progression: focus on basal and squamous cell skin cancer. Exp Dermatol,2003,12:109-125.
[3] Eble JA, Haier J. Integrins in cancer treatment. Curr Cancer Drug Targets,2006,6:89-105.
[4] Sawai H, Okada Y, Funahashi H, et al. Integrin-linked kinase activity is associated with interleukin-1 alpha-induced progressive behavior of pancreatic cancer and poor patient survival. Oncogene,2006,25:3237-3246.
[5] Soreide K, Janssen EA, Körner H, et al. Trypsin in colorectal cancer: molecular biological mechanisms of proliferation, invasion, and metastasis.J Pathol,2006,209:147-156.
[6] 吴泽宇,李靖华,詹文华,等.胃癌组织中MMP-2和E-cadherin的表达及意义.中华消化外科杂志,2007,6:61-63.
[7] Chung A, Gao Q, Kao WJ. Macrophage matrix metalloproteinase-2/-9 gene and protein expression following adhesion to ECM-derived multifunctional matrices via integrin complexation. Biomaterials,2007,28:285-298.
2010-11-01)
(本文编辑:屠振兴)
Effectsofintegrinβ1genesilencingoninvasionofhumanpancreaticcancercellsPANC1
YUFeng,BUXue-feng,LIHua,ZHANGYong-jun,WANGChun-you,CUIJing.
DepartmentofGeneralSurgery,People′sHospital,JiangsuUniversity,Zhenjiang212002,China
YUFeng,Email:yfengyfeng@126.com
ObjectiveTo investigate the effects of integrin β1 gene expression inhibited by short hairpin RNA (shRNA) on invasion of pancreatic carcinoma PANC1 cells in vitro, and investigate the mechanism.MethodsThe eukaryotic expression plasmid of shRNA targeting integrin β1 gene (integrin β1 shRNA) and control eukaryotic expression plasmid shRNA (c-shRNA) was constructed and was transfected into PANC1 cells. The cells without plasmid transfection were used as control. The expressions of integrinβ1, MMP 2, MMP 9 mRNA and protein were detected by real-time PCR and Western blotting. The invasive ability of PANC1 cells was observed with Transwell cell culture chamber.ResultsIntegrinβ1 mRNA expressions in integrinβ1 shRNA group, c-shRNA group and control group were 0.0029±0.0004, 0.0131±0.0009, 0.0138±0.0005; the expressions of integrinβ1 protein were 0.0159±0.0062, 0.3215±0.0126, 0.3107±0.0094; the inhibitory rate of integrinβ1 mRNA and protein expression in integrinβ1 shRNA group was (78.6±7.2)% and (92.9±3.2)% (P<0.01). But there was no difference between the c-shRNA group and control group (P=0.2999). Number of penetrating cells in integrinβ1 shRNA group decreased from 52±5 to 21±4 (P<0.01); the expression of MMP2 and MMP 9 mRNA decreased from 0.592±0.073, 0.847±0.069 to 0.102±0.034, 0.273±0.071; the expression of MMP2 and MMP 9 protein decreased from 0.225±0.046, 0.416±0.081 to 0.059±0.013, 0.106±0.022(P<0.05).ConclusionsRecombinant integrinβ1 shRNA expression plasmid can effectively inhibit the expression of integrinβ1 gene and suppress the invasion of PANC1 cells in vitro by down-regulating MMP 2 and MMP 9 gene expression.
Pancreatic neoplasms; Integrinβ1; Short hairpin RNA; Neoplasm invasiveness
10.3760/cma.j.issn.1674-1935.2011.04.006
212002 江苏镇江,江苏大学附属人民医院普外科(禹峰、步雪峰、李华、张拥军); 华中科技大学同济医学院附属协和医院胰腺外科(王春友、崔静)
禹峰,Email:yfengyfeng@126.com

