MEK通路抑制剂对人胰腺癌细胞生长及细胞周期相关抑癌基因表达的影响
王霞 王晖 蒋楠 梁三红 吕文 张啸 张筱凤
·论著·
MEK通路抑制剂对人胰腺癌细胞生长及细胞周期相关抑癌基因表达的影响
王霞 王晖 蒋楠 梁三红 吕文 张啸 张筱凤
目的观察细胞外信号调节激酶信号通路(MEK)抑制剂对人胰腺癌细胞生长及细胞周期相关的抑癌基因表达的影响。方法培养人胰腺癌细胞系CFPAC1、PANC1和MiaPaCa2,应用50 μmol/L的MEK抑制剂PD98059处理细胞24 h,四甲基偶氮唑蓝(MTT)法检测细胞增殖,流式细胞仪分析细胞周期,实时定量PCR法检测p16INK4a、p21WAF1和p27KIP1mRNA的表达,蛋白质印迹法检测DNA甲基化酶(Dnmt)1、3a和3b表达,甲基化特异性PCR(MSP)分析p16INK4a基因启动子甲基化状况。结果PD98059处理24 h 后,CFPAC1、PANC1和MiaPaCa2细胞的增殖抑制率分别为69%、78%和45%; G0/G1期细胞比例分别从(68.21±0.73)%、(56.54±0.68)%、(54.89±0.79)%增加到(80.37±0.65)%、(72.05±0.52)%、(79.21±0.93)%(P值均<0.05);S期和G2/M期细胞比例相应减少。PD98059处理后,CFPAC1、PANC1细胞p27KIP1、p21WAF1和p16INK4amRNA表达增加, Dnmt1和Dnmt3b蛋白表达减少;p16INK4a启动子甲基化状态被去除。而MiaPaCa2细胞仅p27KIP1mRNA表达增加;p21WAF1、p16INK4amRNA和Dnmt表达均无明显变化。结论MEK通路抑制剂可能通过下调DNA甲基化酶、上调细胞周期相关抑癌基因表达而抑制胰腺癌细胞周期进展和细胞增殖。
胰腺; 肿瘤细胞系; MEK抑制剂; 细胞周期; DNA甲基化酶; 抑癌基因
胰腺癌中RAS基因突变率高达70%~90%,可引起细胞外信号调节激酶信号通路(MEK)转导异常,癌基因激活,抑癌基因失活。因此抑制MEK信号通路是抗肿瘤治疗的潜在靶点[1-2]。本实验应用MEK抑制剂PD98059干预人胰腺癌细胞株,观察其对细胞增殖、细胞周期及相关抑癌基因表达的影响,探讨其分子机制。
材料与方法
一、细胞生长及增殖抑制率检测
人胰腺癌细胞系CFPAC1、PANC1和MiaPaCa2均购自中科院上海细胞生物学研究所。收集对数生长期细胞,制备成5×104/ml的单细胞悬液,以1×105个细胞/孔接种于6孔板,分为2组,分别加入含终浓度为50 μmol/L的MEK抑制剂PD98059(美国Sigma公司,药物组)和700 nmol/L DMSO(对照组)的培养液,培养后第2、4、6天随机取3孔采用血细胞计数器计数细胞,绘制生长曲线。另取5×104/ml的单细胞悬液接种于96孔培养板,100 μl/孔,给予PD98059或DMSO培养24 h后各孔加入浓度为5 mg/ml的MTT 10 μl,37℃孵育4 h,再加入100 μl DMSO,酶标仪测定各孔570 nm处吸光度(A)值。细胞生长抑制率(%)=(1-药物组A570值/对照组A570值)×100%。每组5个复孔,实验重复3次。
二、细胞周期检测
取对数生长期细胞,应用无血清RPMI 1640培养基培养16~24 h以同步化。分别用PD98059或DMSO干预24 h,收集各组细胞,制成1×106/ml的单细胞悬液。取2 ml细胞悬液用70%冷乙醇固定。去乙醇,加入含1% RNase的Tris-HCl缓冲液孵育10 min,用碘化丙啶染色,流式细胞仪检测细胞周期。实验重复3次。
三、p16INK4a、p21WAF1和p27KIP1mRNA检测
取干预24 h的各组细胞, 应用Trizol法提取细胞总RNA。先逆转录成cDNA,然后行实时荧光定量PCR检测p21WAF1、p16INK4a和p27KIP1mRNA表达。各引物和探针序列以及基因登序号同参考文献[3]。探针和引物由上海基康生物公司合成。反应条件:93℃ 15 s,60℃ 1 min,40个循环。每个样品设3个复孔。通过PCR仪自带软件获取Ct值。以β-actin作为内参照,对照组细胞Ct值为基准,计算PD98059组细胞mRNA的表达倍数(N)。N=2-(药物△Ct-对照△Ct),药物△Ct-对照△Ct=(药物Ct-β-actin Ct)-(对照Ct-β-actin Ct)。N≥3为表达增强,N≤0.33为表达减弱[4]。
四、DNA甲基化酶(Dnmt)检测
将各组细胞置裂解缓冲液[20 mmol/L Tris-HCl(pH7.7)、250 mmol/L NaCl、2 mmol/L EDTA、0.5%NP-40、10%甘油、20 mmol/L β-甘油磷酸、1 mmol/L Na3VO4]裂解30 min,离心后取上清。取100 μg 蛋白行蛋白质印迹术,以GAPDH为内参照。抗Dnmt1、3a和3b抗体(BD公司和Sant Crue公司)1∶500稀释, HRP标记二抗1∶1000稀释,最后ECL发光。每组实验重复3 次。
五、DNA甲基化状态分析
取各组细胞DNA,按照Gysin等[5]方法以亚硫酸氢钠处理DNA,采用甲基化特异性PCR分析p16INK4a基因启动子区甲基化状态。引物序列及反应条件参考文献[6],由上海生工公司合成。
六、统计学处理
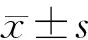
结 果
一、胰腺癌细胞生长、增殖和细胞周期的变化
PD98059可明显抑制人胰腺癌细胞系CFPAC1、PANC1和MiaPaCa2细胞的生长(图1)。药物干预24 h后,CFPAC1、PANC1和MiaPaCa2细胞的增殖抑制率分别为69%、78%和45%。3株细胞系的G0/G1期细胞比例均明显升高,而S期细胞数比例降低(表1)。

图1 PD98059对人胰腺癌细胞生长抑制作用

细胞系PD98059干预组G0/G1SG2/MDMSO对照组G0/G1SG2/MCFPAC180.37±0.65a6.92±0.14a12.54±0.2368.21±0.7313.46±0.3118.52±0.33PANC172.05±0.52a5.13±0.09a24.82±0.3956.54±0.6814.31±0.2929.15±0.41MiaPaCa279.21±0.93a7.35±0.32a13.45±0.4154.89±0.7925.13±0.1711.03±0.26
注:与对照组比较,aP<0.05
二、细胞周期相关抑癌基因的mRNA表达
PD98059干预后, CFPAC1、PANC1细胞p27KIP1、p21WAF1、p16INK4amRNA的表达均增强;MiaPaCa2细胞仅p27KIP1mRNA表达增强,而p21WAF1和p16INK4amRNA表达无明显变化(表2)。
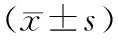
表2 PD98059干预后抑癌基因mRNA表达的变化
三、抑癌基因甲基化状态和Dnmt蛋白表达的变化
CFPAC1和PANC1细胞p16INK4a基因启动子呈高甲基化状态(图2),PD98059干预后呈去甲基化状态;Dnmt1和Dnmt3b蛋白表达减少。MiaPaCa2细胞Dnmt表达无明显变化(图3)。
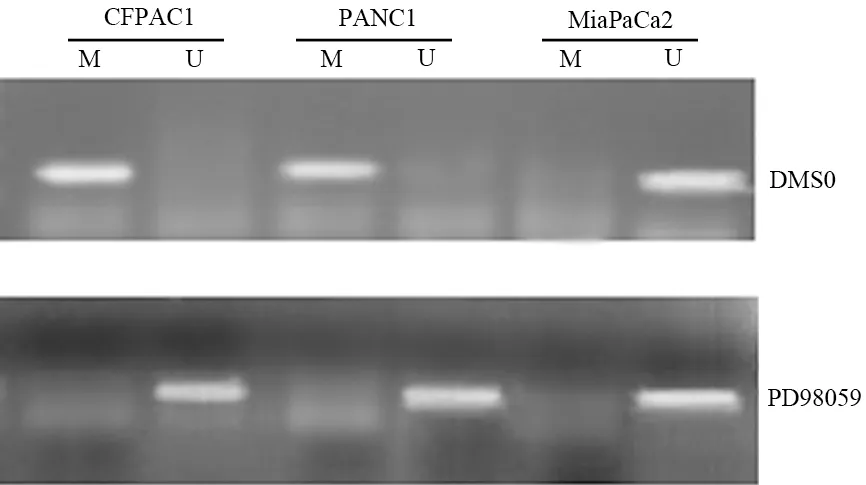
图2 p16INK4a基因启动子甲基化状态

图3 3株胰腺癌细胞Dnmt蛋白表达的变化
讨 论
胰腺癌中广泛存在RAS和(或)RAF基因的突变,导致MEK信号通路的异常激活、细胞恶性转化和增殖过度,CpG岛甲基化异常[4-5]。MEK抑制剂PD98059是非底物依赖性竞争的蛋白激酶抑制物,对ATP无影响,具有抗肿瘤作用[3],但国内关于此类药物对人胰腺癌的作用报道较少。本实验结果显示,PD98059可抑制人胰腺癌细胞系CFPAC1、PANC1和MiaPaCa2的生长,阻滞细胞周期从G0/G1期向S期转化,并上调细胞周期相关基因p27KIP1、p21WAF1、p16INK4amRNA的表达,降低DNA甲基化酶活性,其中p16INK4a基因的恢复表达与DNA去甲基化有关。与Gysin等[5]应用MEK抑制剂U0216阻滞胰腺癌细胞于G0/G1期、上调p27KIP1mRNA 表达的结果一致。
抑癌基因的失活与基因突变及DNA甲基化异常密切相关。随着表观遗传学的深入研究,发现人类多种肿瘤存在抑癌基因CpG岛甲基化异常,其中p16INK4a、cyclin D2、RASSF1A、pp ENK等基因的高甲基化在胰腺癌发展中起重要作用[5,7]。最近研究[8-10]表明,持续活化MEK信号通路介导Par-4、p16INK4a和p21WAF1等基因启动子区高甲基化与抑制其转录有关。本结果显示,p16INK4a在CFPAC1、PANC1细胞系呈高甲基化状态,PD98059干预后p16INK4a基因呈去甲基化状态,同时Dnmt的活性显著减低,表明MEK抑制剂能降低RAS活化的RAF/MEK/ERK通路活性,下调Dnmt表达,导致抑癌基因的去甲基化。
但是,本实验在3株细胞系中均未扩增出p21WAF1和p27KIP1甲基化条带,在MiaPaCa2细胞亦未扩增出p16INK4a甲基化条带,提示PD98059上调胰腺癌细胞系p21WAF1和p27KIP1mRNA的表达与DNA去甲基化无明显关系,且p16INK4a基因启动子区甲基化亦并非存在于所有的胰腺癌细胞,这一现象有待于进一步探讨。
[1] Espino PS,Pritchard S,Heng HH,et al.Genomic instability and histone H3 phosphorylation induction by the Ras-mitogen activated protein kinase pathway in pancreatic cancer cells.Int J Cancer,2009,124:562-567.
[2] Takayama Y,Kokuryo T,Yokoyama Y,et al.MEK inhibitor enhances the inhibitory effect of imatinib on pancreatic cancer cell growth.Cancer Lett,2008,264:241-249.
[3] Wang X,Sun DF,Lu R,et al.RAF may induce cell proliferation through hypermethylation of tumor suppressor gene promoter in gastric epithelial cells.Cancer Sci,2009,100:117-125.
[4] Lomberk G,Mathison AJ,Grzenda A,et al.The sunset of somatic genetics and the dawn of epigenetics:a new frontier in pancreatic cancer research.Curr Opin Gastroenterol,2008,24:597-602.
[5] Gysin S,Lee SH,Dean NM,et al.Pharmacologic inhibition of RAF-->MEK-->ERK signaling elicits pancreatic cancer cell cycle arrest through induced expression of p27Kip1.Cancer Res,2005,65:4870-4880.
[6] Zebisch A,Czernilofsky AP,Keri G,et al.Signaling through RAS-RAF-MEK-ERK:from basics to bedside.Curr Med Chem,2007,14:601-623.
[7] Missiaglia E,Donadelli M,Palmieri M,et al.Growth delay of human pancreatic cancer cells by methylase inhibitor 5-aza-2′-deoxycytidine treatment is associated with activation of the interferon signalling pathway.Oncogene,2005,24:199-211.
[8] Lu R,Wang X,Chen ZF,et al.Inhibition of the extracellular signal-regulated kinase/mitogen-activated protein kinase pathway decreases DNA methylation in colon cancer cells.J Biol Chem,2007,282:12249-12259.
[9] Peng DF,Kanai Y,Sawada M,et al.DNA methylation of multiple tumor-related genes in association with overexpression of DNA methyltransferase 1 (DNMT1) during multistage carcinogenesis of the pancreas.Carcinogenesis,2006,27:1160-1168.
[10] Pruitt K,Ulku AS,Frantz K,et al.Ras-mediated loss of the pro-apoptotic response protein Par-4 is mediated by DNA hypermethylation through Raf-independent and Raf-dependent signaling cascades in epithelial cells.J Biol Chem,2005,280:23363-23370.
2010-08-27)
(本文编辑:吕芳萍)
EffectsofMEKsignalinginhibitoronthegrowthofhumanpacreaticcancercelllinesandtheexpressionofcellcycleassociatedgenes
WANGXia,WANGHui,JIANGNan,LIANGSan-hong,LÜWen,ZHANGXiao,ZHANGXiao-feng.
FirstPeople′sHospitalofHangzhou,Hangzhou310006,China
WANGXia,Email:wang78xia@hotmail.com
ObjectiveTo examine the effects of the MEK inhibitor on human pancreatic cancer cells, and to explore the molecular mechanisms.MethodsHuman pancreatic cancer cell lines CFPANC1, PANC1 and MiaPaCa2 were treated with MEK inhibitor PD98059 or DMSO, the sensitivity was analyzed by an MTT assay, and cell cycle distribution was evaluated by flow cytometry(FCM), The transcriptional level and protein expression of tumor suppressor genes were detected by real-time RT-PCR and western blot respectively. DNA methyltransferase (Dnmt)1, 3a and 3b were also assayed by western blot,The methylation status of the promoter of the p16INK4A gene was assayed by methylation-specific PCR (MSP).ResultsPD98059 inhibited to various degrees the growth of three pancreatic cancer cell lines, accompanied by G0-G1 cell cycle arrest. PD98059 up-regulated the expression of p16INK4a, p21WAF1, p27KIP1mRNA, demethylated the hypermethylation status of p16INK4agene promoter, and decreased Dnmt1 and Dnmt3b in CFPANC1 and PANC1 cell lines. PD98059 only increased the expression of p27KIP1, while the changes of p16INK4a, p21WAF1and Dnmt were less marked in MiaPaCa2 cell line.ConclusionsMEK inhibitor PD98059 down-regulate the activation of Dnmt and up-regulate tumor supress genes, along with the inhibition of cell proliferation and cell cycle progression.
Pancreas; Tunor cell line; MEK inhibitor; Cell cycle; DNA methyltransferase; Tumor suppressor genes
10.3760/cma.j.issn.1674-1935.2011.04.009
国家自然科学青年基金(81001078)
310006 杭州,杭州市第一人民医院消化内科
王霞,Email:wang78xia@hotmail.com

