人的核糖体蛋白S3a基因克隆、表达、纯化与亚细胞定位
刘 莹,厉建中,张俊平
(第二军医大学药学院生化药学教研室,上海 200433)
·论著·
人的核糖体蛋白S3a基因克隆、表达、纯化与亚细胞定位
刘 莹,厉建中,张俊平
(第二军医大学药学院生化药学教研室,上海 200433)
目的克隆人核糖体蛋白S3a (Ribosomal protein S3a, RPS3a)基因,并表达、纯化其蛋白,分析RPS3a蛋白的细胞定位,为其功能研究奠定基础。方法应用RT-PCR从人胚肾HEK293细胞的总RNA中反转录并扩增出RPS3a基因,克隆到原核表达载体PET-21a中,转化大肠杆菌(Escherichiacoli)BL21(DE3)进行蛋白表达。在异丙基硫代-β-D-半乳糖苷(IPTG)诱导下,PET21a-RPS3a融合表达载体在大肠杆菌菌株BL21(DE3)中以可溶性蛋白的形式高效表达RPS3a蛋白,超声破碎细胞,通过Ni2+-NTA亲和层析柱初步纯化,再应用50 kD超滤膜进一步纯化。用Western Blot印迹实验检测纯化后的蛋白。构建绿色荧光蛋白(Enhanced Green Fluorescent Protein,EGFP )的pEGFP-N1-RPS3a表达载体,转染HEK293细胞,通过荧光显微镜观察RPS3a重组荧光蛋白在细胞内的分布。结果获得了较高纯度的RPS3a蛋白,亚细胞定位分析表明RPS3a蛋白主要分布于细胞质。结论成功克隆了RPS3a基因并表达纯化了其蛋白,确定其亚细胞分布,为进一步研究RPS3a蛋白的性质和功能奠定了基础。
核糖体蛋白S3a;原核表达;蛋白纯化;亚细胞定位
核糖体蛋白是核糖体的重要组成部分。近年来核糖体蛋白的核糖体外功能研究备受瞩目。核糖体蛋白除了在蛋白合成中起重要作用外,不同的核糖体蛋白还有独特的核糖体外功能[1],如RPL11与MyC结合抑制基因转录,RPS29通过下调Bcl-2和激活p53诱导细胞凋亡、RPS3与NFkB p65结合促进NFkB-DNA结合和基因转录等。核糖体蛋白RPS3a是一个高度保守的蛋白,组成核糖体40S亚基,分子量为29.8 kD。从人、大鼠和小鼠不同细胞克隆分离的基因RPS3a、Fte-1、TU-11、13T和nbl基因序列完全一致[2~6]。研究表明,核糖体蛋白S3a也具有核糖体外功能,如RPS3a能与转录因子CHOP、Bcl-2、EB病毒编码的EBNA-5等相互作用调控红细胞生成[7]、调节p53通路[8]和抑制多聚(ADP-核糖)聚合酶活性[9,10]。为了研究RPS3a的功能,我们通过RT-PCR从人的HEK293细胞中克隆得到RPS3a基因,表达并且纯化了RPS3a重组蛋白,同时构建了含绿色荧光蛋白( Enhanced Green Fluorescent Protein,EGFP) 的RPS3a重组表达载体,通过亚细胞定位实验,发现RPS3a重组荧光蛋白主要分布在细胞质内,为RPS3a功能研究打下基础。
1 材料与方法
1.1实验材料 质粒PET-21a、菌株BL21(DE3)和人胚肾HEK293细胞均为本实验保存。限制性核酸内切酶EcoR I、Hind III、Taq DNA和T4 DNA连接酶购自TaKaRa公司;TRIzol购自Invitrogen公司;RT-PCR试剂盒购自Promega公司;IPTG购自Sigma公司;胰蛋白胨、酵母提取物、丙烯酰胺和N,N-亚甲双丙烯酰胺购自上海生工生物工程有限公司;Ni2+-NTA亲和层析柱和填料购自Pharmacia公司;硝酸纤维素膜购自Amershia公司;引物合成及基因测序由上海生工生物工程有限公司完成;质粒抽提试剂盒,DNA胶回收试剂盒购自上海华舜生物工程有限公司。
1.2TRIzol法提取总RNA 用PBS漂洗人胚肾HEK293细胞后,直接加1 ml TRIzol试剂,混匀,移入 1.5 ml离心管中,用氯仿抽提,异丙醇沉淀,75% 的乙醇充分洗涤沉淀,离心后去除上清,干燥后用DEPC水溶解,-70 ℃保存备用。
1.3引物设计和RT-PCR 1 μg总RNA为模板在反转录体系中,以随机引物合成cDNA,取 2 μl cDNA产物为模板进行PCR扩增。扩增引物根据RPS3a mRNA序列(GenBank基因登录号NM_001006),利用Primer Premier 5.0软件设计PCR扩增引物, 并分别在正义链引物5′端加EcoR I 酶切位点,反义链5′端加Hind III 酶切位点,RPS3a正义链引物:5′-GGC GAA TTC ATG GCG GTT GGC AAG AAC AA-3′;反义链引物:5′-CAG AAG CTT AAC AGA TTC TTG GAC TGG TGG-3′。PCR扩增条件:94 ℃热启动5 min后,94 ℃变性30 s,退火30 s,72 ℃延伸40 s,30个循环后,72 ℃反应5 min。 RT-PCR产物用l% 琼脂糖凝胶电泳进行鉴定。
1.4重组质粒的构建和鉴定 用限制性内切酶Hind III,EcoR I对RPS3a的RT-PCR产物和PET-21a载体质粒进行双酶切,37 ℃酶切 2~3 h后,进行 1% 琼脂糖凝胶电泳,并胶回收PET-21a载体质粒和RPS3a,用T4连接酶16 ℃过夜连接,将连接产物转化大肠杆菌DH5α菌株,涂氨苄青霉素(Amp)抗性LB平板,37 ℃过夜,挑取单克隆分别在LB中37 ℃培养,用碱法提质粒,进行PCR和酶切鉴定并送上海生工生物工程公司进行基因测序。
1.5重组蛋白的表达 将测序正确的PET21a-RPS3a重组质粒分别转化大肠杆菌BL21(DE3)菌株和BL21菌株,挑取单克隆,接种到 3 ml含氨苄青霉素(Amp)的LB培养基中,于37 ℃,250 r/min 振荡培养至对数中期(OD600=0.6),加入终浓度 1 mmol/L 的IPTG时,菌液分为四组:第一组在大肠杆菌菌株BL21(DE3)中32 ℃诱导培养,分别于 4、9 h取样离心收集菌体,第二组在大肠杆菌菌株BL21(DE3)中25 ℃诱导培养,分别于 4、9 h取样离心收集菌体,第三组在大肠杆菌菌株BL21中32 ℃诱导培养,分别于 4、9 h取样离心收集菌体,第四组在大肠杆菌菌株BL21中25 ℃诱导培养,分别于 4、9 h取样离心收集菌体32 ℃诱导培养,4 ℃,4 500 r/min 离心 5 min收集菌体,PBS重悬菌体,超声,4℃,10 000 g 20 min 收集菌体,进行 12% SDS-PAGE。
1.6目的蛋白的分离纯化 取培养菌裂解液上清,离心(10 000 g、20 min、4℃)。用5倍柱体积的裂解缓冲液(Na3PO420 mmol/L、NaCl 500 mmol/L,咪唑 20 mmol/L ,pH8.0)平衡Ni2+-NTA亲和层析柱,加入 20 ml裂解液上清,用洗脱缓冲液洗涤层析柱,去除结合在凝胶上的非特异性蛋白,之后用含有 400 mmol/L 咪唑的洗脱缓冲液将目的蛋白洗脱下来。应用50 kD超滤膜,4 ℃,7 000 r/min 离心 5 min。收集浓缩液,进行SDS-PAGE。融合蛋白纯度用计算机灰度扫描确定。
1.7Western Blot鉴定 诱导表达的菌体总蛋白和纯化后的融合蛋白PET21a-RPS3a经 12% SDS-PAGE凝胶电泳后,4 ℃,360 mA,1 h,电转移至硝酸纤维素膜,以 5% 脱脂奶粉4℃封闭过夜,弃去封闭液,用PBST(含0.05% Tween-20)漂洗3次,加入鼠抗His-tag单克隆抗体,室温孵育 2 h后,弃去一抗,用PBST(含 0.05% Tween-20)漂洗3次,加入HRP标记的羊抗鼠IgG二抗,室温孵育 l h用PBST(含 0.05% Tween-20)洗硝酸纤维素膜3次,最后加入显色液,X光片曝光。
1.8RPS3a重组荧光蛋白的亚细胞定位 根据GenBank中人RPS3a的序列,以5′-GGC GAA ATG GCG GTT GGC AAG AAC AA-3′(Forward);5′-CAG AAG CTT AAC AGA TTC TTG GAC TGG TGG-3′(Reverse)为引物,选择EcoR I 和BamH I为酶切位点,PCR 扩增人全长RPS3a序列(95 ℃ 3 min,变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 40 s,共30个循环),PCR产物胶回收后,和EGFP载体都经EcoR I 和BamH I双酶切后,T4连接酶连接,构建为EGFP-N1-RPS3a重组质粒,重组质粒经酶切鉴定和测序均无误。
将生长状态良好的HEK293细胞按每孔1.0×104个的密度转移到预先置有载玻片的24孔板中,在37 ℃ ,5% CO2,10%含胎牛血清的DMEM培养基中培养至80%左右的铺板密度,用脂质体Lipofectamine 2000将pEGFP-N1-RPS3a质粒和对照空载体pEGFP-N1分别转染到细胞中, 转染48 h后 ,吸去培养基,用PBS漂洗1次,加入4%多聚甲醛固定15 min,吸去多聚甲醛,加入0.5% Triton X-100,室温放置10 min,加入0.01 μg/ml DAPI染色5 min,PBS洗涤三次,甘油封片进行Axiovert 40倒置荧光显微镜下观察,以RGB滤镜对EGFP-NI和DAPI荧光分别记录图像,激发EGFP的激光波长为488 nm,激发DAPT的激光波长为340 nm。
2 结果
2.1重组质粒的构建与鉴定 RPS3a基因片段的克隆与扩增以HEK293细胞中提取的总RNA为模板,经RT-PCR扩增后,于 1% 琼脂糖凝胶电泳上获得一条约 800 bp的特异性条带(图1)。PCR产物经双酶切,胶回收亚克隆到原核表达载体PET-21a的EcoR I与Hind III位点上,得到重组质粒PET21a-RPS3a。经PCR与酶切鉴定正确的阳性克隆送往上海生工生物公司测序,测序结果表明所获得的RPS3a基因序列与GenBank(NM_001006)登录序列一致。

图1RPS3a基因RT-PCR扩增产物的琼脂糖凝胶电泳分析
1-RPS3a基因RT-PCR扩增产物;M-DNA Marker(DL2000)
2.2重组蛋白的表达及其诱导条件的优化 对转入宿主菌的重组表达质粒PET21a-RPS3a进行表达条件的优化,12% SDS-PAGE分析结果,诱导后的重组蛋白在大约 30 kD 处出现一明显条带。PET21a-RPS3a重组蛋白在宿主菌BL21(DE3)的表达量约占全菌总蛋白50%,明显高于宿主菌BL21的10%,所以选择在宿主菌BL21(DE3)中表达重组蛋白。PET21a-RPS3a重组蛋白分别随着OD值及诱导时间的增加,表达量逐渐加大;当OD600达0.6,诱导时间为 9 h,重组蛋白的表达量最大,此后不再明显升高(图2)。
2.3重组蛋白的纯化和Western Blot 12% SDS-PAGE分析超声破碎后上清沉淀, 发现表达产物以可溶性蛋白的形式存在于裂解上清中,而非存在包涵体内。PET-21a载体表达的目的蛋白应用镍亲和层析梯度洗脱的方法,先用30、40、50、60、70 mmol/L 等低浓度咪唑洗涤非特异性结合的杂质蛋白后,用 400 mmol/L 咪唑洗脱,计算机灰度扫描蛋白纯度达 80% 以上。再应用50 kD超滤膜进一步纯化(图3)。

图2PET21a-RPS3a在不同宿主菌的表达产物SDS-PAGE分析
1~2-32 ℃ 诱导前后 4 h BL21-PET21a-RPS3a;3~4-32℃ 诱导前后 9 h BL21-PET21a-RPS3a;M-蛋白 Marker;5~6-22 ℃ 诱导前后 4 h BL21(DE3)-PET21a-RPS3a;7~8-22 ℃ 诱导前后 9 h BL21(DE3)- PET21a-RPS3a
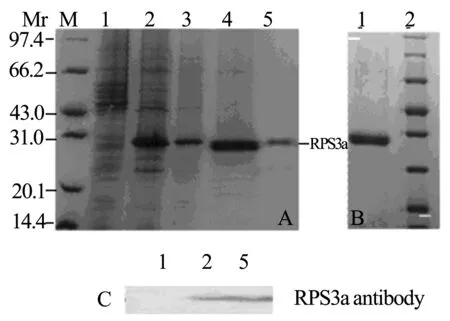
图3PET21a-RPS3a重组蛋白纯化的SDS-PAGE和WesternBlot鉴定
A-PET21a-RPS3a重组蛋白通过亲和层析纯化的SDS-PAGE;B-PET21a-RPS3a重组蛋白通过超滤膜纯化的SDS-PAGE;C-PET21a-RPS3a重组蛋白Western Blot鉴定 M-蛋白 Marker;1-未诱导PET21a-RPS3a;2-诱导PET21a-RPS3a;3-PET21a-RPS3a裂解液上清;4~5-400 mmol/L咪唑洗脱产物。
为进一步鉴定表达的蛋白,进行Western Blot分析,结果显示,IPTG诱导前无目的蛋白表达,诱导后和亲和层析纯化后在分子量为30 kD 处均可见一明显的条带,进一步证实所表达的蛋白为RPS3a。
2.4RPS3a重组荧光蛋白在细胞内的定位分析 通过倒置荧光显微镜在488 nm激发光下对pEGFP-N1进行直接观察,以340 nm激发光分析DAPI的荧光。在表达pEGFP-N1-RPS3a融合蛋白的细胞中,可见EGFP的绿色荧光分布在细胞质;同时,观察DAPI的蓝色荧光布满细胞核,EGFP产生的绿色荧光分布在DAPI蓝色荧光的周围,表明pEGFP-N1-RPS3a融合蛋白主要表达于细胞质。对照组pEGFP-N1转染细胞发出的绿色荧光均匀地分布在整个细胞中(图4)。

图4倒置荧光显微镜观察RPS3a重组荧光蛋白在细胞内的分布情况
A-pEGFP-N1对照质粒转染细胞;B-pEGFP-N1-RPS3a转染细胞;a,b,c分别为绿色荧光,DAPI核荧光染色和a,b图像的叠加重合
3 讨论
在20世纪90年代就有人提出核糖体蛋白S3a作为一个多功能蛋白在细胞凋亡中有重要作用[9]。Naora等人发现在凋亡早期RPS3a的表达水平降低[10]。此外,由依托泊苷诱导的HL-60细胞凋亡早期RPS3a的水平也降低。研究表明,RPS3a可以与Bcl-2联合作用于聚腺苷酸二磷酸核糖转移酶[poly(ADP-ribose) polymerase,PARP]从而显著抑制后者的活性,已知PARP可启动由一系列药物(如烷化剂,活性氧化剂,拓扑异构酶II抑制剂和多柔比星等)引起的细胞凋亡,是重要的凋亡调节子。Song等[11]发现PRS3a和Bcl-2共同作用抑制PARP的活性从而抑制细胞凋亡,在缺少RPS3a的情况下, Bcl-2不能抑制PARP的活性。说明RPS3a在Bcl-2与PARP的相互作用中作为桥梁蛋白,易化了Bcl-2对PARP的抑制作用从而阻止凋亡。这些结果为我们了解凋亡的机制提供了新视野。
为了研究RPS3a的功能,我们成功克隆了RPS3a基因,并构建了PET21a-RPS3a重组表达载体,经优化表达条件,使其在上清中高表达,然后用Ni2+-NTA金属螯合层析柱,以梯度洗脱的方法洗脱目的蛋白,即先用30、40、50 、60、70 mmol/L 等低浓度咪唑洗涤非特异性结合的杂质蛋白,每个浓度洗脱20个柱体积,再用 400 mmol/L咪唑洗脱目的蛋白,脱盐,得到大量的可溶性的PET21a-RPS3a重组蛋白,建立了高效的表达和纯化方案,获得了可溶性好,稳定性高的PET21a-RPS3a重组蛋白。
加强型绿色荧光蛋白(Enhanced Green Fluorescent Protein,EGFP ) 能够自身催化形成发色结构并在蓝光激发下发出绿色荧光,易于构建载体且对活细胞无毒害,对目的基因的功能也没有影响,检测方便,荧光稳定。因此本实验选用EGFP基因作为报告基因,利用基因工程技术构建pEGFP-N1-RPS3a融合蛋白的哺乳动物表达载体,并在HEK293细胞中进行表达。我们将pEGFP-N1-RPS3a重组体转染到状态良好的HEK293细胞,为了确定pEGFP-N1-RPS3a 融合蛋白是定位在细胞核还是细胞质,转染48 h后用特异性的细胞核染色剂DAPI进行核染色,在倒置荧光显微镜下观察,结果显示转染进细胞并表达的pEGFP-N1-RPS3a融合蛋白主要分布于细胞质,位于细胞核的周围。亚细胞定位研究表明RPS3a主要存在于细胞质中,为进行下一步功能研究奠定基础。
[1] Lindstrom MS. Emerging functions of ribosomal proteins in gene-specific transcription and translation[J].Biochem Biophys Res Commun, 2009, 379(2):167.
[2] Metspalu A ,Rebane A, Hoth S,etal.Human ribosomal protein S3a: cloning of the cDNA and primary structure of the protein[J]. Gene, 1992, 119(2): 313.
[3] Kho CJ, Zarbl H. Fte-1, a v-fos Transformation Effector Gene, Encodes the MammalianHomologue of a Yeast Gene Involved in Protein Import into Mitochondria[J]. Proc Natl Acad Sci USA, 1992, 89: 2200.
[4] Chan YL,Olvera J,Paz V,etal.The primary structures of rat ribosomal proteins S3a (the V-Fos transformation effector) and of S3b[J]. Biochem Biophys Res Commun, 1996, 228(1): 141.
[5] Lecomte F,Lecomte F,Szpirer J,etal.The S3a ribosomal protein gene is identical to the Fte-1 (v-fos transformation effector) gene and the TNF-alpha]induced TU-11 gene, and its transcript level is altered in transformed and tumor cells[J]. Gene, 1997, 186(2): 271.
[6] Naora H,Nishida T,Shindo Y,etal.Association of nbl gene expression and glucocorticoid-induced apoptosis in mouse thymus in vivo[J]. Immunology, 1995, 85(1): 63.
[7] Cui K,Coutts M,Stahl J,etal.Novel interaction between the transcription factor CHOP (GADD153) and the ribosomal protein FTE/S3a modulates erythropoiesis[J]. J Biol Chem, 2000, 275(11): 7591.
[8] Kashuba E,Yurchenko M,Szirak K,etal. Epstein-Barr virus-encoded EBNA-5 binds to Epstein-Barr virus-induced Fte1/S3a protein[J]. Exp Cell Res , 2005, 303: 47.
[9] Hu ZB,Minden MD,Mcculloch EA,etal. Regulation of drug sensitivity by ribosomal protein S3a[J]. Blood, 2000, 95(3): 1047.
[10] Song D, Sakamoto S,Taniguchi T.Inhibition of Poly(ADP-ribose) Polymerase Activity by Bcl-2 in Association with the Ribosomal Protein S3a[J]. Biochemistry, 2002, 41(3): 929.
2010-06-09
[修回日期] 2010-09-12
Cloning,expression,purificationandsubcellularlocalizationofhumanribosomalproteinS3a
LIU Ying,LI Jian-zhong,ZHANG Jun-ping
(School of pharmacy ,Second military medical university ,Shanghai 200433, China)
ObjectiveTo express and purify the human ribosomal protein S3a and study the subcellular localization of human ribosomal protein S3a.MethodsThe RPS3a gene was obtained by RT-PCR, total RNA extracted from human HEK293 cell as the template,and cloned into the prokaryotic expressing vector PET-21a to form PET21a-RPS3a, then transferred into (Escherichia coli)BL21(DE3). PET21a-RPS3a was highly expressed in (Escherichiacoli)BL21(DE3) in the presence of isopropyl-β-D-thiogalactopyranoside (IPTG) and most products existed in a soluble form. After ultrasonication, recombinant fusion proteins were purified by Ni2+-NTA affinity chromatography and 50 kD ultrafiltration membrane, the purity of RPS3a was further confirmed by Western Blot analysis. The full sequence of RPS3a gene was recombined in the downstream of the green fluorescent protein gene in the EGFP-N1 vector.The recombined pEGFP-N1-RPS3a vector was transfected into human kidney epithelial cells (293 cells), through the subcellular localization, which was observed RPS3a recombinant fluorescent protein in the cell distribution.ResultsThe higher purity of recombinant fusion protein was obtained. Subcellular localization analysis confirmed that RPS3a recombinant fluorescent protein distributed mainly in the cytoplasm.ConclusionThe recombinant fusion protein PET21a-RPS3a was successfully cloned, expressed, purified. Application of subcellular localization raises the foundation to the study on nature and function of human RPS3a protein.
ribosomal protein S3a(RPS3a);prokaryotic expression;protein purification;subcellular localization
国家自然科学基金(30600766和30871353).
刘 莹(1984-),女,硕士研究生.E-mail:liuchanger1984@163.com.
张俊平.E-mail:jpzhang08@hotmail.com.
Q78
A
1006-0111(2011)02-0097-04
——一道江苏高考题的奥秘解读和拓展

