绞股蓝总皂苷中单体皂苷的分离纯化
孔 玉 琼, 金 凤 燮, 鱼 红 闪
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
绞股蓝中含有绞股蓝皂苷、氨基酸、蛋白质、脂肪、黄酮类、糖类、无机元素、纤维素和维生素等多种化学成分,其中以绞股蓝皂苷为主要的药理活性成分。迄今发现的绞股蓝皂苷达136种,其基本化学结构主要是由四环三萜达玛烷型绞股蓝皂苷元与糖基组成,目前已分离84种与人参皂苷有类似骨架的达玛烷型绞股蓝皂苷(Gypenoside,Gyp)[1-2]。其独特的生物活性和药理作用受到了国内外学者的广泛关注,但目前,在我国关于绞股蓝的文献中,研究绞股蓝药理的占绝大多数,分子水平的研究尚少,林毅[3]、庞敏[4]等开展过分子水平的研究,但未涉及绞股蓝皂苷。本实验室在前期的工作中已经对绞股蓝中总皂苷的提取及含量进行了研究并确定了绞股蓝总皂苷的最佳提取工艺[5-6],并利用柱层析法对实验室自制的绞股蓝皂苷的酶解产物进行了分离纯化,得到一种单体皂苷Rd[7]。本研究以分离纯化得到绞股蓝皂苷单体为目的,用硅胶柱层析法对绞股蓝总皂苷进行分离纯化,以期得到更多绞股蓝皂苷单体化合物,为酶学及药理药效等方面的深入研究提供理论依据。
1 材料与方法
1.1 材料和仪器
绞股蓝干草,市售,江苏泰州;硅胶,青岛海洋化工厂;薄层层析板(TLC),Merck公司;旋转蒸发仪,上海爱朗仪器有限公司;Waters 2695高效液相色谱仪;AB-大孔吸附树脂,D296 阴离子交换树脂,南开大学化工厂;所用试剂均为分析纯。
1.2 实验方法
1.2.1 绞股蓝总皂苷的制备
取绞股蓝全草5 000g,粉碎机将其粉碎后,分别用10、8、6 倍75%的乙醇浸提3 次,每次提取时间为2d,浸提液用旋转蒸发仪低压蒸干,得浸膏。加适量水溶解后取上清液用石油醚脱脂2~3次,以去除叶绿素等脂溶性物质;然后用水饱和正丁醇对脱脂后的上清液萃取皂苷,反复萃取4~5次,收集正丁醇层,减压回收正丁醇,浓缩、烘干,得绞股蓝粗皂苷。
将经饱和正丁醇萃取后的绞股蓝粗皂苷溶于纯净水中,反复上样,使之充分被吸附后依次用8倍柱体积去离子水脱糖,10%乙醇溶液洗脱除杂后用6倍体积的75%乙醇对皂苷进行解吸;收集洗脱液上D-296离子交换树脂进行脱色处理,反复上样,待吸附完全后用水洗至无含皂苷溶液流出,收集含有皂苷的洗脱液蒸干后制得绞股蓝总皂苷粗品。
1.2.2 硅胶柱分离纯化绞股蓝总皂苷
样品胶的制备:准确称取一定量待分离的绞股蓝总皂苷,加入适量的甲醇,在60 ℃水浴中完全溶解后,与1.5倍样品质量的80~100目硅胶混合,搅拌均匀,继续在水浴中加热,直至溶剂挥发干燥后,颗粒均匀而不腻手,即成样品胶。
装柱:脱脂棉铺于玻璃柱底部,取20倍样品质量的300~400目硅胶作为分离胶,铺放均匀后抽真空压实,加入一层高2~3cm 的80~100目的硅胶起缓冲作用,再加上已制好的样品胶,抽真空压实。最后于最上方铺脱脂棉,待用。
梯度洗脱:硅胶柱装好后,先用纯氯仿通柱,然后用V(氯仿)∶V(甲醇)=9.5∶0.5的氯仿-甲醇溶液洗脱样品,每洗脱100mL 收集一瓶,利用薄层层析法对收集的样品进行跟踪检测,根据TLC情况更换洗脱梯度,分步收集洗脱液,旋转蒸发浓缩得固体产物。
1.2.3 薄层层析法(TLC)检测绞股蓝皂苷的分离情况
用刻度毛细管吸取标准品及样品,点样于薄层层析板上。将点好样品的薄层板放入层析缸的展开剂中,展开剂配比为V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5,10%硫酸加热显色。
1.2.4 高效液相色谱法测定分离单体的纯度
利用高效液相色谱仪对分离得到的单体皂苷进行了纯度的检测及皂苷种类的初步鉴定。仪器:Waters2695;色谱柱:Hypersil ODS2(4.6 mm×250mm,5μm)不锈钢填充柱;进样量:10μL;体积流量:1.0 mL/min;柱温:35 ℃;流动相:乙腈(A)+水(B)梯度洗脱;检测波长:203nm;洗脱液组成如表1所示。
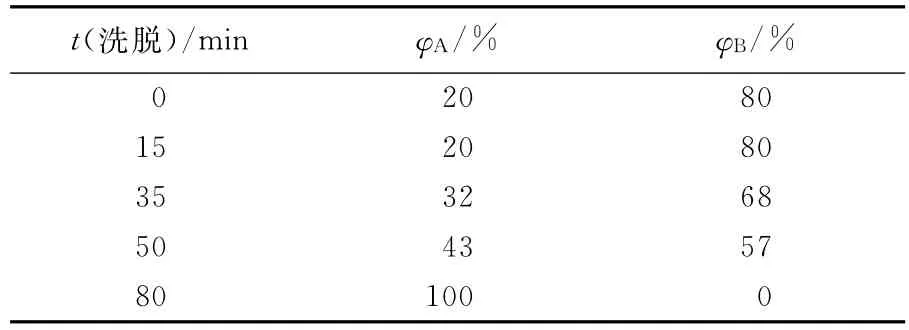
表1 高效液相色谱流动相组成Tab.1 Mobile phase of HPLC
2 结果与讨论
2.1 绞股蓝总皂苷的提取
绞股蓝全草5 000g经75%乙醇反复浸提3次后,醇提液经石油醚脱脂、饱和正丁醇萃取、AB-8大孔吸附树脂柱脱糖除杂、D-296离子交换树脂柱脱色后制得绞股蓝总皂苷7.87g,计算得率,得率=提取绞股蓝粗皂苷的质量/绞股蓝全草的质量。经计算,实验所得绞股蓝总皂苷的得率为0.157 4%。
实验所得绞股蓝皂苷得率较低,分析其原因,除了实验步骤较多,皂苷损失较大,人为因素的操作失误、所用绞股蓝植物的品种产地[8]也是得率偏低的原因。后期实验可以考虑使用皂苷含量较高的绞股蓝品种以提高得率。
2.2 硅胶柱分离绞股蓝皂苷
采用硅胶柱层析法对5g绞股蓝总皂苷进行分离,TLC 点板后收集单体产物,称质量,计算得率。
洗脱出的绞股蓝单体皂苷按洗脱出现先后分别记为组分A、B、C。
2.2.1 组分A 的分离情况
用V(氯仿)∶V(甲醇)=9.5∶0.5的氯仿-甲醇开始洗脱,薄层层析板点样跟踪,结果如图1所示。由图1可以看出,洗脱至第27瓶的时候,即洗脱至2 700mL 时开始出现单点,从第43瓶开始点的位置开始下移,出现其他皂苷点。收集较纯净的27~42瓶洗脱液,低压旋转蒸发得干品组分A,质量为0.132 6g。

图1 组分A 的TLC图Fig.1 TLC of component A
2.2.2 组分B的分离情况
薄层层析板点样跟踪洗脱过程,在V(氯仿)∶V(甲醇)=9∶1时出现组分B,结果如图2所示。由图2可以看出,洗脱至第11瓶的时候,即洗脱至1 100mL时开始出现较为纯净的单点,且浓度较大,从第16瓶开始点的位置开始下移。收集较纯净的11~15瓶洗脱液,低压旋转蒸发得干品组分B,质量为0.145 0g。
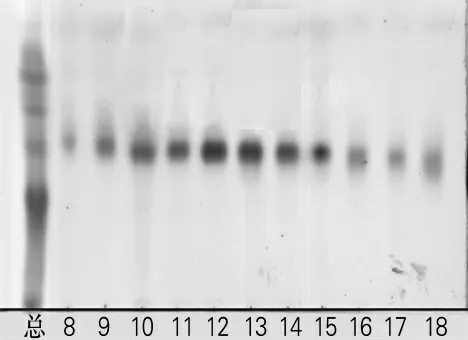
图2 组分B的TLC图Fig.2 TLC of component B
2.2.3 组分C的分离情况
组分C 在V(氯仿)∶V(甲醇)=9∶1 时出现,结果如图3所示。由图3可以看出,洗脱至第27瓶的时候,即洗脱至2 700mL 时开始出现较为纯净的单点,且浓度较大,从第32瓶开始点的位置开始下移。收集较纯净的27~31瓶洗脱液,低压旋转蒸发得干品组分C,质量为0.261 0g。
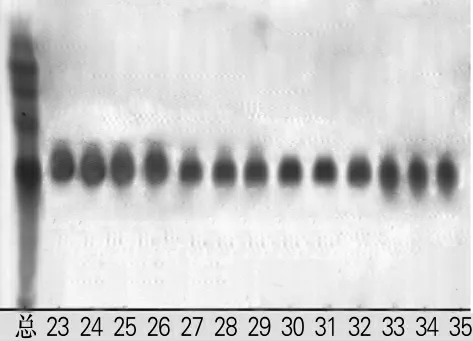
图3 组分C的TLC图Fig.3 TLC of component C
2.2.4 硅胶柱分离绞股蓝皂苷的洗脱条件
将上述所得的3种绞股蓝皂苷组分A、B、C进行TLC 检测,显示为较干净的单点,初步判断为绞股蓝单体化合物。图4为绞股蓝总皂苷经过硅胶柱分离得到的这3种单体化合物的TLC 检测结果。
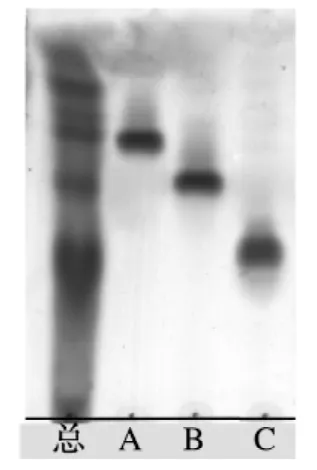
图4 绞股蓝总皂苷硅胶柱分离成分TLC 检测结果Fig.4 TLC for gynostemma pentaphylla sample separated by silica gel column chromatograph
将所得3 种单体皂苷组分使用的洗脱液比例,洗脱体积,所得样品质量及得率整理,结果如表2所示。

表2 绞股蓝皂苷洗脱分离收集表Tab.2 Obtain rate of gypenoside
2.3 绞股蓝皂苷单体的HPLC检测
采用高效液相色谱法检测绞股蓝总皂苷及分离所得单体。精密称取各样品3 mL 分别溶于1mL色谱甲醇,完全溶解过0.45μm 微孔滤膜,取滤液,即得3 mg/mL 的供试品。其HPLC 检测图谱如图5所示,3种组分的HPLC 结果数据见表3。
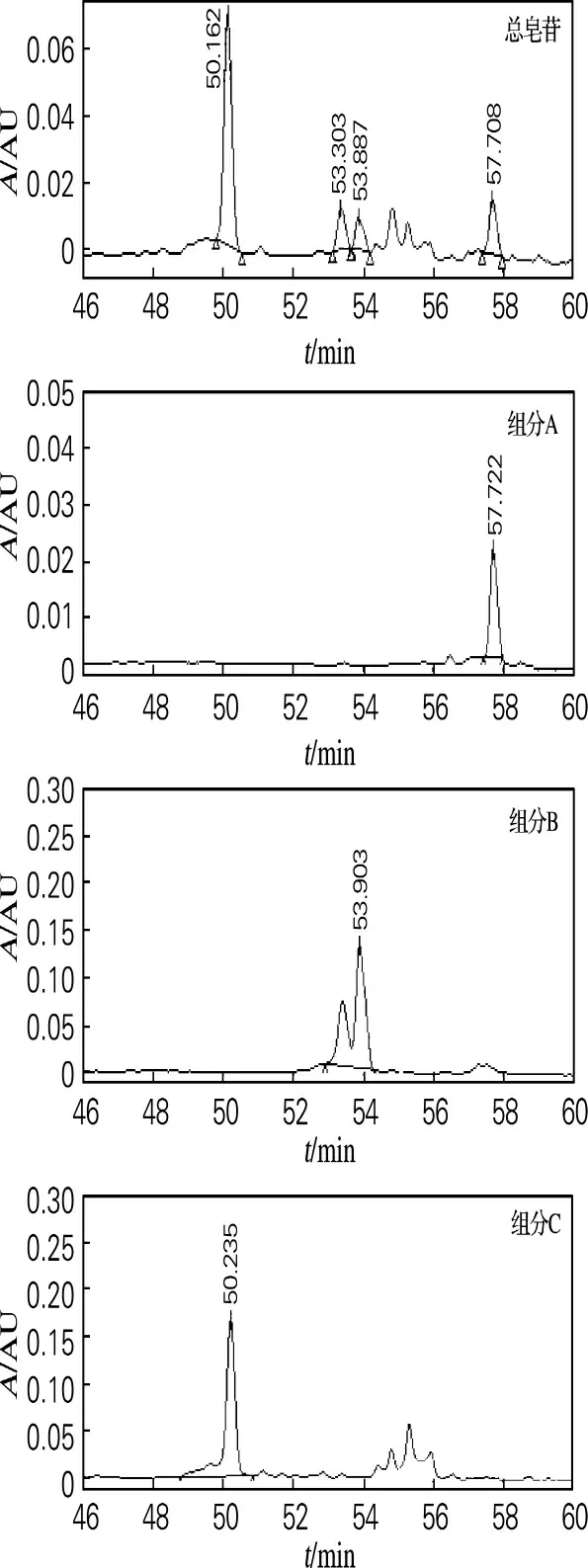
图5 绞股蓝总皂苷及A、B、C组分色谱图Fig.5 Chromatogram of gypenoside and sample A,B and C
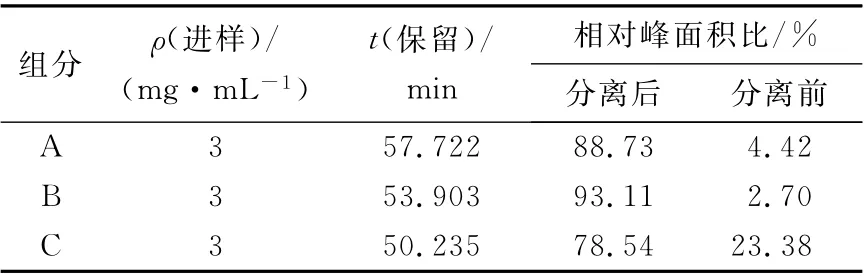
表3 组分A、B、C的HPLC图谱数据Tab.3 Data analysis of sample A,B and C
由图5和表3可以看出,经过硅胶柱的纯化后绞股蓝单体皂苷A、B、C 均得到了较好的分离纯化,较粗品皂苷纯度显著提升。
3 结 论
通过硅胶柱分离绞股蓝皂苷样品5g,TLC检测,得到3 种绞股蓝皂苷单体,得率分别为2.6%、3.0%、5.2%。高效液相色谱检测各样品,相对纯度分别约为88.73%、93.11%、78.54%。结果表明,采用硅胶柱层析法,以氯仿-甲醇混合液为流动相对绞股蓝皂苷进行梯度洗脱可以达到分离纯化绞股蓝总皂苷的目的,在洗脱比例V(氯仿)∶V(甲醇)=9.5∶0.5下洗脱至2 700mL出现较纯的单体组分A;9∶1下洗脱至1 100 mL出现较纯的单体组分B,洗脱至2 700mL出现较纯的单体组分C。这一洗脱比例及洗脱液体积的确定,为大量制备绞股蓝多糖基单体皂苷提供了理论依据,制备中可根据所需单体皂苷采用相应比例洗脱液直接洗脱制备,能有效缩短实验时间并节约试剂,提高实验效率。
[1]侯慧丽,傅童生.绞股蓝的化学成分与药理作用研究进展[J].动物医学进展,2006,27(增):59-61.
[2]CIRCOSTA C,PASQUALE R D,OCCHIUTO F.Cardiovascular effects of the aqueous extract of Gynostemma pentaphyllum Makino[J].Phytomedicine,2005,12:638-643.
[3]林毅,吴祖建,谢联辉,等.抗虫害基因新资源:绞股蓝核糖体失活蛋白基因[J].分子植物育种,2003,1(5/6):763-765.
[4]庞敏,邹芳平,肖娅萍.应用RAPD 技术构建绞股蓝DNA 指纹图谱[J].陕西师范大学学报,2006,34(3):89-93.
[5]沈宏伟,鱼红闪,金凤燮,等.绞股蓝中总皂苷的提取及含量研究[J].食品科技,2008(4):158-160.
[6]沈宏伟,鱼红闪,金凤燮,等.绞股蓝皂苷最佳提取条件的研究[J].安徽农业科学,2008,36(4):1332-1336.
[7]YU Hongshan,LIU Hai,ZHANG Chunzhi,et al.Purification and characterization of gypenoside-α-Lrhamnosidase hydrolyzing gypenoside-5into ginsenoside Rd[J].Process Biochemistry,2004,39:861-867.
[8]覃章铮,赵蕾,毕世荣,等.绞股蓝的皂甙成分及资源[J].天然产物研究与开发,1992,4(1):83-98.

