原子力显微镜表征燕麦β-葡聚糖的分子链形态
吴 佳 邓 霄 谢笔钧
(福州大学生物科学与工程学院1,福州 350108)
(福建东南标准认证中心2,福州 350002)
(华中农业大学食品科技学院3,武汉 430070)
原子力显微镜表征燕麦β-葡聚糖的分子链形态
吴 佳1邓 霄2谢笔钧3
(福州大学生物科学与工程学院1,福州 350108)
(福建东南标准认证中心2,福州 350002)
(华中农业大学食品科技学院3,武汉 430070)
利用原子力显微镜(AFM)研究了不同浓度和存放时间对燕麦β-葡聚糖分子聚集状态的影响。考察了SDS、Tween-20和Tween-80三种表面活性剂对聚集体的分散效果。利用粒度分析仪测定了不同浓度β-葡聚糖在溶液中的聚集体尺寸,并和AFM的结果进行了比较。结果显示,聚集体的尺寸随着β-葡聚糖浓度的升高而增大,若将低浓度的β-葡聚糖溶液放置一定时间,其中也可以形成聚集体。表面活性剂SDS能够分散1 μg/mL的β-葡聚糖溶液中的聚集体,得到单个β-葡聚糖分子,通过AFM直接观察了单个糖链的形态。粒度分析仪和AFM测定的聚集体尺寸有一定差异,可能与AFM的制样方法有关。
燕麦 β-葡聚糖 原子力显微镜 分子链形态
燕麦β-葡聚糖是存在于燕麦亚糊粉层和胚乳细胞壁中的一种线型多糖,由β-(1→3)和β-(1→4)糖苷键连接的葡萄糖单位构成[1]。因其具有降血糖、降血脂和免疫调节等活性而受到广泛的关注[2]。大量的研究表明,燕麦β-葡聚糖的生理作用与其在水溶液中的形态和构象密切相关,因而通过适当的方法研究β-葡聚糖在水溶液中的分子状态和聚集行为将有助于对其诸多生理功能的理解。
多糖在溶液中往往可以形成聚集态结构。光散射和黏度研究表明,啤酒中的β-葡聚糖可以形成缨状胶束聚集体[3]。对燕麦β-葡聚糖溶液的黏弹性行为研究证实了低分子质量的β-葡聚糖更容易形成凝胶,并推测β-葡聚糖分子之间产生了物理交联作用[4]。大麦β-葡聚糖的流变学行为则揭示了多糖分子之间是如何在特定的溶液环境中形成网络结构的[5]。对多糖溶液进行适当的处理,可以得到多糖分子的单链,这些单分子链可以利用电子显微镜和其他显微镜技术进行直接观察和形态分析。
原子力显微镜(AFM)是一种研究多糖分子在溶液中的形态和构象的直观方法,已经成功应用于结冷胶、海藻酸盐、果胶、裂褶多糖和淀粉的研究[6]。但是目前利用AFM研究燕麦β-葡聚糖的工作还非常少。鉴于样品的制备方法对AFM的观察结果具有决定性的影响,因而需要仔细选择合适的制样方法和步骤,以得到多糖在不同溶液环境下的真实状态。例如,为了得到单个的多糖分子,有时需要使用表面活性剂进行分散处理。得到了多糖样品的AFM图像之后,可以从中分析出多糖链的轮廓长度、末端距和持续长度等参数,并可以进一步推断出已知结构线型多糖的分子质量和多分散系数等统计学参数。而AFM得到的单分子形貌是其他仪器分析方法所无法获得的,具有独特的价值。
1 材料与方法
1.1 试验材料
燕麦β-葡聚糖:从燕麦粉中提取,经纯化后β-葡聚糖的质量分数为93.8%,相对分子质量4.49×105;十二烷基磺酸钠(SDS):Sigma公司;Tween-20、Tween-80:上海化学试剂公司。
1.2 主要仪器
原子力显微镜:AJ-Ⅲ,上海爱建纳米科技发展有限公司;恒温加热磁力搅拌器:MR 2002,德国Heidolph公司;粒度分析仪:N4 plus,美国Beckman Coulter公司。
1.3 试验方法
1.3.1 用于聚集态观察的样品制备
将燕麦β-葡聚糖溶于适量去离子水中,80℃搅拌溶解1 h使其充分溶解成为澄清透明的溶液,定容,制得1 mg/mL的β-葡聚糖溶液。然后将溶液逐步稀释成为 100、50、20、10、1 μg/mL。按上述方法新鲜制备的溶液即可用于AFM观察。
取不同浓度的燕麦β-葡聚糖样品滴加到云母片表面观察其浓度效应产生的不同聚集状态。将新鲜制备的β-葡聚糖溶液于室温存放9 d后再次观察时间效应导致其在溶液中产生的聚集态结构。
1.3.2 用于单链观察的样品制备
分别将SDS、Tween-20和Tween-80加入β-葡聚糖溶液中,使SDS、Tween-20和 Tween-80的质量浓度均为1 mg/mL,β-葡聚糖的最终质量浓度也为1 mg/mL,并加热溶解,然后用80℃的去离子水将混合溶液逐步稀释成最终质量浓度为1 μg/mL的溶液,最后将约1 μL的溶液滴加至云母片表面并于干燥器中自然干燥。
1.3.3 原子力显微镜观察方法
取1 μL燕麦β-葡聚糖溶液滴加到新鲜切开的云母片表面。于干燥器中自然干燥2 h,然后将表面有样品的云母片置于AFM上观察。硅悬臂的弹性常数为23~91 N/m,驱动频率为315 kHz。样品扫描频率为1~2 Hz。采用AJ在线和离线软件采集和处理数据,并测量观察对象的高度和宽度等数值。
1.3.4 燕麦β-葡聚糖的粒径分布
按照前述方法制备1 mg/mL的燕麦β-葡聚糖溶液,然后分别稀释成1、10、100 μg/mL的溶液。将不同质量浓度的葡聚糖溶液于25℃测定粒度分布,所用的激光波长为632.8 nm,散射角为90°,每个质量浓度的溶液测定3次以保证溶液达平衡状态。
2 结果与分析
2.1 不同浓度燕麦β-葡聚糖在溶液中的聚集状态
燕麦β-葡聚糖即使在稀溶液中也可以形成聚集体结构,10 μg/mL的燕麦β-葡聚糖溶液的AFM图像如图1a所示,图中有许多直径20~50 nm,截面高度3~5 nm的圆形聚集体结构。这些小的球状结构可能是水溶液中燕麦β-葡聚糖分子之间缠绕所形成的聚集体。当云母片上的溶液自然干燥之后,这些球状的聚集体结构坍缩成扁平的球体。另外,AFM针尖的增宽效应也可能是这种具有扁平结构的图像的成因。随着燕麦β-葡聚糖浓度的提高,溶液中逐渐形成越来越大的聚集体结构(如图1b和图1c所示)。在图1b中,燕麦β-葡聚糖的质量浓度为20 μg/mL,其中的扁球状聚集体的直径介于200 nm至800 nm之间;图1c中燕麦β-葡聚糖的质量浓度为50 μg/mL,其中聚集体的直径集中在600 nm至800 nm之间,分布较为均一,这些聚集体的截面高度约为3.6 nm。当燕麦β-葡聚糖的质量浓度上升至100 μg/mL 时,形成了长达 3 μm 的纤维状结构(图1d),这些微纤维的高度约为20 nm,宽度约为300 nm。可见,随着燕麦β-葡聚糖浓度的升高,β-葡聚糖之间形成了越来越紧密的聚集体结构。一般认为,这种聚集效应源于β-葡聚糖之间的氢键相互作用。当提高β-葡聚糖的浓度时,β-葡聚糖分子之间有更多的机会通过热运动而相互碰撞并形成聚集体结构。这些AFM图片提供了燕麦β-葡聚糖分子形成聚集体的直接证据,同时也说明燕麦β-葡聚糖因浓度效应产生的聚集体大小不仅与其浓度成正相关,而且当浓度达到一定大小时,聚集体结构将发生质的变化。从另一个角度提示,多糖的生物或生理效应与其聚集体结构相关。
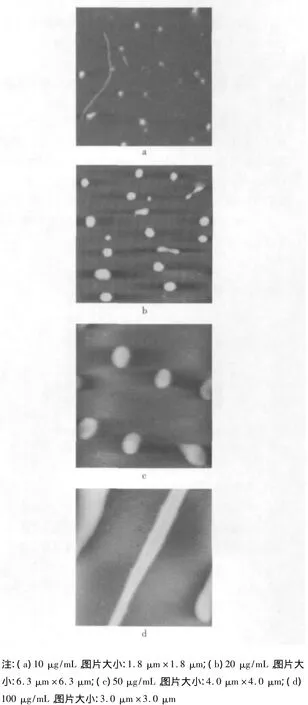
图1 不同质量浓度燕麦β-葡聚糖在溶液中的聚集形态
2.2 存放不同时间后燕麦β-葡聚糖在溶液中的聚集状态
将10 μg/mL的燕麦β-葡聚糖溶液于室温下保存9 d以后观察得到的AFM图像如图2所示。很明显,其中形成了许多扁平的盘状结构,这些圆盘的直径约为300 nm,高度介于15~20 nm之间。这种聚集态结构显示溶液中的燕麦β-葡聚糖分子可以自发通过碰撞和氢键而自组装成相对稳定的结构,尽管这是一个相对缓慢的过程。

图2 燕麦β-葡聚糖溶液于室温存放9 d后的AFM图像及其截面高度图
2.3 燕麦β-葡聚糖单链的观察
2.3.1 用SDS分散燕麦β-葡聚糖
鉴于燕麦β-葡聚糖在溶液中容易形成聚集体,所以采用添加表面活性剂的方法来分散这些聚集体以获得单个的β-葡聚糖分子。结果表明,十二烷基磺酸钠(SDS)可以有效地将β-葡聚糖分散成单个分子。图3中显示了有代表性的燕麦β-葡聚糖分子链形态。这些β-葡聚糖分子链的高度为(0.44±0.1)nm,宽度约2.8 nm。这一结果与硬葡聚糖的数据接近,硬葡聚糖是一种主链由β-(1→3)-D-葡萄糖残基构成并带有(1→6)分支的葡聚糖,其单链高度经X射线衍射测定为0.55 nm[7]。因为燕麦β-葡聚糖分子没有支链,所以其分子链的高度略小于硬葡聚糖的链高。这些链高度数据说明用SDS确实可以将燕麦β-葡聚糖分散成单个分子。AFM图片显示这些单个的燕麦β-葡聚糖分子确实是一种线性无分支的多糖链。直观的证实了前人的研究结果。

图3 用SDS分散的单个燕麦β-葡聚糖分子
2.3.2 用Tween-20和Tween-80分散燕麦 β-葡聚糖
Tween-20和Tween-80也可以用来分散燕麦β-葡聚糖分子,但是所得到的葡聚糖的链高度超过1.0 nm,表明这些链不是单个的分子而可能是几个分子并列所形成的复合体。另外将Tween-20加入葡聚糖溶液中时形成浑浊的溶液,而SDS加入葡聚糖中则形成澄清的溶液,反映出Tween-20和Tween-80并不能像SDS那样有效的将燕麦β-葡聚糖分散成单个分子。这几种表面活性剂分散能力的差异可能源于它们具有不同的疏水效应和自身所带的电荷。Tween-20和Tween-80是中性分子,它们比SDS更加疏水,而SDS是一种离子型的表面活性剂,且其分子具有较小的尺寸。因此SDS能够进入β-葡聚糖分子间的空隙并通过和β-葡聚糖结合而破坏β-葡聚糖分子间的氢键,由于SDS带负电荷,因此结合有SDS的β-葡聚糖分子之间会产生静电排斥作用而有利于其分散。
2.4 不同浓度燕麦β-葡聚糖在溶液中的粒径分布
图4显示,当燕麦β-葡聚糖的质量浓度从1 μg/mL上升至10 μg/mL时,其在水溶液中的粒径稍有增加,当β-葡聚糖的质量浓度继续增加至100 μg/mL时,β-葡聚糖的粒径显著增加。这说明燕麦β-葡聚糖在水溶液中的聚集程度随其质量浓度而变化。当燕麦β-葡聚糖的质量浓度为1 μg/mL时,其粒径为(926±28)nm,这与燕麦β-葡聚糖的分子链长度接近(938 nm,由AFM测定);当燕麦β-葡聚糖的质量浓度上升至10 μg/mL时,其粒径为(1 191±78)nm,而相同质量浓度时从AFM图像中测量的颗粒直径在20~50 nm之间,这一极大的差异说明当10 μg/mL的燕麦β-葡聚糖溶液滴加至云母片表面并在空气中干燥后,β-葡聚糖分子从松散的线型结构转变成紧密的球状结构。可能是云母片表面β-葡聚糖溶液中水分的蒸发使得单个的β-葡聚糖在分子内氢键的作用下形成了这种扁平的球状结构。当β-葡聚糖溶液的质量浓度上升至100 μg/mL时,其在溶液中的粒径为(2 023±180)nm,用原子力显微镜观察到的纤维结构的长度则超过3 000 nm,说明在此质量浓度下燕麦β-葡聚糖可以形成胶束状结构。
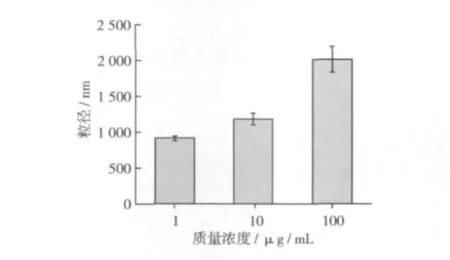
图4 燕麦β-葡聚糖在水溶液中的粒度分布
3 讨论
原子力显微镜和粒度分析仪的测量结果都表明在水溶液中,燕麦β-葡聚糖的粒度随着其浓度的上升而增大。但是两者的测量结果并不一致,这一差异除了说明燕麦β-葡聚糖在水溶液中和在AFM测定条件下的构象不同之外,还表明将β-葡聚糖溶液滴加到云母片表面的制样方法并不能完全反映出β-葡聚糖在溶液中聚集的真实状态。当β-葡聚糖溶液被滴加至云母片表面时,由于水分的蒸发和表面张力的存在,可能导致其构象的改变。而且AFM所得到的是β-葡聚糖分子在云母片表面的二维构象,并不是三维形貌。所以利用AFM技术只能在一定程度上反映燕麦β-葡聚糖的状态。要得到燕麦β-葡聚糖在溶液中的详细信息,还需要借助其他手段。
因为燕麦β-葡聚糖分子在溶液中可以通过扩散而相互接近,并有可能在分子间作用力的影响下相互结合形成聚集体,所以将β-葡聚糖的稀溶液存放一定时间之后,在溶液中也可以形成聚集体。当溶液浓度很低时,这是一个缓慢的过程。
燕麦β-葡聚糖之所以难以被分散是因为分子间的氢键相互作用,利用表面活性剂可以分散β-葡聚糖分子,这说明表面活性剂可以破坏这种氢键相互作用。同时也表明β-葡聚糖分子在某种程度上具有类似疏水性的特性,因此可以和SDS的疏水长链结合,从而被分散。
4 结论
随着浓度的升高,燕麦β-葡聚糖在溶液中所形成的聚集体也随之增大。低浓度的燕麦β-葡聚糖溶液在存放了一定时间之后,也可以形成类似的聚集体。通过加入离子型表面活性剂SDS,成功得到了燕麦β-葡聚糖的单分子。试验表明AFM并不能完全反映出β-葡聚糖在溶液中聚集的真实状态。因而研究多糖分子在溶液中的构象时最好结合其它方法,这样才能准确描述多糖在溶液中的聚集状态。
[1]Woodward J R,Fincher G B,Stone B A.Water soluble(1→3),(1→4)-β-D-glucans from barley(Hordeum vulgare)endosperm.II.Fine structure[J].Carbohydrate Polymer,1983,3(3):207 -225
[2]Kerckhoffs D A,Hornstra G,Mensink R P.Cholesterol lowering effect of β-glucan from oat bran in mildly hypercholesterolemic subjects may decrease when β-glucan is incorporated into bread and cookies[J].American Journal of Clinical Nutriton,2003,78(2):221 -227
[3]Grimm A,Kruger E,Burchard W.Solution properties of β -D - (1,3)(1,4)- glucan isolated from beer[J].Carbohydrate Polymers,1995,27(3):205 -214
[4]Doublier J L,Wood P J.Rheological properties of aqueous solutions of(1→3),(1→4)-β-D -glucan from oats(Avena sativa L.)[J].Cereal Chemistry,1995,72(4):335 -340
[5]Gomez C,Navarro A,Garnier C,et al.Physical and structural properties of barley(1→3),(1→4)- β -D -glucans III.Formation of aggregates analysed through its viscoelastic and flow behavior[J].Carbohydrate Polymer,1997,34(3):141 -148
[6]Round A N,MacDougall A J,Ring S G,et al.Unexpected branching in pectin observed by atomic force microscopy[J].Carbohydrate Research,1997,303(3):251 -253
[7]Bluhm T L,Deslandes Y,Marchessault R H,et al.Solid -state and solution conformation of scleroglucan[J].Carbohydrate Research,1982,100(1):117 -130.
Characterization of Molecular Chain Morphology of Oat β-Glucan by Atomic Force Microscopy
Wu Jia1Deng Xiao2Xie Bijun3
(College of Biological Science and Technology,Fuzhou University1,Fuzhou 350108)
(Fujian Southeast Standard Certification Center2,Fuzhou 350002)
(College of Food Science and Technology,Huazhong Agricultural University3,Wuhan 430070)
Effects of concentration and storage time on aggregation states of oat β-glucan were studied by the atomic force microscopy(AFM).SDS,Tween-20 and Tween-80 were used to disperse the aggregates and the effectiveness was investigated.The sizes of the aggregates were measured by a particle size analyzer and AFM,and then the values from two methods were compared.The results indicated that the sizes of the aggregates increased with increasing concentration.Aggregates could also be observed when a diluted β - glucan solution was stored for a certain time.SDS,a surfactant,could disperse the aggregates into single molecules in 1μg/mL β - glucan solution effectively.The shape of the single molecular chain was observed by AFM.There were differences in the size of aggregates measured by the particle size analyzer and AFM,which might be related to the sample preparation method of AFM.
oat,β - glucan,atomic force microscopy,molecular chain morphology
TS201.2
A
1003-0174(2011)10-0040-05
“十一五”国家科技支撑计划(2006BAD27B09)
2010-12-15
吴佳,男,1980年出生,讲师,硕士生导师,食品化学
谢笔钧,女,1942年出生,教授,博士生导师,食品化学与天然产物化学

