高粱 DNA 导入引起小麦 HMW-GS的 变异及其品质改良和变异机理分析
欧巧明 倪建福 崔文娟 庞斌双
(甘肃省农业科学院生物技术研究所1,兰州 730070)
(北京市农林科学院杂交小麦工程技术研究中心2,北京 100089)
高粱 DNA 导入引起小麦 HMW-GS的 变异及其品质改良和变异机理分析
欧巧明1倪建福1崔文娟1庞斌双2
(甘肃省农业科学院生物技术研究所1,兰州 730070)
(北京市农林科学院杂交小麦工程技术研究中心2,北京 100089)
采用花粉管通道法,将高粱 (Sorghum bicolor L.)基因组 DNA导入粉质籽粒的稳定品系 89122中,后代经多代连续选择优良变异系,并进行了高分子质量麦谷蛋白亚基的 SDS-PAGE电泳检测和品质化验分析。获得 1个稳定遗传变异新品种,与导入受体 89122相比,后代新品系 2001502-23含有 7+8、5+10优质亚基,HMW-GS发生明显变异,GulD1位点基因发生等位变异,其表达产物由原来 (89122)的 2+12亚基为 5+10亚基;其品质指标较受体得到改善,从而实现了受体小麦 HMW-GS基因的遗传转化和品质改良。说明利用花粉管通道法完全可以实现小麦 HMW-GS基因的转化和品质目标性状的遗传改良。而生物诱变是其可能的遗传转化和变异机理之一。
小麦 高粱 DNA 花粉管通道法 高分子质量谷蛋白亚基 (HMW-GS) 等位变异
国内小麦品种麦谷蛋白亚基是改善烘烤品质的限制因子,其中 Glu-D1位点的品质效应来源于 5+10亚基与 2+12亚基之间的差异,5+10亚基取代 2+12亚基将可能改善小麦的烘烤品质[1-3]。近年来,小麦品质的遗传改良愈加被重视。有计划的常规/远缘杂交和系统选育等作为主要手段在小麦品种改良中发挥了重要作用,但这也使得小麦的遗传基因资源愈加狭窄,其品质改良也受到很大限制[4]。花粉管通道法介导的遗传转化等分子育种技术为小麦品质改良提供了新的途径。
已有的研究结果表明,花粉管通道法介导的遗传转化及其后代能产生变异,已相继在 40多种作物上取得了显著成效[5-6];在国外 SCI/EI期刊也相继出现报道[6-10],并已获得大量优良小麦[11-14]新品种。利用花粉管通道法将多种异源基因组 DNA导入春小麦,成功实现了小麦的遗传改良[4,12,15-16]。其中将高粱基因组 DNA导入受体甘麦 8号,经高分子质量麦谷蛋白亚基 (HMW-GS)SDS-PAGE电泳检测,后代 89144的 HMW-GS发生了突变,由受体的2+12亚基变为 5+10亚基,其他几个转基因后代与其受体相比,HMW-GS虽未发生变化,但各亚基的相对质量分数有较大变化,实现了小麦 HMW-GS基因的转化和品质性状的遗传改良[4]。可见,在普通小麦优良谷蛋白基因缺乏的情况下,采用花粉管通道法、分子标记等分子育种技术进行小麦品质改良是完全可行的。
本研究拟采用花粉管通道法,将高粱 (Sorghum bicolorL.)基因组 DNA导入粉质籽粒的稳定品系89122,对其品质进行改良,并对其后代进行 HMWGS检测和品质化验分析,以期引入普通小麦缺乏的优良品质性状基因,在品质育种方面更加突出目标性状的遗传改良,创造特异新种质和优良新品种,也为外源DNA导入创造优良新品种等相关研究提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 供试材料
外源 DNA供体:高粱 6A/115(Sorghum bicolor L.),禾本科高粱属,一年生草本,体细胞染色体数目2n=20,生育期 130 d,分蘖旺盛,抗逆性强,适应性广[17]。由甘肃省农科院生物技术研究所引种。
受体材料:89122,甘肃省春小麦品种,2n=42,籽粒粉质,耐盐碱,高感条锈病,品质较差。由甘肃省农科院生物技术研究所采用花粉管通道法育成的粉质春小麦品种[18]。
1.1.2 仪器
Ther mo Helios可见 /紫外分光光度计:UN I CAM公司;PROTEAN II xi电泳仪 (Biorad Mini-Protean Tetra Electrophoresis System):美国 Bio-rad公司;FTI-500型 Fujifilm凝胶成像系统:Pharmacia公司;Te2 cator1030全自动凯氏定氮仪:瑞典 Tecator公司;GX2 DL-202型蛋白质 -赖氨酸分析仪:北京检测仪器厂;HGT-1000型容重器:上东方衡器厂;BAU-A型沉淀值测定仪:中国农业大学仪器厂。
1.2 试验方法
1.2.1 供体总 DNA的提取
采用 CTAB法,按照刘学春等[19]报道的方法,提取供体高粱基因组 DNA,紫外分光光度计检测,A260/A230=2.13>2.00,A260/A280=1.87>1.80;琼脂糖电泳呈单一区带,无拖尾现象,表明所提纯的 DNA分子质量在 50 ku以上,蛋白质等杂质已去除干净,达到作物DNA导入所要求的纯度。基因组 DNA溶于1×SSC溶液,4℃储存,导入前用蒸馏水稀释至300μg·mL-1。
1.2.2 供体高粱基因组 DNA的导入及后代的处理与选择
供体高粱基因组 DNA的花粉管通道法导入参考倪建福等的方法[4,18]。待导入穗幼胚形成后,记作D0代种子。取其 15~20 d胚龄的幼胚进行幼胚培养,于MS培养基上直接诱导幼胚成苗 (D1),并于温室加代选择,所获 D1代种子进行田间点播。D2代点播于单株选择圃,选择各种变异株,按单株收取种子;自 D3代起播种于株系选择圃,连续选择优良株系,直至获得稳定的变异株系和有价值的育种材料。D4~D6代依次参加高代产量比较试验、品系鉴定试验和品种比较试验,逐代筛选优良品系。自 D1代起进行观察、记载和统计分析。
1.2.3 高分子质量麦谷蛋白亚基鉴定
参考倪建福等的方法[4]。HMW-GS样品的制备过程:单粒种子放入玻璃纸中磨碎后转进 1.5 mL离心管中,加入 150μL提取液 (100 mL中含 12.5 mL,0.5 mmol/L的 TrisHCl,pH 6.7,20 mL,10%的SDS,5 mL巯基乙醇,10 mL甘油,10 mL,0.02%的溴酚蓝),玻棒碾磨 3~5 min,沸水中煮 3 min,6 000~7 000 r/min离心 10 min,取上清液加 125μL,70%乙醇沉淀麦谷蛋白,10 000 r/min再离心5 min,收集沉淀。沉淀凉干后用 50μL提取液溶解待用。
SDS-PAGE:采用 SDS连续缓冲系统,分离胶10%(pH 8.9),浓缩胶 3.5%(pH 6.7)。SDSPAGE电泳:电极缓冲液为 0.025 mmol/L TrisCl,0.192 mmol/L甘氨酸,0.001%SDS,pH 8.3。浓缩胶电压为 200 V,进入分离胶后 100 V稳压电泳。染色、脱色和保存:凝胶用 10%三氯乙酸固定后,0.05%,R-250染色 3 h,7.0%冰乙酸溶液脱色至背景清晰。照相、扫描或干胶保存。
1.2.4 品质分析
自D6代委托省级作物品质化验分析机构 (甘肃省农业科学院农业测试中心)进行新品系的品质化验分析。容重测定:采用称重法 (GB/T5498—1985);粗蛋白含量测定:采用半微量凯氏定氮法(GB5511—1985);氨基酸含量测定:采用染料结合法(GB4801—1984);沉淀值测定:采用 SDS法 (GB/T15685—1995);湿面筋测定:采用手工洗涤法 (GB/T14608—1993);淀粉含量测定:采用采用α-淀粉酶法 (GB/T 9826—1988)。
2 结果与分析
2.1 高分子质量麦谷蛋白亚基鉴定
HMW-GS检测结果显示:后代新品系 2001502-23含有 7+8、5+10优质亚基,与导入受体 89122(含有 7+8、2+12亚基 )相比 ,HMW-GS发生明显变异,GulD1位基因发生等位变异,其表达产物由原来 (89122)的 2+12亚基为 5+10亚基,但高粱种子贮藏蛋白中并没有亚基 5+10,从而实现了麦谷蛋白亚基的改良。这与倪建福等[4]报道的高粱基因组DNA的导入春小麦甘麦 8号的后代 89144的 HMWGS基因变异情况相同。这种相同的异源供体基因组DNA导入不同小麦材料产生了相同的变异情况,其可能的原因是异源高粱基因组DNA的导入对受体基因组中 HMW-GS基因的生物诱变机理和效果相同所致。
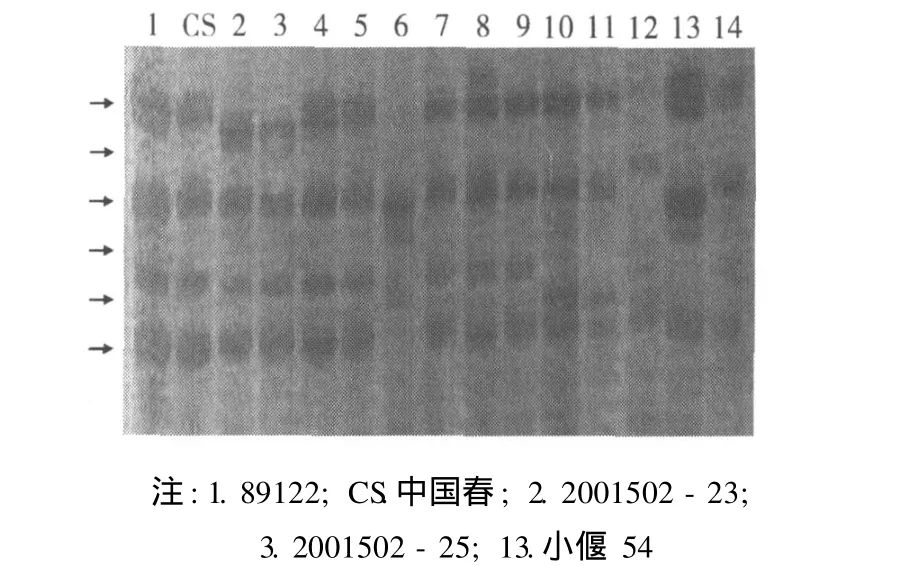
图 1 外源DNA导入受体与后代新品系的 HMW-GS组成的比较
2.2 籽粒和面粉品质分析
外源DNA供体、导入受体与后代新品系的籽粒营养及加工品质分析结果显示,外源 DNA导入新品系 2001502-23的容重、蛋白质含量、籽粒粗蛋白含量、赖氨酸质量分数、湿面筋质量分数、沉淀值等较导入受体 89122和DNA供体高粱均出现不同程度的明显增加 (见表 1)。排除高粱作为杂粮作物本身的品质指标较低外,导入新品系 2001502-23其较导入受体 89122的粗蛋白质量分数提高 17.56%,容重提高3.80%,赖氨酸质量分数提高 9.11%,湿面筋质量分数降低10.30%,沉淀值降低 11.38%,品质类型均属于中筋小麦,导入新品系籽粒综合品质得到明显改善。将高粱DNA导入受体小麦陇春 13就可获得了品质指标得到改良的小麦品系 89122[18]。我国首批面包小麦品种蛋白质质量分数为 14.64%~18.61%[20-21],而小麦淀粉特性是决定含小麦淀粉食品食用品质的一个主要因素[22],沉淀值可作为小麦品种选育过程中预测面条筋力的首选指标[23-25]。这些研究结果证明高粱外源基因导入小麦引起了相应基因表达和蛋白质等籽粒和小麦粉品质性状的变化。

表 1 外源DNA供体、导入受体与后代新品系的籽粒营养及加工品质的比较与分析
3 讨论与结论
利用花粉管通道法将多种异源基因组 DNA导入小麦,实现小麦的品质、抗性等多方面的遗传改良已成为小麦生物技术育种的重要手段之一。
将高粱基因组 DNA导入粉质籽粒的稳定小麦品系,获得 1个稳定的遗传变异优良新品种,实现了受体小麦 HMW-GS基因的遗传转化和品质性状改良,与王广金等[26]、倪建福等[4]、刘香利等[27]报道的结果相同,这说明 HMW-GS基因的转化和遗传变异具有相当的共性,加之目前 HMW-GS基因定位较清楚,有望成为品质遗传改良中的标记基因。
本研究中,异源高粱基因组 DNA导入受体小麦后,后代新品系 HMW-GS发生明显变异,Gul D1位点基因发生等位变异,其表达产物由原来 (89122)的2+12亚基为 5+10亚基,但高粱种子贮藏蛋白中并没有亚基 5+10。该结果与倪建福等[4]报道的高粱基因组DNA的导入春小麦甘麦 8号的后代 89144的HMW-GS基因变异情况相同。这种相同的异源供体基因组 DNA导入不同小麦材料产生了相同的变异情况,其可能的原因是异源高粱基因组 DNA的导入对受体基因组中 HMW-GS基因的生物诱变机理和变异效果相同所致。外源基因进入受体后会受到包括选择在内的各种因素的影响,且涉及到结构基因和调控基因相互作用以及插入片段的位置效应等。张鲁军等[28]报道了 HMW-GS基因可能发生的基因沉默、相关元件的激活等,包括染色体部分缺失、调控元件突变以及基因突变等。李三和等[29]报道,在外源基因的影响下,杂交后代出现了新的、杂交亲本并不表达的高分子质量麦谷蛋白亚基,并认为这是多拷贝的外源基因在不同于受体环境的细胞质中的表达发生了变化,且由于外源基因的插入引起了内源高分子质量麦谷蛋白亚基组成的变异。上述研究中异源高粱基因组 DNA导入受体小麦后的新品系高分子质量麦谷蛋白亚基的变异机理也可能与此情况类似。
另外,关于外源 DNA导入引起变异的机理,提出了各种推测:①外源DNA重组插入具有调节基因功能的高度或中度重复序列,从而改变其调节功能,也不排斥外源 DNA重组插入导致单一序列的结构基因失活或突变[30]。②外源 DNA导入前期或整合时存在被受体切割酶与重组酶适当酶切和重组的过程,从而导致导入后代产生广泛变异[31]。③外源DNA与受体细胞中的组蛋白及非组蛋白结合形成“小染色体”(从而不被酶降解),与受体染色体局部同源,可与受体染色体局部形成“拟联会复合体”,在受体DNA复制时,拟联会复合体中外源DNA和与受体同源DNA片段发生置换;而不同源的小染色体可能以“B-染色体”形式存在或被消化。④个别较小的外源DNA断片有可能在受体 DNA复制时直接插入其中[32]。
外源DNA导入后代性状变异是供体与受体基于DNA分子局部亲和性而产生片段杂交的必然结果。万文举等[33]报道外源 DNA导入的双重作用:直接转化和生物诱变。因此,直接遗传转化和生物诱变均是外源 DNA导入可能的遗传转化机理之一,是一种综合作用的结果。这也表明花粉管通道法会引起很复杂的受体遗传特性的变化。而本研究在不同时间阶段和不同受体材料下的研究结果出现如此相似的结果,这可能是异源高粱基因组 DNA导入小麦后受体基因组发生的相同作用和类似变异的普遍现象。关于高粱DNA导入引起小麦 HMW-GS基因突变的确切分子机理目前正在进行当中,将另文报道。
[1]朱金宝.小麦籽粒高、低分子量麦谷蛋白亚基及其与品质关系的研究[J].中国农业科学,1996,29(1):34-39
[2]马传喜,吴兆.小麦胚乳蛋白组成及高分子量麦谷蛋白亚基与烘烤品质的关系[J].作物学报,1993,19(6):562-566
[3]李兴林,王光瑞,徐凤,等.面包小麦品质性状的研究Ⅱ面包质地品质性状的相关性分析[J].中国粮油学报,1999,14(4):4-7
[4]倪建福,欧巧明,庞斌双,等.高粱总 DNA导入春小麦新品系高分子量麦谷蛋白亚基的变化[J].兰州大学学报(自然科学版),2005,41(6):47-49
[5]孔青,丰震,刘林,等.外源 DNA导入花粉管通道技术的发展和应用[J].分子植物育种,2005,3(1):113-116
[6]Song M,Gu Y H,Qin G Y.Application of a transformation method via the pollen-tube pathway in agriculture molecular breeding[J].Life Science Journal,2007,4(1):77-79
[7]Luo Z X,Wu R.A simple method for transfor mation of rice via the pollen tube pathway[J].PlantMolecular Biology Re2 porter,1989,7(1):69-77
[8]Li Z,Nelson R L,W idhol m J M,et al.Soybean transformation via the pollen tube pathway[J].Soybean Genet Newslett,2002,29:1-11
[9]Shou H X,Pal mer R G,Wang K.Irreproducibility of the Soy2 bean Pollen-Tube Pathway Transformation Procedure[J].PlantMolecularBiology Reporter,2002,20(4):325-334
[10]ChenW S,Chiu C C,Liu H Y,et al.Gene transfer via pol2 len-tube pathway for anti-fusarium wilt in water melon[J].I UBMB Life,2008,46(1):1201-1209
[11]王立新,常利芳,段绍光,等.通过花粉管通道导入外源DNA创造抗白粉病小麦新种质 [J].中国农业科学,2003,36(12):1576-1581
[12]令利军,倪建福,张正英.花粉管通道转基因技术及在小麦分子育种中的应用[J].分子植物育种,2004,2(3):407-412
[13]王永芳,张军,崔润丽,等.利用花粉管通道转化谷子DNAj基因获得转基因小麦 [J].华北农学报,2009,24(2):17-21
[14]周春江,葛荣朝,赵宝存,等.利用花粉管通道法将兔防御素 NP21基因导入小麦的研究[J].华北农学报,2007,22(2):26-28
[15]欧巧明,倪建福,张正英,等.长穗偃麦草 DNA导入引起的冬小麦后代性状变异及其遗传研究[J].麦类作物学报,2005,25(5):18-22
[16]倪建福,令利军,欧巧明,等.外源 DNA导入小麦的分子育种实践[J].麦类作物学报,2005,25(5):27-31
[17]山仑,徐炳成.论高粱的抗旱性及在旱区农业中的地位[J].中国农业科学,2009,42(7):2342-2348
[18]倪建福,周文麟,王亚馥.高粱 DNA导入小麦选育抗条锈白粒新品系[J].兰州大学学报:自然科学版,1994,30(增刊):144-147
[19]刘学春,潘春欣,宋云枝,等.一种单子叶植物总 DNA提取方法的改进与应用[J].山东农业大学学报,1995,26(4):491-492
[20]姚大年,徐风,马传喜,等.中国首批面包小麦品质的研究[J].中国粮油学报,1995,10(4):1-4
[21]刘爱华,何中虎,王光瑞,等.小麦品质与馒头品质关系的研究[J].中国粮油学报,2000,15(2):10-15
[22]赵俊晔,于振文.小麦籽粒淀粉品质与蛋白质品质关系的初步研究[J].中国粮油学报,2004 19(4):17-20
[23]王士杰,林作辑,吴政卿,等.小麦品质微量测定方法的评价[J].中国粮油学报,2006,21(4):124-127
[24]舒卫国,张玉良,王光瑞.冬小麦主要品质性状鉴定及其相关性研究[J].中国粮油学报,1996,11(4):2-7
[25]师俊玲,魏益民,欧阳韶晖,等.小麦品种籽粒品质与中国挂面品质关系研究[J].中国粮油学报,2003,18(3):31-36
[26]王广金,李忠杰,张晓东,等.利用花粉管通道法将编码优质 HMW-GS基因导入小麦进行品质改良的研究[J].黑龙江农业科学,2002,6:1-3
[27]刘香利,刘缙,郭蔼光,等.小麦高分子量麦谷蛋白 14亚基基因的花粉管通道法转化[J].西北农林科技大学学报:自然科学版,2008,36(1):121-124
[28]张鲁军,焦浈,史艳芹,等.小麦高分子量麦谷蛋白基因沉默研究进展[J].麦类作物学报,2009,29(6):1129-1133
[29]李三和,李举,王娜丽,等.外源 1Dx5基因导致小麦高分子量麦谷蛋白亚基表达变异[J].生物技术通讯,2007,18(2):217-219
[30]刘芳,袁鹰,高树仁,等.外源 DNA花粉管通道途径导入机理研究进展[J].玉米科学,2007,15(4):59-62
[31]赵炳然.外源 DNA直接导入植物后的整合与分子验证[J].作物研究,1998(4):1-3
[32]王玉元.染色体遗传中的一个不解之谜——B染色体[J].武汉植物学研究,1997,15(1):73-79
[33]万文举,邹冬生,彭克勤.论生物诱变——外源 DNA导入的双重作用 [J].湖南农学院学报,1992,18(4):886-891.
Introducing Sorghum DNA into SpringWheat:HMW-GS Variation,Quality I mprovement and ItsMechanis ms
Ou Qiaoming1Ni Jianfu1CuiWenjuan1Pang Binshuang2
(Bio-technology Institute,Gansu Academy ofAgricultural Sciences1,Lanzhou 730070)
(HybridWheat Engineering And Technique Research Center,Beijing academy of agriculture and forestry sciences2,Beijing 100089)
The genome DNA of sorghum was introduced into floury grain springwheatNo.89122 via the pollen tube pathway.Excellent variant lineswere chosen with multi-generation selecting.The detection of HMW-GS by SDS-PAGE electrophoresis and quality analysiswere conducted.One stable variantwasobtained.Comparedwith its recipientNo.89122,the new variant 2001502-23 contained quality subunits 7+8 and 5+10,significant variation of HMW-GS occurred,gene alleles appeared in Gul D1Locus,and HMW-GS 5+10 were expressed in variants 2001502-23 while subunits 2+12 were presented in its recipient No.89122. Its quality indexes were i mproved compared with the receptor.Thus the genetic transformation of HMW-GS gene and quality improvement for the re2 ceptorwheatwas realized in this study.This result indicates that the genetic transfor mation of HMW-GS gene and ai m character i mprovement of quality in wheat can be entirely achieved via the pollen tube pathway.In addition,the bio-inducted mutation is one of the mechanisms of its genetic transfor mation.
wheat,sorghum DNA,pollen-tube pathway,HMW-GS,gene alleles
S512.332
A
1003-0174(2011)01-0015-05
甘肃省重大科技专项(0801NKDA015),甘肃省科技支撑计划[自然科学基金 ](0803RJZA041),甘肃省农科院农业科技创新专项(2009GAAS16)
2010-03-22
欧巧明,男,1976年出生,助理研究员,硕士,小麦生物技术育种及品质改良
倪建福,男,1951年出生,研究员,小麦生物技术育种

