壳聚糖抗坏血酸盐的制备及其抗氧化性的研究
刘静娜,庄远红,耿微微
(漳州师范学院生物科学与技术系,福建漳州363000)
壳聚糖抗坏血酸盐的制备及其抗氧化性的研究
刘静娜,庄远红,耿微微
(漳州师范学院生物科学与技术系,福建漳州363000)
制备了壳聚糖抗坏血酸复合盐,并研究了抗氧化性。以壳聚糖和抗坏血酸为原料制备了复合盐,对其结构进行了表征,并测定了其溶解性、稳定性、抗氧化性等性质。对原料配比、反应温度和反应时间进行探讨,发现最优工艺条件为原料配比为1∶6、温度为25℃、时间为120min,在此条件下制得的复合盐有较好水溶性,在溶液中的稳定性优于抗坏血酸,清除羟基自由基的能力优于壳聚糖,从红外光谱图上可看出抗坏血酸结合于壳聚糖的氨基上。该复合盐的制备改善了其原料的性质,有利于进一步的应用。
壳聚糖,抗坏血酸,抗氧化
壳聚糖(Chitosan)是由甲壳素(Chitin)经过脱乙酰化得到的聚氨基葡萄糖,具有良好的生物相容性、安全性,有多种生物活性,在食品、化工、医药及生物医学工程等诸多领域的应用研究取得了重大进展[1]。近年来的研究发现,壳聚糖还是一种良好的抗氧化剂,在体外和体内实验中,壳聚糖都表现出良好的对自由基的清除作用、提高体内抗氧化酶的活性等作用[2-5]。但壳聚糖不能直接溶于水中,也不溶于一般的有机溶剂,只能溶于酸性溶液中,这在很大程度上限制了它的应用[6]。壳聚糖大分子上分布着许多活泼的羟基、氨基,可以通过化学改性改善壳聚糖的溶解性能,进而提高其功能活性[7]。维生素C(vitamin C),又名L-抗坏血酸(L-ascorbic acid),是含有6个碳原子的酸性多羟基化合物,也是一种人体必需的水溶性维生素。抗坏血酸可以提高人体的免疫力,增强人体抵抗能力,这可能与抗坏血酸是一种人体抗氧化剂有关,它可以消除人体内多余的活性氧和自由基,使人体细胞保持健康状态[8]。壳聚糖是自然界唯一的碱性多糖,而抗坏血酸呈酸性,因此,本文制备了壳聚糖抗坏血酸复合盐,从而改善壳聚糖不溶于水的缺点,同时壳聚糖的大分子结构可以保护抗坏血酸、延缓其被空气中的氧气氧化。此外,还对其物化性质及抗氧化性进行了探讨,为壳聚糖的进一步应用提供理论基础,具有一定的学术意义。
1 材料与方法
1.1 材料与仪器
壳聚糖 购自浙江金壳生物有限公司,脱乙酰度90%,粘度50cP·s;L-抗坏血酸、异丙醇、无水乙醇、冰醋酸、邻二氮菲等 均为分析纯。
DHG-9070A型电热恒温鼓风干燥箱、DKZ-1型电热恒温振荡水槽 上海精宏实验设备有限公司;UV-754分光光度计 上海第三分析仪器厂;HH-2数显恒温水浴锅 金坛市江南仪器厂;LG-D2型真空冷冻干燥机 沈阳新阳仪器设备有限公司;90-2恒温磁力搅拌器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 壳聚糖抗坏血酸盐的制备 在500mL的三口烧瓶中加入150mL异丙醇和50mL水配制异丙醇水溶液,称取一定量的抗坏血酸并以异丙醇水溶液溶解,再加入一定量的壳聚糖,将烧瓶放入振荡器中,在一定温度下恒温振荡一定时间。反应结束后,将反应体系进行抽滤、洗涤,然后将滤饼进行真空冷冻干燥,最后得到产物。选择反应配比(壳聚糖的-NH2和抗坏血酸的摩尔比),反应时间和反应温度进行壳聚糖抗坏血酸盐制备的三因素三水平正交实验,因素水平见表1。

表1 制备壳聚糖抗坏血酸盐的因素水平表
1.2.2 壳聚糖抗坏血酸盐中有效Vc含量的测定 分别准确称取抗坏血酸0.025、0.05、0.075、0.1、0.125g,溶于0.1mol/L的盐酸溶液中,用紫外分光光度计在242.5nm处测其吸光度,并制作其标准曲线[9-10]。

图1 抗坏血酸含量标准曲线
取按不同因素水平制备的抗坏血酸盐产物0.1g溶于0.1mol/L的盐酸中,用紫外分光光度计在242.5nm处测其吸光度,计算壳聚糖抗坏血酸盐中有效Vc含量。
1.2.3 产物结构表征 取壳聚糖原料及壳聚糖抗坏血酸盐产物,用KBr压片后在傅立叶红外仪(FTIR)上进行结构分析。
1.2.4 溶解性的测定 取制得的适量(0.1g)壳聚糖抗坏血酸盐置于试管,加10mL去离子水、HCl(1%)、乙酸(1%)、丙酮、乙醇溶剂,放入振荡培养箱中振荡24h,观察其溶解现象。
1.2.5 稳定性的测定 将纯L-抗坏血酸和壳聚糖抗坏血酸盐分别溶解在pH=4.8的乙酸-乙酸钠缓冲溶液、蒸馏水、pH=10.0的碳酸钠-碳酸氢钠缓冲溶液,在室温下放置,定期测定其最大吸收波长处的吸光度值[9]。
1.2.6 对羟基自由基的清除 采用邻二氮菲-Fe2+氧化法[11]。计算不同样品对·OH的清除率:

式中:A样为样品组的吸光值;A损为损伤管的吸光值;A未损为未损伤管的吸光值。
2 结果与讨论
2.1 壳聚糖抗坏血酸盐的制备
抗坏血酸容易失去活性,在60℃以上就会分解,所以选择比较温和的实验条件来制备壳聚糖抗坏血酸盐,反应时间也不宜过长。通过反应配比、反应时间和温度三因素的水平变化来讨论其对壳聚糖抗坏血酸盐有效Vc含量和溶解性的影响,实验结果见表2。

表2 壳聚糖抗坏血酸盐制备的正交实验结果
从表2中可以看出,反应时间延长有助于提高产物壳聚糖抗坏血酸盐中有效Vc含量;而且抗坏血酸的浓度越大,有效Vc含量也就越大;但在一定温度范围内,抗坏血酸的活性会随着温度升高而被破坏,因此25℃时比40℃时反应得到的产物抗坏血酸含量更高。由结果分析可知,制备壳聚糖抗坏血酸盐的最优条件组合为A2B1C3或A3B1C3,后者即为实验7的条件组合,从表中可看出,该条件下所制得的产品中有效Vc含量最高,因此最终确定反应配比1∶6,温度25℃,时间120min为最佳反应条件,此时反应程度最高,产物中有效Vc含量最大,而且该产物在水中可以全部溶解。由极差分析可知,对正交结果的影响为温度>配比>时间,即温度对壳聚糖抗坏血酸盐的制备影响最大,配比次之,时间影响最小。
2.2 壳聚糖抗坏血酸盐的红外表征

图2 壳聚糖及壳聚糖抗坏血酸盐的红外光谱图
将壳聚糖及壳聚糖抗坏血酸盐用红外光谱进行结构表征,结果如图2所示。从图中可知,经过成盐反应后,3428cm-1处的N-H伸缩峰由原来的尖而窄变得钝而宽,表明抗坏血酸通过壳聚糖的-NH2键进行结合。在壳聚糖抗坏血酸盐的谱图中,增加了1032cm-1和1062cm-1的峰,这是C-O伸缩振动,表明结合上了抗坏血酸分子。
2.3 壳聚糖抗坏血酸盐的溶解性
将壳聚糖原料及产品壳聚糖抗坏血酸盐溶解于水、盐酸及常用有机溶剂,结果如表3所示。结果表明,壳聚糖抗坏血酸盐在水溶液中的溶解性比壳聚糖原料提高很多,能完全溶于水;在稀盐酸和乙酸这两种酸性溶剂中的溶解速度也大大加快,但是在常用有机溶剂中仍然不溶解。壳聚糖抗坏血酸复合盐的水溶性使其在食品和营养领域的应用范围大大拓宽。

表3 壳聚糖及壳聚糖抗坏血酸盐的溶解性
2.4 不同pH环境中壳聚糖抗坏血酸盐的稳定性
2.4.1 纯L-抗坏血酸浓度随静置时间的变化 将分别溶于水、乙酸盐缓冲液、碳酸盐缓冲液的L-抗坏血酸溶液在室温下静置,定时测定其最大吸收波长处的吸光度,以观测Vc浓度随时间的变化情况,结果如图3所示。由图可知,Vc在pH=10.00的碳酸盐缓冲体系中浓度变化速度最快,平均每分钟下降1.3%;而在水中和在pH=4.8的乙酸盐缓冲液中吸光度值下降趋势几乎相同,下降速率分别约为0.5%/min和0.44%/min。
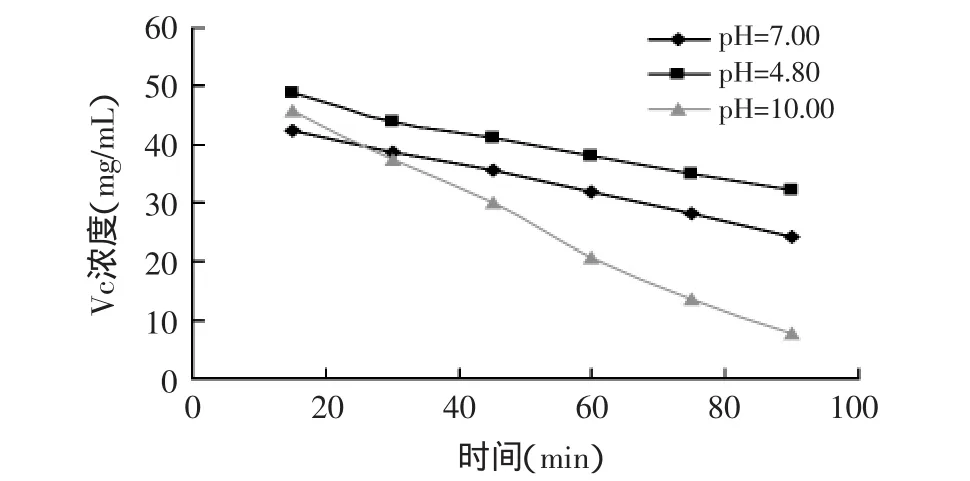
图3 纯L-抗坏血酸在不同pH下静置时间对Vc浓度的影响
2.4.2 壳聚糖抗坏血酸盐浓度随静置时间的变化 将壳聚糖抗坏血酸盐分别溶于pH为4.8、7.0和10.0的溶液中,观测其中有效Vc含量随时间的变化。由图4可以看到,壳聚糖抗坏血酸盐在水体系中最不稳定,Vc浓度每天下降最快;而在pH=10.00的碳酸盐缓冲体系中下降次之,在pH=4.8的乙酸盐缓冲液中每天下降则为最慢。
图3和图4反映的是Vc在不同pH体系中的稳定性,纯L-抗坏血酸在水中的稳定时间不超过3h,即使是在pH=4.8的乙酸盐缓冲液中也不过数小时。而对壳聚糖抗坏血酸盐而言,稳定性有所提高,在pH=4.8的乙酸盐缓冲液中一周内都未观察到明显的分解,在水和pH=10.00的碳酸盐缓冲体系中要完全分解也至少需要一周的时间。这是因为抗坏血酸成盐,对酸、氧的稳定性大大提高,壳聚糖与抗坏血酸反应成盐,保护了其抗氧化性。结果表明了壳聚糖抗坏血酸盐稳定性明显高于纯L-抗坏血酸。
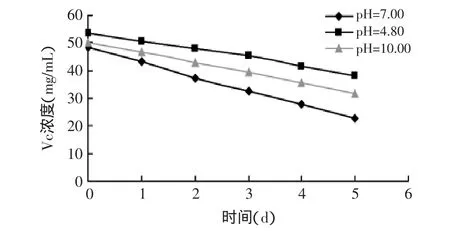
图4 壳聚糖抗坏血酸盐在不同pH下静置时间对Vc浓度的影响
2.5 壳聚糖抗坏血酸盐对羟基自由基的清除
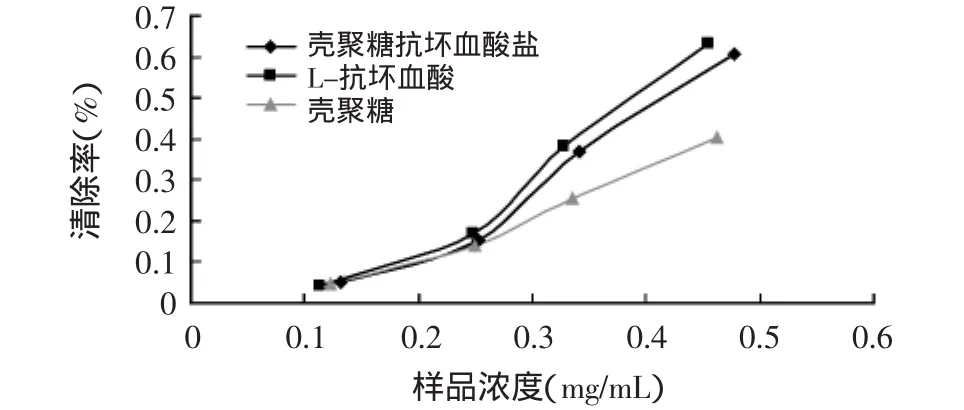
图5 原料和产物对羟基自由基的清除效果
羟基自由基是自由基对人体造成损伤,导致人体衰老的重要原因之一,其损害作用主要体现在对生命大分子的损害。羟基自由基是已知的最强氧化剂,可以与几乎所有的细胞成分发生反应,对机体危害极大,与衰老、肿瘤等密切相关[12]。不同浓度的壳聚糖、抗坏血酸及壳聚糖抗坏血酸盐对羟基自由基(·OH)清除作用的结果见图5。由图可知,随着浓度的升高,抗坏血酸及壳聚糖抗坏血酸盐对羟基自由基的清除能力增强较明显,其半抑制浓度IC50(当清除率达到50%时,所需自由基清除剂的浓度)分别为0.38、0.39mg/mL,二者之间的羟基自由基清除能力大致相同,而壳聚糖原料对羟基自由基的清除能力相对较差。由此可见壳聚糖与抗坏血酸反应成盐后,壳聚糖起到了很好地保护抗坏血酸的载体作用,并未影响其抗氧化能力,而且增强了壳聚糖本身的抗氧化能力。
3 结论
本文利用壳聚糖在异丙醇介质中与抗坏血酸进行反应,在原料配比1∶6,温度25℃,时间120min的最优工艺条件下,制备了水溶性较好的壳聚糖抗坏血酸盐。对产物的结构用红外光谱进行表征,表明抗坏血酸结合在壳聚糖的活性氨基上。对产物的物化性质进行了测定,表明产物的水溶性和对羟基自由基的清除能力都优于原料壳聚糖;稳定性优于原料抗坏血酸。该结果表明,壳聚糖与抗坏血酸结合之后,产物的性能得到了改良,将更有利于其在食品、医药等领域的应用,具有较高的使用价值。
[1]蒋挺大.甲壳素[M].北京:中国环境科学出版社,1999:376.
[2]Li W,Jiang X,Xue P,et al.Inhibitory effects of chitosan on superoxideanionradicalsandlipidfreeradicals[J].ChineseScience Bulletin,2002(11):887-889.
[3]Yena M T,Tsengb Y H,Lia R C,et al.Antioxidant properties of fungal chitosan from shiitake stipes[J].LWT-Food Science and Technology,2007,40(2):255-261.
[4]Jeon T,Hwang S G,Park N G,et al.Antioxidative effect of chitosan on chronic carbon tetrachloride induced hepatic injury in rats[J].Toxicology,2003,187(1):67-73.
[5]刘静娜,张家骊,夏文水.壳聚糖降低脂质过氧化作用的研究[J].食品与生物技术学报,2010,29(6):836-841.
[6]胡章,李思东,李先文.新型壳聚糖季铵盐衍生物的合成与表征[J].广东海洋大学学报,2009,29(1):58-59.
[7]姚倩,孙涛,周冬香,等.壳聚糖衍生物的抗氧化性能研究进展[J].食品科技,2007(10):109-111.
[8]黎观红,瞿明仁,晏向华,等.Vc的营养和应用研究进展[J].粮食与饲料业,2001(4):28-32.
[9]韩颖达.新型壳聚糖/抗坏血酸复合物的制备与应用性能研究[D].天津大学,2007:20-21.
[10]袁叶飞,甄汉深,欧贤红.分光光度法测定大枣中的维生素C含量[J].安徽中医学院学报,2006,25(2):1-5.
[11]张敬晗,金黎明,张盼,等.壳聚糖及其衍生物清除羟自由基的能力[J].大连民族学院生命科学学院,2008,10(7): 23-24.
[12]金惠铭.病理生理学[M].上海:复旦大学出版社,2005:81-83.
Study on preparation and antioxidation of chitosan-ascorbic acid compound
LIU Jing-na,ZHUANG Yuan-hong,GENG Wei-wei
(Department of Biological Sciences and Biotechnology,Zhangzhou Normal University,Zhangzhou 363000,China)
Chitosan-ascorbic acid compound was prepared and its antioxidation was studied.The compound was prepared with chitosan and ascorbic acid,and the structure,solubility,stability and antioxidation were determined.The optimal technology was 1∶6 of material ratio,25℃ of temperature and 120min of time.The compound prepared under this condition showed better solubility and hydroxyl free radical scavenging ability than chitosan,and better stability in the solution than ascorbic acid.Infrared spectrum exhibited that ascorbic acid bound with the amino group.The product improved the ability of materials,which was good to the further application.
chitosan;ascorbic acid;antioxidation
TS201.2
A
1002-0306(2011)10-0139-04
2011-07-29
刘静娜(1980-),女,博士,讲师,主要从事生物活性物质与功能性食品的研究。
福建省青年科技人才创新项目(2009J05038);漳州师范学院博士启动课题项目(L20812)。

