有机胺溶液吸收CO2的研究现状及进展
吕碧洪,金佳佳,张 莉,李 伟
(浙江大学 环境工程研究所,浙江 杭州 310058)
特约述评
有机胺溶液吸收CO2的研究现状及进展
吕碧洪,金佳佳,张 莉,李 伟
(浙江大学 环境工程研究所,浙江 杭州 310058)
温室气体引起的全球气候变暖已成为国际社会关注的焦点。而CO2作为最主要的温室气体之一,它的减排与控制刻不容缓。综述了国内外CO2捕集技术中有机胺溶液吸收法的研究现状,概述了常用的一乙醇胺、二乙醇胺、N-甲基二乙醇胺、2-氨基-2-甲基-1-丙醇等有机胺溶液吸收法,以及有机胺与其他溶剂混合吸收CO2的研究现状及进展;简要阐述了有机胺溶液吸收CO2的反应机理及反应动力学研究;介绍了国内外CO2捕集与封存技术的应用现状,并预测了有机胺溶液与其他溶剂混合吸收CO2的方法将是该方法的研究趋势之一。
吸收;二氧化碳;有机胺
随着现代工业的迅猛发展,人类对煤、油、天然气等含碳化合物燃料的大规模使用,以及大面积森林火灾和绿色植物的破坏,导致大气中CO2的浓度逐年增加。而由温室气体引起的全球气候变暖可能引发冰川融化、干旱蔓延、作物生产率下降、动植物发生变异等自然灾害,已成为当今社会最为显著的环境问题之一[1]。政府间气候变化专门委员会(IPCC)《气候变化 2007:综合报告》[2]中指出,2005年大气中 CO2和 CH4的含量远远超过了过去650 000年的自然变化的范围。IPCC排放情景特别报告[3]预估,到2030年,在全球混合能源结构配置中化石燃料仍保持主导地位,全球温室气体排放量在2000—2030年期间则会增加25% ~90%(CO2当量),预估未来20年全球将以每十年约升高0.2℃的速率变暖。CO2作为最重要的温室气体之一,它的控制与减排已势在必行。
对于目前大气中已有的高含量CO2,以及化石燃料型的全球能源结构无法短时间转变的现状,众多CO2控制技术中,CO2捕集与封存是最为直接和高效的方法。CO2捕集方式主要有三大类:整体煤气化联合循环发电系统、富氧燃烧、燃烧后捕集。而针对21世纪60% ~80%的碳减排目标[2],燃烧后捕集被公认为是近期可行的 CO2减排方法[4-5]。捕集CO2的方法可分为化学溶剂法、物理溶剂法、膜分离法等几大类[6]。由于烟气温度高、气量大、成分复杂、CO2压力和含量相对较低,因此用物理溶剂法、膜分离法不太经济[7]。化学溶剂法中常用的是有机胺溶液吸收法,在实际工业应用中,一乙醇胺(MEA)和二乙醇胺(DEA)溶液吸收工艺已较为成熟,但仍存在一定的缺陷。N-甲基二乙醇胺(MDEA)、位阻胺以及混合胺体系开始成为研究的热点。
本文综述了有机胺溶液吸收CO2的研究现状,概述了其反应机理及反应动力学,并提出了有机胺溶液吸收CO2方法的研究趋势,介绍了国内外CO2捕集与封存技术的应用现状。
1 单一有机胺溶液
1.1MEA/DEA
用有机胺溶液富集CO2的文献最早见于1920年末[8],当时就已有人注意到用有机胺溶液吸收CO2具有比较理想的效果。经过几十年的发展,如今有机胺已成为应用最广泛的CO2吸收剂。
MEA属伯胺,碱性较强,与CO2反应具有吸收迅速、吸收能力强的特点,但MEA水溶液容易发泡、降解。MEA与CO2反应生成的产物氨基甲酸盐较稳定,溶液再生温度较高,蒸汽消耗量大;氨基甲酸盐的腐蚀性较强,CO2负荷较高时腐蚀犹为严重。此外,在与空气接触或原料气中含氧时,MEA易降解,生成草酸、蚁酸和少量的醋酸以及结合的有机酸类,更增强了MEA溶液的腐蚀性。当原料气中含有SO2和Cl-等时,MEA与之反应生成不能再生的化合物;同时,MEA的蒸气压高,因而MEA的损失较大[9]。早期小规模处理装置中MEA的吸收容量(以1 mol MEA吸收的CO2的物质的量计)仅限于0.5 mol/mol以内,MEA溶液质量分数一般不超过20%。
1950年后,法国和加拿大针对净化大量的H2S与CO2含量高的天然气的要求,开发了以DEA为溶剂吸收CO2的新工艺,即SNPA-DEA工艺。DEA是仲胺,它的特点及缺陷都与MEA类似。
不少学者对MEA和DEA的物性参数进行了研究,Rebolledo-Libreros等[10]研究了 DEA 在303.15 ~343.15 K 时的密度和黏度;Chiu 等[11]在30~80℃下考察了CO2在几种有机胺中的热容。此外,为了克服MEA法的缺陷,研究者通过各种方式对该方法进行了补充和改进。Tobiesen等[12]对MEA法的再生过程进行了模拟研究,提出了通入惰性气体提高再生压力(大于0.2 MPa)以降低再生能耗的方案,研究结果表明,与常压再生相比加压后再生能耗下降。通过改进,MEA/DEA法的缺陷得到一定的弥补,目前MEA、DEA是工业上应用最广泛的CO2吸收剂,但高的消耗和生产成本仍制约着该方法的进一步推广。
1.2MDEA
MDEA 法是20世纪70年代由德国BASF公司开发的。MDEA是叔胺,分子中不存在活泼氢原子,因而化学稳定性好,不易降解变质;MDEA水溶液的发泡倾向和腐蚀性均低于伯胺和仲胺;MDEA与CO2反应生成亚稳定的氨基甲酸氢盐,故再生容易,能耗低。因此,该工艺在世界范围内逐渐得到应用[13]。
近年来,采用MDEA溶液脱除CO2的方法越来越引起关注。Rho等[14]测定了CO2在MDEA溶液中的溶解度;Rowley等[15]测定了MDEA在水中的扩散系数;Shi等[16]研究了MDEA与CO2反应的动力学;曹长青等[17]用渗透理论建立了MDEA同时吸收H2S和CO2的传质动力学模型。这些基础数据的研究也为该方法的实际应用提供了设计依据。由于MDEA溶液与CO2反应速率较慢,因此还需要加入某些添加剂,改善它的脱碳和脱硫性能,以提高 MDEA 吸收 CO2的速率[18]。
1.3 位阻胺
1964 年,Sharma[19]关注到位阻胺的性质,并提出了位阻胺的空间位阻效应。位阻胺是一大类涉及数百种具有空间位阻效应的有机化合物。研究发现,在胺分子中引入某些具有空间位阻效应的基团,可明显改善有机胺吸收剂的脱碳和脱硫效果。目前最常用的空间位阻胺是2-氨基-2-甲基-1-丙醇(AMP)。由于位阻胺的空间位阻效应使它生成的碳酸盐十分不稳定,有利于有机胺的再生,在降低能耗的同时提高了再生效率。同样由于空间位阻效应的影响,位阻胺与CO2的反应比链状取代基的伯胺和仲胺慢,但比叔胺快。在基础研究中,Chan等[20]检测了 AMP在298~353 K 时的密度和容积比;Zhang等[21]分析了AMP和MDEA在278~368 K时的摩尔热容和热焓等。
日本三菱重工公司发现了一种新的CO2吸收剂,是被称为KS-1和KS-2的位阻胺类吸收剂,它回收CO2所需的能量比MEA约少20%。因为KS-l和KS-2对热更稳定、腐蚀性也比MEA小,因此操作时胺类的总损失约为常规吸收剂的1/20。对于能量费用不昂贵的地区,在大规模装置上采用这种新工艺,CO2回收费用(包括压缩所需费用)约为20美元/t,比基于MEA的常规法低约30%。日本三菱重工公司已在马来西亚一套尿素装置上验证了这一技术,可从烟气中回收CO2200 t/d[22]。
虽然位阻胺溶液优势明显,但也因为存在空间位阻效应,使其吸收CO2的速率较MEA和 DEA慢,从而影响了该技术的应用。
2 混合有机胺溶液
对于单组分有机胺,吸收与解吸是一个矛盾。为了寻找既有良好吸收性能又易于解吸的溶剂,研究者想到了采用混合有机胺作为吸收剂的方法[23-35],主要思路是把反应速率较快而腐蚀性强、再生能耗高的胺与腐蚀性低、再生能耗小但反应速率慢的胺相混合,从而改善吸收CO2的过程。20世纪90年代美国的气体研究院和气体加工者协会联合开展了一项“酸性气体处理”的研究计划,其中对混合胺溶剂的性能及其工业应用进行了全面研究,大大推进了混合胺溶剂的技术开发。目前,比较热门的混合胺类型主要有以下几种。
2.1 添加剂保护法
针对MEA法的缺陷,不断有研究者提出改善方法。20世纪60年代末,美国联碳公司将缓蚀剂(亦称胺保护剂)加入到MEA水溶液中,从而增加了脱碳负荷,减少了能耗[34]。中国南京化学工业集团研究院采用抗氧化剂和活性胺[18]解决了MEA的化学降解问题,随后开发了一组缓蚀剂配入复合胺溶液中,使溶液对设备的腐蚀速率小于0.1 mm/a,从根本上解决了MEA法对设备腐蚀严重的技术问题。该技术于2001和2002年分别在中国石化四川维尼纶厂和青海油田格尔木炼油厂甲醇车间回收烟道气中3 000 m3/h CO2装置上进行了工业应用,各项消耗指标达到预期效果,取得了较大的直接经济效益。
目前工业上采用的MEA/DEA法,大部分都已采用胺保护法以弥补该方法的缺陷并强化CO2吸收能力,降低经济成本。
2.2 有机胺混合溶液
MEA/DEA与MDEA的混合体系最先被提出。通过混合MDEA和MEA/DEA,使MDEA的高处理能力与MEA/DEA的高反应速率相结合。在基础研究方面,Hagewiesche等[29]建立了 MEA+MDEA混合溶剂吸收CO2的传质模型,并求得温度为40℃时的传质系数公式。相关中试[35]结果表明,混合胺溶液富集CO2的方法具有能提高吸收速率、节约再生能耗、降低腐蚀等优点。但由于体系的研究数据还不够充分,目前仍处于实验研究及小规模试用阶段。
近年来也有学者提出MEA/DEA与AMP的混合体系,并做了一定的研究。Mandal等[36]研究了AMP+MEA中CO2和N2O在293~313 K时的溶解度和扩散系数。Alvarez等[30]检测了在298~323 K时AMP+MDEA+MEA的密度和黏度。此外,Choi等[37]的研究结果表明,在AMP溶液中加入少量的MEA可明显提高CO2的吸收速率。
早在1982年,MDEA与哌嗪(PZ)的混合物用于吸收CO2的工艺就已获得专利,该体系以其高吸收速率及高吸收容量的优势,在合成气装置中广泛用于脱除CO2。此后的学者对该混合体系的动力学和反应机理等进行了完善[38-39]。张旭等[40]采用填料塔研究了加压条件下PZ与MDEA混合水溶液吸收CO2的动力学;Zhang等[41]探究了MDEA和PZ体系吸收CO2的动力学机理。这些实验研究结果都表明,将PZ加入以反应速率为限制的有机胺体系中,将极大地加快吸收速率,从而弥补反应速率的制约缺陷。
项菲等[42]研究了二乙烯三胺(DETA)与MDEA、三乙烯四胺(TETA)与MDEA的混合有机胺水溶液,在双搅拌釜反应器中吸收模拟烟道气中的CO2。研究结果表明,在 MDEA中加入少量DETA或TETA,可显著提高CO2吸收速率和吸收容量,吸收效果优于常用的MEA和DEA。
此外,还有其他混合胺溶液(如MDEA与三乙醇胺、MEA与烯醇胺等)用于吸收CO2。
2.3 有机胺与氨基酸盐的混合溶液
20世纪80—90年代,氨基乙酸作为添加剂开始应用于合成气脱除CO2等净化领域。氨基酸盐溶液具有蒸气压低、表面张力系数高、即使有O2存在也不易降解、与CO2有高反应活性和高吸收容量等优点[43-44],但再生困难。因此,需要通过添加活化剂等对氨基酸盐溶液进行改良,常用的活化剂有无机盐和有机胺两类,PZ便是一种常用的高效活化剂。陆建刚等[45]选择了两种低相对分子质量的氨基乙酸和氨基丙酸作为吸收剂,考察了它们在膜接触器中吸收CO2的性能,同时在氨基乙酸溶液中添加PZ活化剂形成新型的氨基酸基复合溶液。研究证明,少量的PZ具有明显的活化作用,能显著增强传质效率。
2.4 有机胺与离子液体的混合溶液
1999年,Blanchard等[46]发现CO2在1 -丁基 -3-甲基咪唑六氟磷酸盐([Bmim][PF6])离子液体中具有很高的溶解度。离子液体因具有蒸气压低、不易给气体引入其他杂质、且对CO2吸收具有极高选择性、能有效降低离子液体在吸收过程中的损耗从而降低运行成本等优点,被认为是比较具有应用前景的新型吸收剂。但离子液体吸收CO2是物理吸收过程,存在吸收速率较慢、吸收容量低等缺陷。
Camper等[47]将室温离子液体与MEA/DEA混合,研究了混合溶液对CO2的吸收情况,取得了一定的成效。该混合方法将有机胺与离子液体混合,将有机胺吸收速率快、吸收容量高的特点与离子液体蒸气压低、稳定性良好等性质相结合,相辅相成,改善了CO2处理能力。
3 有机胺吸收CO2的机理及反应动力学
3.1 “穿梭”机理和“两性离子”机理
Danckwerts等[48]认为胺在气液界面处与 CO2反应后又会在溶液主体中得到再生,即该过程符合“穿梭”机理,如图1所示。有机胺再生反应只在溶液主体中进行,而反应消耗的有机胺需溶液主体扩散供给;吸收过程中生成的胺基甲酸根离子扩散至溶液主体,再反应生成有机胺,如此往复扩散,就形成了“穿梭”状态。“穿梭”作用改变了气液反应的历程,大大加快了反应速率。
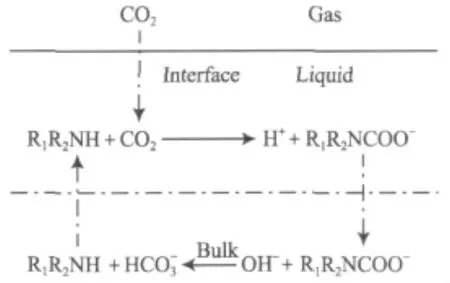
图1“穿梭”机理示意Fig.1 “Shuttle”mechanism.
在溶液中,胺与CO2的反应过程,目前公认的反应机理是由 Caplow[49]提出、Danckwerts[50]补充完整的“两性离子”机理,即:

式中,B表示溶液中存在的碱性物质;kb表示碱性物质与两性离子反应的速率常数;R1R2NH表示有机胺;k2表示CO2与有机胺反应生成两性离子的反应速率常数;k-1表示两性离子分解为CO2与有机胺的逆反应速率常数。
由于烃基数目的不同,CO2与各种胺反应的机理也存在着一定的差异。MDEA属叔胺,氮原子上无质子氢,无法反应形成两性离子,因此MDEA溶液不像MEA和DEA那样能直接与CO2反应,仅起到催化CO2水解的作用,因此反应机理如下[51]:
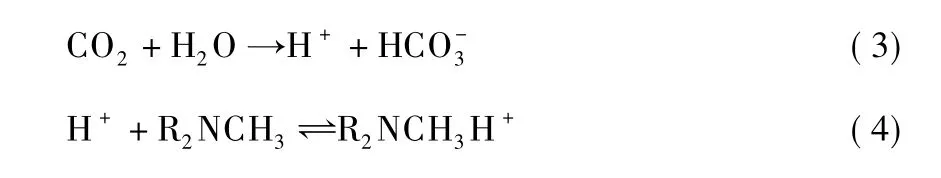
式(3)受液膜控制,为反应的控制步骤;式(4)则是瞬时可逆反应。为加快吸收速率,可在MDEA溶液中加入适量的添加剂,促进式(3)反应的进行。
围绕有机胺溶液,不少研究者对各种体系的反应机理进行了深入探讨。根据“两性离子”机理,Blauwhoff等[52]考察了溶液中各种碱性催化物(如OH-和胺)对中性离子去离子化反应的贡献;Xiao等[23]建立了AMP+MEA与CO2反应速率的模型,较好地解释了混合有机胺的反应动力学特征。
虽然目前对不同有机胺体系吸收CO2的机理还存在争议,但大多是依据“穿梭”机理及“两性离子”机理等相关理论,并根据具体情况展开探讨。随着研究的深入,不同有机胺吸收体系的反应机理将趋于明朗。
3.2 有机胺吸收CO2的反应动力学
为了满足工程开发及工艺应用的需要,研究者们也着手研究吸收体系的反应动力学。按“两性离子”等机理,同时假定两性离子浓度符合拟一级反应条件,便可得到MEA/DEA溶液中的反应速率(r)方程为:

由于烃基数目的不同,CO2与各种胺的反应机理、速率常数也存在着一定的差异。Sun等[53]采用湿壁反应器研究了AMP与PZ吸收CO2的反应速率方程,证明溶液中加入少量的PZ即可明显提高混合溶液整体的表观速率常数,且加入PZ后的混合溶液效果远远超过MEA与AMP的混合效果;Sami[54]则通过停流电导法研究了不同温度下AMP分别与MEA和DEA溶液混合吸收CO2的反应,基于“两性离子”机理,所得混合溶液体系的反应为拟一级反应,混合溶液的反应速率常数高于纯胺的反应速率常数的总和。此外,研究者也在不同的反应器中探究了有机胺的吸收情况,如David等[55]比较了填料塔和膜反应器中AMP等胺溶液吸收CO2的吸收行为;Wang等[56]利用中空膜反应器建立了AMP等吸收CO2的模型。对反应机理和反应动力学的考察,可为确定一种高效、经济的富集CO2的方法提供必要的理论指导,并对实际工程设计和应用提供依据。
4 CO2捕集与封存技术工业应用现状
随着全球变暖的加剧,各国逐渐关注CO2的减排与控制,把火力发电厂排放的CO2作为主要的储存对象,开始碳捕集与封存技术的研究及开发试验。美国未来发电计划(FutureGen项目)、挪威Sleipner项目、德国黑泵电厂项目、中英碳捕集与封存合作项目是目前国际上正在开展的CO2捕集与封存项目中比较著名的四大项目。其中,美国的FutureGen项目最为波折和受人关注。该项目于2003年由美国政府提出,计划建造一座275 MW燃煤发电和制氢的近零排放示范电厂,包括整体煤气化联合循环发电厂的碳捕集和CO2捕集与封存系统。但由于预期成本过高,2008年6月,美国能源部宣布重新整合该项目,只赞助CO2捕集与封存系统。在示范阶段,每年至少将1 Mt CO2储存到含盐储存层,另外1 Mt CO2用于油气增产或采取其他方式永久封存。
澳大利亚联邦科学与工业研究组织、中国华能集团公司和西安热工研究院联合建设了燃烧后捕集示范项目[57],对华能北京热电厂进行碳捕集改造,设计CO2回收率大于85%,年回收CO2能力为3 kt。该示范项目已于2008年7月16日正式投产。该项目在示范运行中捕集效率稳定在80%~85%,截至2009年1月底,捕集的CO2接近900 t,捕集每吨 CO2消耗的蒸汽热量为3.3~3.4 GJ,电耗约100 kW·h。
CO2捕集与封存示范项目的成功运行,再一次证明了该技术是CO2减排与控制手段中最为直接有效的方法之一,但昂贵的投入成本已成为其推广的限制因素。如果在技术和经济上都可行,CO2捕集与封存无疑将是燃煤电厂减排CO2的主要手段之一,对全球温室气体减排与缓解全球变暖有着重要的意义。
5 结语
随着全球气候变暖带来的一系列环境问题,全球CO2减排的呼声越来越强烈,CO2减排的相关研究也越来越多。纵观有机胺溶液吸收CO2方法的发展历程,研发具有吸收速率快、吸收容量高、再生能耗低、腐蚀性低的吸收体系,是近几十年来完善CO2回收工艺的关键。
作为CO2捕集技术中最具应用优势的有机胺溶液吸收法,由于传统的单一有机胺溶液吸收法存在各自的缺陷,因此如何根据不同类型有机胺溶液吸收CO2的特点,优选合适的混合体系,调变溶液的整体性质,从而改善CO2的处理过程、提高吸收效率、节约再生能耗可能成为该方法研究的突破口。
[1]费维扬,艾宁,陈健.温室气体CO2的捕集和分离——分离技术面临的挑战与机遇[J].气体净化,2005,5(2):1-4.
[2]Metz B,Davidson O R,Bosch P,et al.IPCC Climate Change 2007:Mitigation of Climate Change.Working GroupⅢContribution to the Fourth Assessment Report of the IPCC[M].Cambridge:Cambridge University Press,2007:97.
[3]Nakicenovic N,Alcamo J,De Vries B,et al.Special Report on Emissions Scenarios:A Special Report of Working GroupⅢ of the Intergovernmental Panel on Climate Change[M].Cambridge:Cambridge University Press,2000:599.
[4]IEA.Capturing CO2:IEA Greenhouse Gas R&D Program[M].Cheltenham:IEA,2007:23.
[5]Bert Metz,Intergovernmental Panel on Climate Change.Working GroupⅢ.IPCC Special Report on Carbon Dioxide Capture and Storage[M].Cambridge:Cambridge University Press,2005:440.
[6]陈甘棠.化学反应工程[M].北京:化学工业出版社,1995:170-181.
[7]钟战铁.有机胺溶液吸收二氧化碳基础研究[D].杭州:浙江大学,2002.
[8]Rinker E B,Ashour S S,Sandall O C.Absorption of Carbon Dioxide into Aqueous Blends of Diethanolamine and Methyldiethanolamine[J].Ind Eng Chem Res,2000,39(11);4346 -4356.
[9]王志安.烟道气中回收 CO2[J].化肥设计,1997,35(5):50-52.
[10]Rebolledo-Libreros M E,Trejo A.Density and Viscosity of Aqueous Blends of Three Alkanolamines:N-Methyldiethanolamine,Diethanolamine,and 2-Amino-2-Methyl-1-Propanol in the Range of(303 to 343)K[J].J Chem Eng Data,2006,51(2):702-707.
[11]Chiu Li-Feng,Li Meng-Hui.Heat Capacity of Alkanolamine Aqueous Solutions[J].J Chem Eng Data,1999,44(6):1396-1401.
[12]Tobiesen E A,Svendsen H F.Study of a Modified Amine Based Regeneration Unit[J].Ind Eng Chem Res,2006,45(8):2489 -2496.
[13]张剑鹏,来强,刘亚冲.MDEA脱碳装置腐蚀原因探讨[J].煤化工,2000,(1):30-31.
[14]Rho S W,Yoo K P,Lee J S,et al.Solubility of CO2in Aqueous Methyldiethanolamine Solutions[J].J Chem Eng Data,1997,42(6):1161-1164.
[15]Rowley R L,Adams M E,Marshall T L,et al.Measurement of Diffusion Coefficients Important in Modeling the Absorption rate of Carbon Dioxide into AqueousN-Methyldiethanolamine[J].J Chem Eng Data,1997,42(2):310-317.
[16]Shi Yao,Zhong Zhantie.A Rigorous Model for Absorption of Carbon Dioxide into AqueousN-Methyldiethanolamine Solution[J].Chem Eng Commun,2005,192(9):1180-1193.
[17]曹长青,吕清茂.MDEA脱硫过程的模拟分析与优化[J].石油化工,1999,28(3):179 -181.
[18]王泉清.有机胺溶液吸收CO2的研究评述[J].山东师范大学学报:自然科学版,2008,23(1):81 -83.
[19]Sharma M M.Absorption of CO2and COS in Alkaline and Amine Solutions[D].Cambridge:University of Cambridge,1964.
[20]Chan C,Maham Y,Mather A E,et al.Densities and Volumetric Properties of the Aqueous Solutions of 2-Amino-2-Methyl-1-Propanol,N-Butyldiethanolamine andN-Propylethanolamine at Temperatures from 298.15 to 353.15 K[J].Fluid Phase Equilibr,2002,198(2):239-250.
[21]Zhang Kai,Hawrylak B,Palepu R,et al.Thermodynamics of Aqueous Amines:Excess Molar Heat Capacities,Volumes,and Expansibilities of{Water+Methyldiethanolamine(MDEA)}and{Water+2-Amino-2-Methyl-1-Propanol(AMP)}[J].J Chem Thermodyn,2002,34(5):679-710.
[22]钱伯章.CO2回收和捕集技术新进展[J].中国环保产业,2009,(5):28 -32.
[23]Xiao Jimmy,Li Chih-Wei,Li Meng-Hui.Kinetics of Absorption of Carbon Dioxide into Aqueous Solutions of 2-Amino-2-Methyl-1-Propanol+Monoethanolamine[J].Chem Eng Sci,2000,55(1):161-175.
[24]Glasscock D A,Critchfield J E,Rochelle G T.CO2Absorption/Desorption in Mixture ofMethyldiethanolamine with Monoethanolamine or Diethanolamine[J].Chem Eng Sci,1991,46(11):2829-2845.
[25]Sakwattanapong R,Aroonwilas A,Veawab A.Behavior of Reboiler Heat Duty for CO2Capture Plants Using Regenerable Single and Blended Alkanolamines[J].Ind Eng Chem Res,2005,44(12):4465-4473.
[26]Versteeg G F,Kuipers J A M,Van Beckum F P H,et al.Mass-Transeer with Complex Reversible Chemical-Reactions:2.Parallel Reversible Chemical-Reactopms[J].Chem Eng Sci,1990,45(1):183-197.
[27]Rangwala H A,Morrell B R,Mather A E,et al.Absorption of CO2into Aqueous Tertiary Amine/MEA Solutions[J].Can J Chem Eng,1992,70(3):482-490.
[28]Rinker E B,Ashour S S,Sandall O C.Absorption of Carbon Dioxide into Aqueous Blends of Diethanolamine and Methyldiethanolamine[J].Ind Eng Chem Res,2000,39(11):4346 -4356.
[29]Hagewiesche D P,Ashour S S,AI-Ghawas H A,et al.Absorption of Carbon Dioxide into Aqueous Blends of Monoethanolamine andN-Methyldiethanolamine[J].Chem Eng Sci,1995,50(7):1071-1079.
[30]Alvarez E,Gomez-Diaz D,La Rubia M D,et al.Densities and Viscosities of Aqueous Ternary Mixtures of 2-(Methylamino)Ethanol and 2-(Ethylamino)Ethanol with Diethanol-Amine,Triethanolamine,N-Methyldiethanolamine,or 2-Amino-1-Methyl-1-Propanol from 298.15 to 323.15 K[J].J Chem Eng Data,2006,51(3):955-962.
[31]Mandal B P,Guha M,Biswas A K,et al.Removal of Carbon Dioxide by Absorption in Mixed Amine:Modeling of Absorption in Aqueous MDEA/MEA and AMP/MEA Solutions[J].Chem Eng Sci,2001,56(22):6217 -6224.
[32]Jamal A,Meisen A,Lim C J.Kinetics of Carbon Dioxide Absorption and Desorption in Aqueous Alkanolamine Solutions Using a Novel Hemispherical Contactor:Ⅰ.Experimental Apparatus and Mathematical Modeling[J].Chem Eng Sci,2006,61(19):6571-6589.
[33]Aroua M K,Haji-Sulaiman M Z,Ramasamy K.Modelling of Carbon Dioxide Absorption in Aqueous Solutions of AMP and MDEA and Their Blends Using Aspenplus[J].Sep Purif Technol,2002,29(2):153 -162.
[34]毛松柏,叶宁,丁雅萍.低分压CO2的回收新技术与应用[J].化学工业与工程技术,2004,25(3):12 -15.
[35]Arashi N,Oda N,Yamada M,et al.Evaluation of Test Results of 1 000 m3N/h Pilot Plant for CO2Absorption Using an Amine-Based Solution[J].Energ Convers Manage,1997,38(S1):S63-S68.
[36]Mandal B P,Kundu M,Bandyopadhyay S S.Physical Solubility and Diffusivity of N2O and CO2into Aqueous Solutions of(2-Amino-2-Methyl-1-Propanol+Monoethanolamine)and(NMethyldiethanolamine+Monoethanol-Amine)[J].J Chem Eng Data,2005,50(2):352-358.
[37]Choi Won-Joon,Seo Jong-Beom,Jang Sang-Yong,et al.Removal Characteristics of CO2Using Aqueous MEA/AMP Solutions in the Absorption and Regeneration Process[J].J Environ Sci,2009,21(7):907 -913.
[38]Xu Guowen,Zhang Chengfang,Qin Shujun,et al.Kinetics Study on Absorption of Crabon Dioxide into Solution of Activated Methyldiethanolamine[J].Ind Eng Chem Res,1992,31(3):921-927.
[39]Bishnoi S,Rochelle G T.Absorption of Carbon Dioxide into Aqueous Piperazine Kinetics,Mass Transfer and Solubility[J].Chem Eng Sci,2000,55(22):5531 -5543.
[40]张旭,王军,张成芳,等.压力对N-甲基二乙醇胺混合哌嗪水溶液脱碳速率的影响[J].化学工程,2005,33(1):9-11,27.
[41]Zhang Xu,Zhang Chengfang,Qin Shujun,et al.A Kinetics Study on Absorption of Carbon Dioxide into Mixed Aqueous Solution of Methyldiethanolamine and Piperazine[J].Ind Eng Chem Res,2001,40(17):3785-3791.
[42]项菲,施耀,李伟.混合有机胺吸收烟道气CO2的实验研究[J].环境污染与防治,2003,25(4):206 -208,225.
[43]Hook R J.An Investigation of Some Sterically Hindered Amines as Potential Carbon Dioxide Scrubbing Compounds[J].Ind Eng Chem Res,1997,36(5):1779 -1790.
[44]Penny D E,Ritier T J.Kinetic Study of the Reaction Between Carbon Dioxide and Primary Amines[J].J Chem Soc,Faraday Trans,1983,79(10):2103 -2109.
[45]陆建刚,郑有飞,陈敏东,等.膜基-氨基酸盐及其复合溶液吸收 CO2的性能[J].化学工程,2008,36(9):5 -8.
[46]Blanchard L A,Hancu D,Beckman E J,et al.Green Processing Using Ionic Liquids and CO2[J].Nature,1999,399(6731):28-29.
[47]Camper D,Bara J E,Gin D L,et al.Room-Temperature Ionic Liquid-Amine Solutions:Tunable Solvents for Efficient and Reversible Capture of CO2[J].Ind Eng Chem Res,2008,47(21):8496-8498.
[48]Danckwerts P V,McNeil K M.Absorption of Carbon Dioxide into Aquesous Amine Solutions and the Effects of Catalysis[J].Trans Instn Chem Engrs,1967,45(1):T32-T49.
[49]Caplow M.Kinetics of Carbamate Formation and Breakdown[J].J Am Chem Soc,1968,90(24):6795-6803.
[50]Danckwerts P V.The Reactions of CO2with Ethanolamines[J].Chem Eng Sci,1979,34(4):443 -446.
[51]张培.位阻胺AMP溶液富集烟道气中二氧化碳的研究[D].杭州:浙江大学,2007.
[52]Blauwhoff P M M,Versteeg G F,Van Swaaij W P M.A Study on the Reaction Between CO2and Alkanolamines in Aqueous Solutions[J].Chem Eng Sci,1984,39(2):207 - 225.
[53]Sun Wei-Chen,Yong Chia-Bao,Li Meng-Hui.Kinetics of the Absorption of Carbon Dioxide into Mixed Aqueous Solutions of 2-Amino-2-Methyl-1-Propanol and Piperazine[J].Chem Eng Sci,2005,60(2):503 -516.
[54]Sami H A.Kinetics of the Reaction of Carbon Dioxide with Blends of Amines in Aqueous Media Using the Stopped-Flow Technique[J].Int J Chem Kinet,2005,37(7):391 - 405.
[55]David D,Paitoon T,Amit C.Comparing the Absorption Performance of Packed Columns and Membrane Contactors[J].Ind Eng Chem Res,2005,44(15):5726-5732.
[56]Wang R,Li D F,Liang D T.Modeling of CO2Capture by Three Typical Amine Solutions in Hollow Fiber Membrane Contactors[J].Chem Eng Process,2004,43(7):849 -856.
[57]黄斌,许世森,郜时旺,等.华能北京热电厂CO2捕集工业试验研究[J].中国电机工程学报,2009,29(17):14-29.
A Systematic Review of CO2Absorption Using Amine
Lü Bihong,Jin Jiajia,Zhang Li,Li Wei
(Institute of Environmental Engineering,Zhejiang University,Hangzhou Zhejiang 310058,China)
The globe climate change caused by greenhouse gas has become world wide concerned issue.As one of the most important greenhouse gas,CO2capture and sequestration to reduce its release to atmosphere is of critical importance.This paper reviewed the current status of the development of CO2capturetechnology, summarized CO2absorption into common organicamine, e.g.,monoethanolamine,diethanolamine,N-methyldiethanolamine,2-amino-2-methyl-1-propanol and the mixture solution.The reaction mechanism and kinetics of CO2absorption into amines were also described.And the present situation of application was introduced.Finally,it was predicted that the complex system by organic amines and other absorbent may be the trend of CO2absorption in future.
absorption;carbon dioxide;amine
1000-8144(2011)08-0803-07
TQ 028
A
2011-01-25;[修改稿日期]2011-05-30。
吕碧洪(1985—),女,福建省仙游县人,博士生,电话0571 -88982038,邮箱 11014027@zju.edu.cn。联系人:李伟,电话0571 -88982038,电邮 w_li@zju.edu.cn。
国家自然科学基金资助课题(20976157)。
(编辑 王 萍)

