TiO2纳米管阵列覆盖Si薄膜光催化还原CO2性能的研究
刘有松 张 斌 朱 蕾 常晓峰 李健生 姬广斌*,
(1南京航空航天大学,材料科学与技术学院,南京 211100)
(2南京理工大学,环境与生物工程学院,南京 210094)
TiO2纳米管阵列覆盖Si薄膜光催化还原CO2性能的研究
刘有松1张 斌1朱 蕾1常晓峰1李健生2姬广斌*,1
(1南京航空航天大学,材料科学与技术学院,南京 211100)
(2南京理工大学,环境与生物工程学院,南京 210094)
本工作采用CVD法在阳极氧化TiO2纳米管阵列膜表面沉积一层非晶Si膜,通过退火后得到晶化了的Si膜/TiO2纳米管阵列的复合结构,并初步就其光催化还原CO2制备碳氢化合物的活性进行研究。拉曼光谱(Raman)、X射线衍射(XRD)、场发射扫描电镜(FE-SEM)、高分辨透射电子显微镜(TEM)等微结构表征结果表明所制备的TiO2纳米管阵列的厚度为270 nm左右,管直径约为70 nm,管壁厚度约为16 nm。覆盖的Si膜已晶化,其厚度约为300 nm。通过高效液相色谱(HPLC)及总有机碳(TOC)来检测光催化还原液相产物中的甲酸及总有机碳含量,发现负载Si膜后的TiO2纳米管阵列光催化性能有所提高,在装有400cut滤光片氙灯照射2 h下TOC含量从21.2 mg·L-1增长到29.5 mg·L-1,表明Si与TiO2的复合可有效的提高光催化还原CO2的活性,这可能与该异质结结构可增加对光的吸收并且可降低光生空穴-电子对复合有关。光催化循环实验表明所制得的催化剂在循环5次后仍可保持91.6%的催化活性。
硅;二氧化钛;光催化;还原;甲酸;总有机碳
0 引 言
长期以来,石油天然气等碳氢化合物燃料作为现在社会中最重要的能源,在人类社会的发展中具有不可替代的重要作用。但由于碳氢化合物燃料的不可再生性,能源紧缺成为了阻滞社会发展的重要因素,而其在燃烧过程中带来的巨大环境问题也不容忽视,如CO2的排放[1]所引起的温室效应等。汉森[2-3]以及他的合作者通过古气候的数据研究得出地球以每年6℃的速度升温会使地球从冰川季转变成南极冰川融化时代。因此CO2在大气中含量的不断升高严重威胁着生态平衡和人类的发展,如何有效地降低CO2在大气中的含量成为了科学界新的研究热点。
许多研究者致力于处理CO2的研究,并提出了一系列有效可行的方法。目前,研究者发现并报道的处理二氧化碳的方法有吸附法[4],电化学合成法固定二氧化碳[5],微生物及酶固定等方法。太阳能是一种几乎取之不尽用之不竭的清洁能源,近几年来,随着光催化材料的发展,很多研究工作者将研究方向转向了通过光催化的方法将CO2还原为碳氢燃料,以达到再次循环的目的。迄今为止,TiO2系,,Zn2Ge(Ga),SiC[9]等在不同波段光波驱动下催化还原CO2的光催化剂已被人们广泛研究,其中,由于TiO2在光催化反应中表现出的得天独厚的优越性,越来越多的人对TiO2基结构的光催化材料进行了研究。Adachi等[10]将Cu负载到TiO2粉末上,在Xe灯的照射下将CO2转化为CH4和C2H6。Anpo等[11]又将 TiO2粉末负载在沸石分子筛上在328 K下将 CO2和 H2O高选择性的还原成了CH3OH。Gratzel与他的合作者用Ru以及Ru的氧化物敏化TiO2在Ar存在的条件下将CO2与H2的混合物转化为了。不久前,Oomman等制备了氮掺杂的TiO2纳米阵列,并在其上负载了Cu纳米粒子与Ag纳米粒子,在户外可见光的照射下高效的成功的将CO2还原为CH4、CO等[13]。目前,国内对于CO2光催化还原的研究还较少。邹志刚等研究了新型介孔ZnGaO4材料的修饰和改性,在Xe灯照射下将CO2还原为赵志换等致力于TiO2复合金属酞菁(MPc:M代表金属,Pc代表酞菁)用于光催化还原CO2的研究,通过溶胶-凝胶法和原位合成法合成了ZnPc/TiO2复合结构,将CO2的水溶液在可见光的照射下还原为甲酸[15]。
相比其它半导体材料,硅(Eg=1.12 eV)可大量的利用太阳光中的可见光光子能量,然而较窄的禁带宽度导致了其仍存在光生电子-空穴极易发生复合而使得光电转换效率降低的问题。最早在1976年,Mirisaki等在p-Si和n-Si组成的太阳能电极上,用CVD的方法在Si电极上沉积了一层TiO2薄膜,增大了电极的光生电压,提高了光解水的效率[16]。Li等[17]采用一步水热法合成了掺杂Si的TiO2空心微球,研究表明,Si的掺入可使TiO2的禁带宽度由3.32 eV增加到3.38 eV,这意味着光生空穴有了更强的氧化潜能,从而使其光催化活性提高了1.52倍。加州大学伯克利分校的杨培东等[18]于2009年报道了用原子层沉积(ALD)技术制备高密度共轴Si/TiO2核-壳纳米线阵列的方法。研究发现Si/TiO2异质结构的构建可弥补TiO2光吸收范围小的缺点,且在异质结上发生的能带弯曲效应可提高电子-空穴的分离能力,进一步提高光催化性能。他们还发现Si/TiO2界面的产生可减少光生空穴的损失从而进一步提高光阳极电流,这一点在光电催化降解有机污染物或分解水制氢能领域上有着重要的意义和价值。
本工作采用CVD法在阳极氧化TiO2纳米管阵列膜表面沉积一层非晶Si膜,通过退火得到了晶化的Si膜/TiO2纳米管阵列的复合结构,并就所制备的Si/TiO2结构的光催化还原CO2活性进行初步的研究与探讨。
1 实验部分
1.1 实验试剂
氢氟酸(40wt%、A.R.、南京宁氏化学试剂有限公司);硝酸(A.R.、南京宁氏化学试剂有限公司);乙醇(A.R.、南京宁氏化学试剂有限公司);丙酮(A.R.,上海中试化工总公司);甲酸(85wt%、A.R.、上海实意化学试剂有限公司);磷酸二氢钠(A.R.、南京化学试剂有限公司);磷酸(85wt%、A.R.、上海中试化工总公司);甲醇(色谱纯,美国Tedia试剂公司);甲醛(35~40wt%、A.R.、上海中试化工总公司);钛片(工业纯、纯度99.6%、东莞市富泰金属材料有限公司);蒸馏水用于材料的制备及光催化还原反应介质,超纯水(电阻率大于18.2 MΩ·cm)用于高效液相色谱流动相的配置;CO2(纯度高于99.5wt%、南京第五十五研究所技术开发总公司)。
1.2 TiO2纳米管阵列的制备[19]
将大小为3 cm×3 cm的新钛片分别于丙酮、乙醇溶液中超声15 min,风干,然后浸于∶VH2O=1∶4∶5的混合酸液于通风橱中蚀刻30 s,结束后用水稀释并去掉混合酸溶液,最后用去离子水清洗。将处理好的钛片放于空气中风干,处理后的钛片表面清洁光亮,无杂质。
钛片、石墨电极分别接到直流稳压电源(DF1731SC2A,宁波中策电子有限公司)的正、负极,以0.3%(体积分数)氢氟酸溶液为电解质,施加直流电压20 V。阳极氧化实验最初几秒钟电流迅速下降,很快就达到稳定的电流值。20 min反应完毕后,将样品放在管式炉中按如下条件锻烧:以2℃·min-1的速率从室温升到500℃,然后保温1 h再冷却到室温,即可制得TiO2纳米管阵列。
1.3 TiO2纳米管阵列沉积Si制备Si/TiO2复合结构
利用化学气相沉积方法(PECVD-450型等离子体增强化学气相沉积,北京泰克诺科技有限公司)在TiO2纳米管阵列膜上沉积Si(取相同大小的玻璃同炉沉积Si做对照实验,记为Si/CG,CG意为cover glass),沉积参数为:衬底温度200℃,功率10 W,气压69 Pa,SiH4/H2流量 (sccm)=4/16,沉积时间10 min。将沉积得到的Si/TiO2复合结构放在石英管式炉中按如下条件退火:在H2和Ar气气氛保护下,以2℃·min-1的速率从室温升到650℃,然后保温1 h再随炉冷却到室温,即可制得晶化的Si/TiO2复合结构。
1.4 TiO2纳米管阵列和Si/TiO2复合结构的表征
用JY HR800型激光拉曼光谱仪(Raman)检测TiO2纳米管阵列上Si膜退火后晶化情况,光源为Ar激光(波长为488 nm);用Bruker D8 ADVANCE X射线衍射仪 (XRD,Cu靶Kα射线,λ=0.154 178 nm)检测样品的物相,扫描范围10°~90°;用JEOL S4800型场发射扫描电镜(FE-SEM)观察样品的外观形貌;用 Nicolet670型傅里叶变换红外光谱仪(FTIR)对Si/TiO2复合结构表面的Si膜进行分析和鉴定;用Varian Cary 100型紫外-可见分光光度计(UV-Vis)对获得的TiO2纳米管阵列和Si/TiO2复合结构进行紫外-可见全波长扫描,分析试样的可见光吸收情况,扫描范围200 nm~800 nm。
1.5 光催化还原CO2实验及光催化还原产物的检测
光催化还原CO2反应在装有250mL烧杯中进行,光源为500 W的全弧氙灯(CHF-XM500W,北京畅拓科技有限公司),发光中心与液面距离为5 cm,光功率密度约为400 mW·cm-2。分别将3×3 cm的Si/CG、未沉积Si的TiO2纳米管阵列和Si/TiO2片正面 (即沉积Si的一面)朝上加入到200 mL蒸馏水中。调节CO2气体的流速为0.4 L·min-1,先通高纯CO2气体30 min以排除反应器中的空气并使之饱和。打开氙灯,预热5 min,而后对反应系统进行照射。实验中,还采用UV 400 nm cut和550 nm band pass滤光片以获得滤掉400 nm以下波长的可见光及波长范围为(550±15)nm的绿色可见光作为照射光源。
光催化反应开始后,每隔20 min用HPLC进样针将20 μL水样注入HPLC(Agilent 1100,美国安捷伦科技有限公司)进行分析,并用外标法来确定其中甲酸的含量。色谱柱采用岛津公司生产的C18反相色谱柱。流动相使用磷酸盐缓冲溶液(PBS),pH=2.5,其中磷酸二氢钠含量为10 mmol·L-1,盐溶液与甲醇体积比为78∶22,流速为0.4 mL·min-1,柱温为25℃,检测波长为210 nm。实验测得的积分面积(A)对浓度(C)的标准曲线方程为A=0.7233C-36.7471(线性相关度R=0.9843)。同时采用总有机碳(TOC)分析仪(vario TOC cube,德国元素分析系统公司)来分析液相中总有机碳的含量(外标法测定)。TOC分析仪是以优纯级的邻苯二甲酸氢钾作为有机标准试剂有机碳标准溶液[20]:c=500 mL·L-1,准确称取邻苯二甲酸氢钾 (预先在110℃烘箱内2 h)1.0625 g溶于盛有二次蒸馏水的1000 mL容量瓶中,然后准确加入二次蒸馏水满刻度。燃烧炉温度设定为850℃,仪器自动进邻苯二甲酸氢钾标准溶液并稀释,最终实验测得有机碳浓度(Y)对实验测得的积分面积(X)的标准曲线方程为Y=-1.284 5×10-4X+4.034 2×10-8(线性相关度R=0.999)。
2 结果与讨论
2.1 TiO2纳米管阵列与Si/TiO2复合结构的表征
2.1.1 拉曼光谱
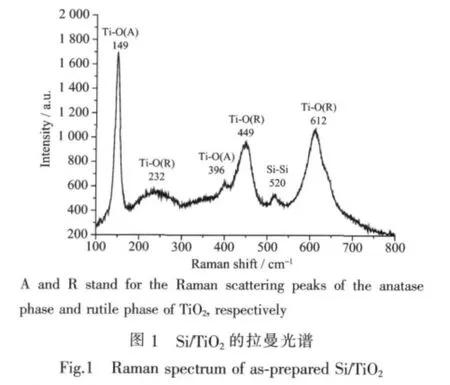
为了确定退火后Si/TiO2复合结构的相组成情况,我们对样品进行了拉曼光谱测试,其激发光源为Ar激光,激发波长为488 nm。拉曼光谱的结果对于我们确定650℃保温2 h条件下退火后获得的Si/TiO2复合结构是单晶还是非晶相具有重要的作用。从拉曼光谱当中我们可以看到在频率为100~800 cm-1范围内有6个明显的拉曼散射峰,分别位于 149、232、396、449、520、612 cm-1处。其中,520 cm-1处的峰为硅的晶态拉曼散射峰,480 cm-1处没有明显的无定形Si的拉曼散射峰出现,这表明,TiO2纳米管阵列表面沉积的Si薄膜经退火后已基本完全晶化。149 cm-1处的高强峰和396 cm-1处的弱峰分别对应于锐钛矿型TiO2的Eg和B1g振动模式,232、449和612 cm-1为金红石型TiO2的振动峰[21]。这些结果表明,所制备的Si/TiO2复合结构在退火后,TiO2纳米管阵列表面沉积的Si薄膜得以晶化,TiO2纳米管阵列由锐钛矿型跟金红石型两种晶型组成。
2.1.2 X射线衍射
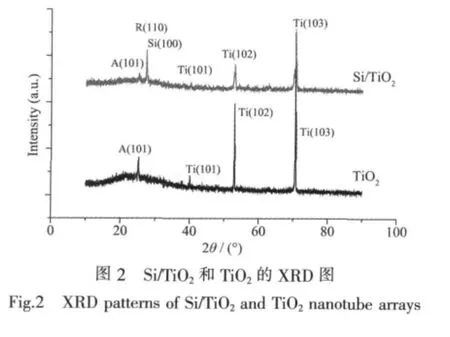
从TiO2的XRD图上可以看到,在2θ=25.3°处开始出现锐钛矿相在(101)晶面的特征衍射峰(PDF No.84-1286),在2θ=40.2°处出现了Ti的(101)特征衍射峰,由于Ti基底并未完全氧化,因此在XRD图上的53.0°和70.7°还出现了Ti的(102)和(103)晶面的强衍射峰(PDF No.44-1294)。从Si/TiO2的XRD图上可以看出,在2θ=25.3°处锐钛矿相在(101)晶面特征衍射峰有所减弱,而在2θ=27.4°处出现金红石相在(110)晶面的特征衍射峰(PDF No.78-2485),这表明经650℃退火的Si/TiO2样品中同时存在TiO2的锐钛矿相和金红石相。在Si/TiO2的XRD图中,位于27.1°的衍射峰可能为Si(100,PDF No.80-0005)或金红石相TiO2(110)晶面的衍射结果。
2.1.3 FE-SEM分析
图3(a)为TiO2纳米管的FE-SEM图,可以看出TiO2孔洞较为有序,孔径约72 nm,孔壁厚度约为16 nm。图3(b)为TiO2纳米管断面的FE-SEM图,从图中我们可以看到,所制得的TiO2纳米管阵列是由一根根独立的TiO2纳米管组成,纳米管阵列的厚度约为270 nm。采用化学气相沉积(CVD)方法在TiO2纳米管阵列上沉积Si,由于在CVD沉积过程中,SiH4裂解产生的Si可随机的沉积到TiO2纳米管内部与管口的管壁上,并逐渐长大形成Si颗粒,管口的管壁上沉积的Si随着Si颗粒的长大最终可全部覆盖住TiO2纳米管,因此Si基本都在TiO2纳米管阵列上沉积形成一层薄膜。图3(c)为CVD沉积得到的Si/TiO2复合结构的FE-SEM全貌照片,从图中可以观察到,CVD沉积制备的Si膜比较致密,基本完全覆盖住了TiO2纳米管阵列。图3(d)为Si膜某破裂处拍摄的SEM照片,从图中我们可以看到,Si/TiO2复合结构由三部分组成,依次为Ti基底、TiO2纳米管阵列和Si膜,其中Si膜的厚度约为300 nm。
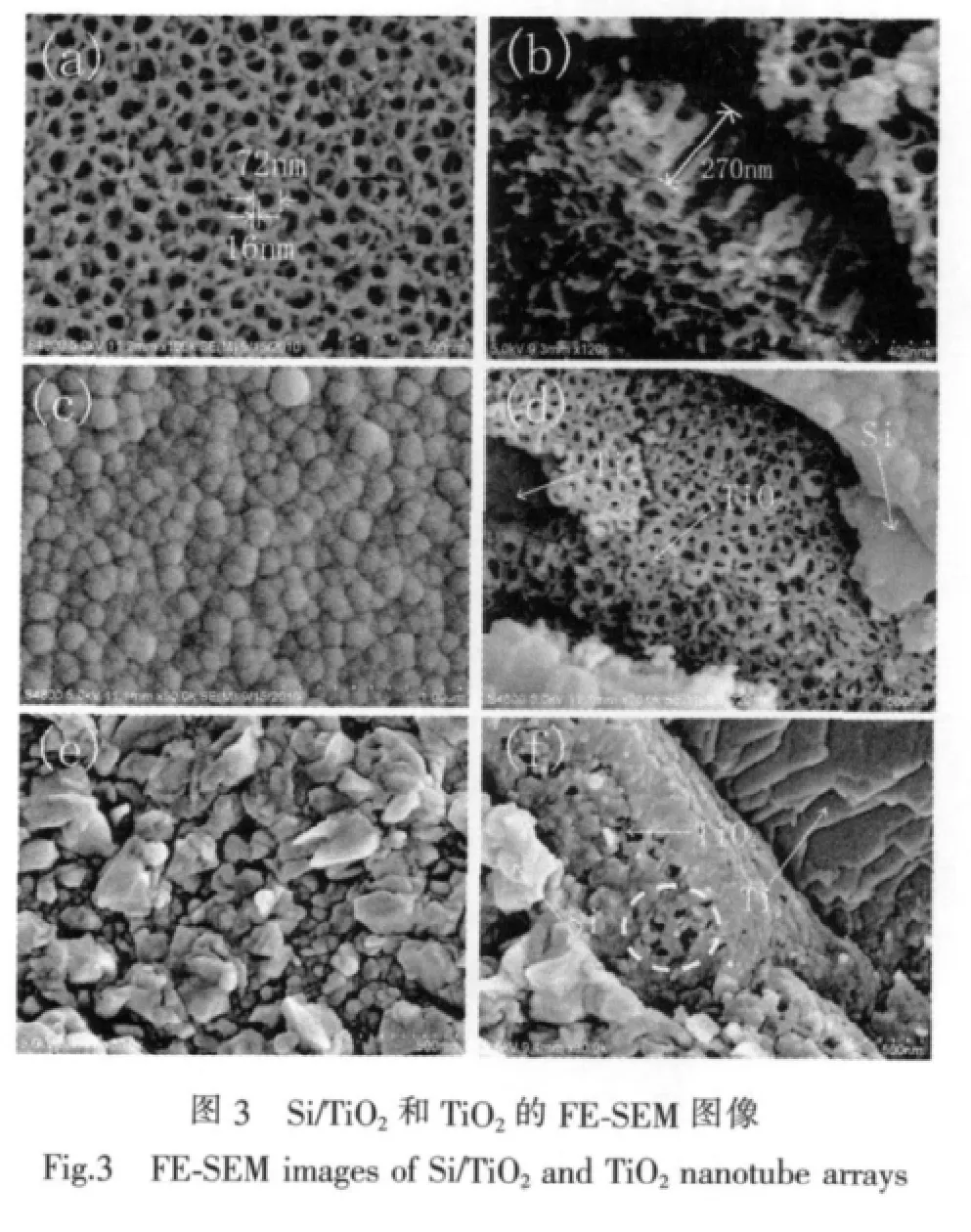
对650℃退火后的Si/TiO2复合结构进行FESEM分析,以研究退火对TiO2纳米管阵列及表面形貌的影响。从图3(e)中,可以观察到,退火后在TiO2纳米管阵列表面沉积得到的Si膜由许多Si纳米颗粒组成,这可能是由于退火过程中发生的晶化作用使得Si逐渐长成多晶Si纳米颗粒的缘故。在图3(f)所示的某处Si膜破裂处,我们可以观察到,TiO2纳米管阵列仍然保留有较好的孔道结构 (见图中白色虚线框标明的位置)。
2.1.4 红外光谱
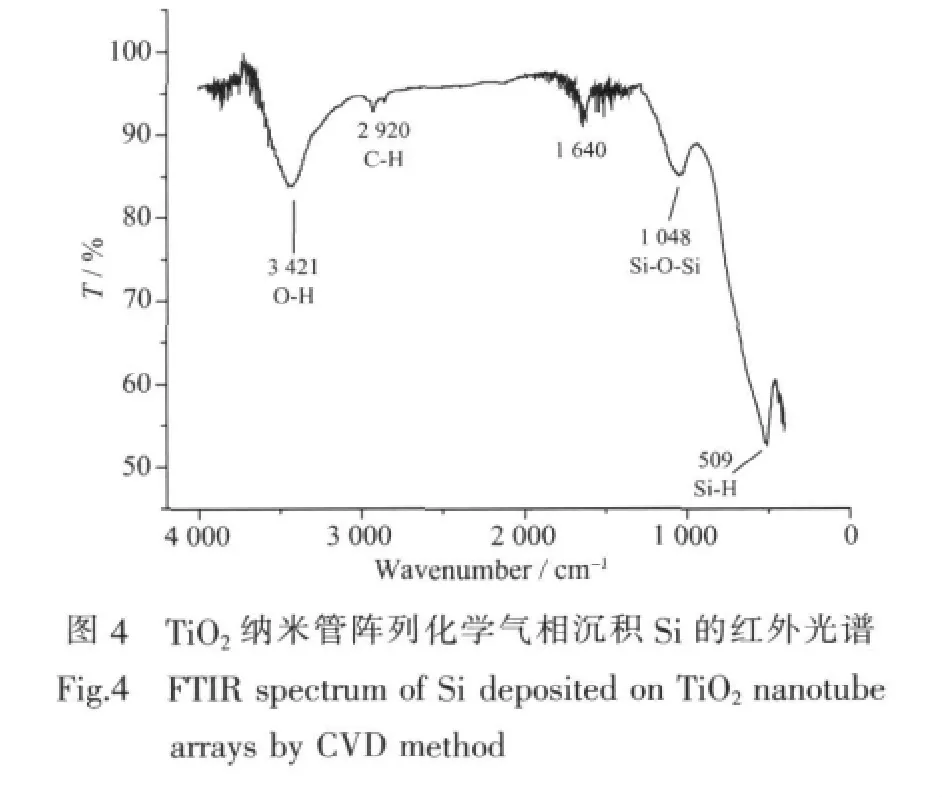
对从Si/TiO2复合结构上超声剥离下的Si进行红外光谱测试,以表征TiO2纳米管阵列表面沉积Si的成键情况。从红外光谱中,我们可以看到在509 cm-1处有一个较强的特征吸收峰,其为Si-H键的伸缩振动峰,1 048 cm-1处的峰为Si-O键的伸缩振动峰[22],这表明,TiO2纳米管阵列表面的Si有部分的氧化。在3421 cm-1附近的位置有一个较强的吸收峰,为-OH基的伸缩振动峰,1640 cm-1处为水气的弯曲振动峰,2920 cm-1处为饱和烷烃C-H键的伸缩振动峰,这可能是由于干燥时间过短在样品中仍留有少量乙醇或制样进行红外扫描过程中引收水气等杂质造成的。
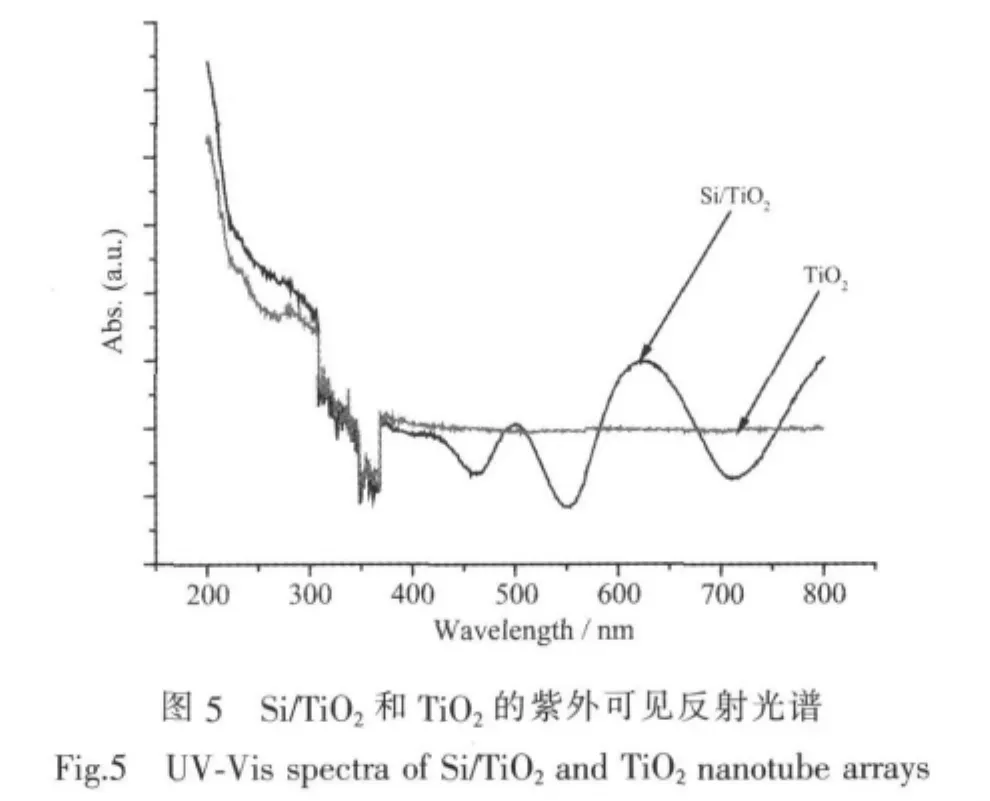
2.1.5 紫外可见反射光谱
从图5 TiO2/Si与TiO2的反射光谱中,可以看出Si/TiO2复合后形成的异质结结构与TiO2纳米管阵列在372 nm处都有强烈的吸收,这表明Si/TiO2复合结构仍具有TiO2的强烈的紫外光响应;另外,还可以发现,Si/TiO2复合结构较TiO2纳米管阵列而言,在可见光区其吸收有了明显的变化,吸收得以增强。这表明,可能是形成的异质结结构,使得Si/ TiO2复合结构具有了可见光响应,其能够吸收利用紫外和可见光,增加了光吸收范围。
2.2 Si/TiO2复合结构光催化还原CO2性能
2.2.1 甲酸含量的测定
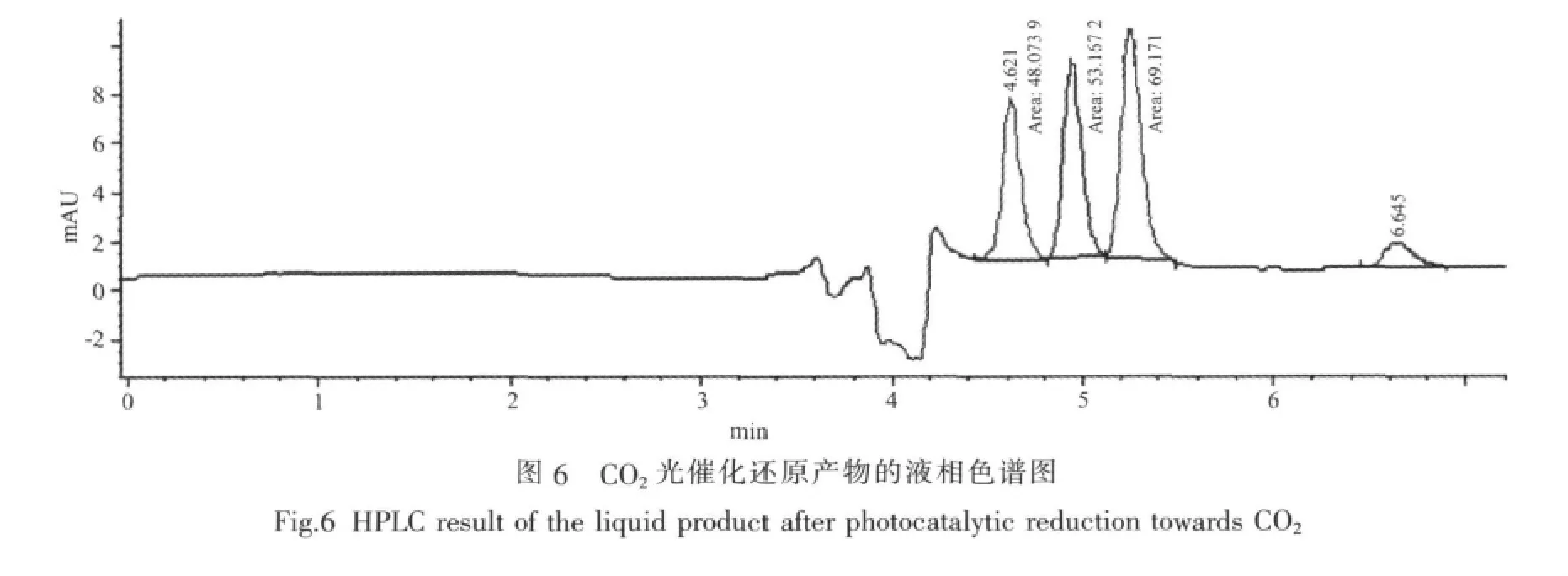
用高效液相色谱分析CO2在光催化条件下的还原产物。图6是以Si/TiO2复合结构为催化剂进行CO2光催化还原2 h所得产物的典型液相色谱图,图中位于保留时间为4.6和5.2 min处的色谱峰分别对应于光催化还原产物甲醛和甲酸。
分别将裸TiO2纳米管阵列跟Si/TiO2复合结构在不同波长滤光片的氙灯照射下对CO2进行光催化还原,每20 min取样一次,进行液相色谱分析。我们得到了甲酸含量随时间变化图,见图7。
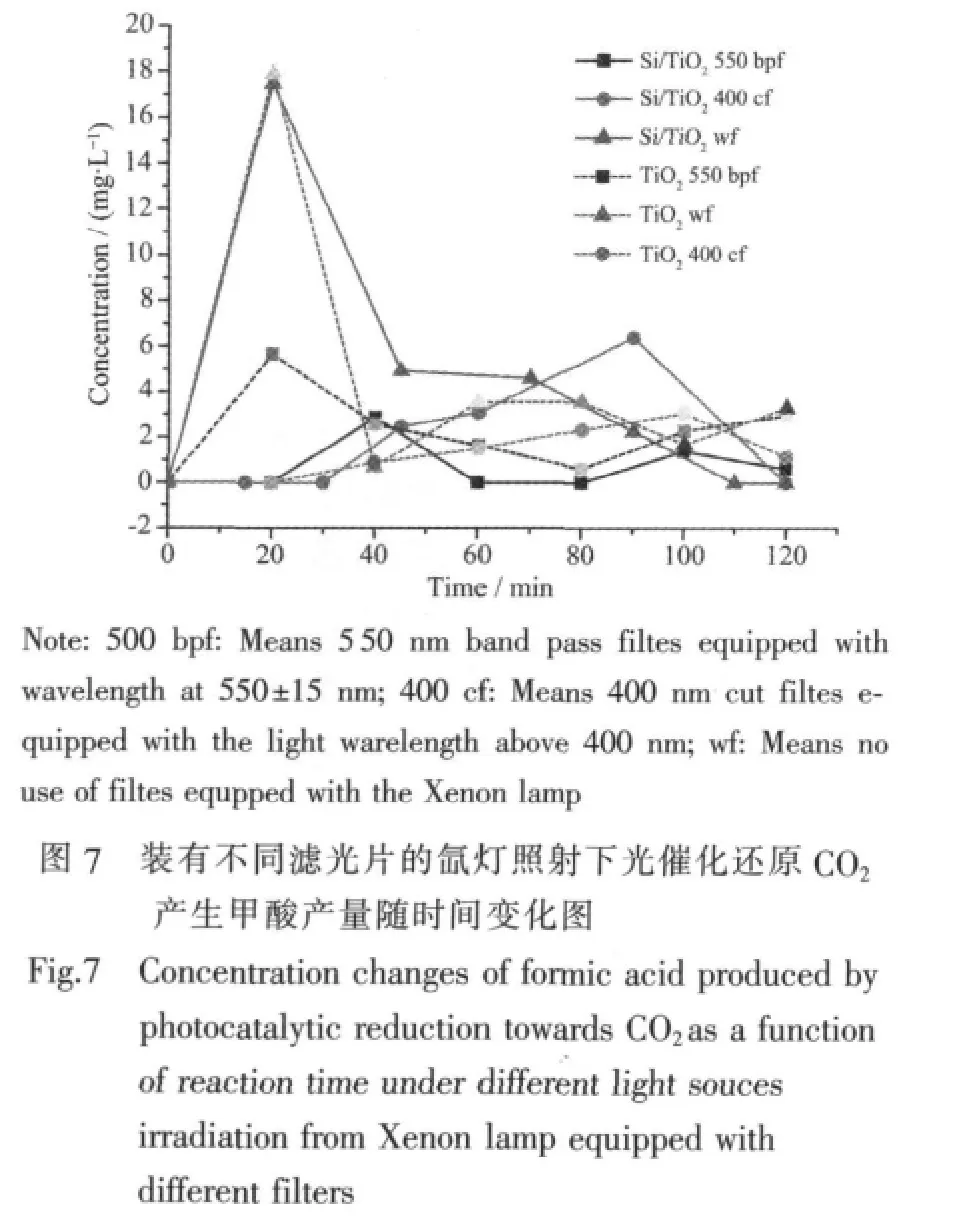
从图中可以看到,甲酸的含量随时间变化呈现无规则变化的趋势,通过其光催化机理对其进行分析,可能的机理解释为:
在Si/TiO2产生光生空穴和光生电子后,会发生下列反应:
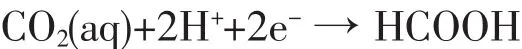
但由于光生电子的进一步形成,HCOOH只是反应中间产物,在适合能量电子的作用下,又会发生下列反应:
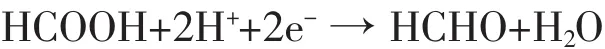
而后,具有足够能量的光生电子在此基础上,还会有如下反应:
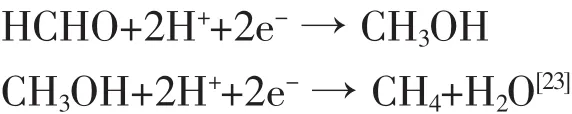
从以上的分析中可以看出HCOOH不是光催化还原CO2反应的终产物,而是光催化反应的第一步产物,因而在反应过程中会出现先增加后减少的过程,当反应到一定程度时,随着进一步还原反应的饱和,甲酸的产量又会增加。
2.2.2 总有机碳(TOC)含量的测定
我们通过总有机碳含量来表征催化剂的CO2光催化还原性能。在装有400 nm cut滤光片氙灯照射2 h后,Si/CG、TiO2纳米管阵列和Si/TiO2复合结构的光催化还原产物中总有机碳(TOC)含量分别为6.2、21.2和29.5 mg·L-1。
Si因为其禁带宽度较低(1.12 eV),光生空穴-电子较易发生复合,所以其光催化还原CO2活性最低。而TiO2纳米管阵列由于其锐钛矿/金红石相结的存在,使其可吸收部分可见光,故而具有光催化还原CO2的活性,又由于其禁带宽度(~3.0 eV)大于Si的禁带宽度,光生空穴-电子复合几率较低,使其光催化活性较Si有所提高。Si/TiO2复合结构的光催化活性最高,这表明,TiO2纳米管阵列在覆盖Si膜后,二者之间的协同作用使其光催化活性有了较大提高(详细机理解释见2.4)。
2.3 Si/TiO2复合结构催化剂稳定性能
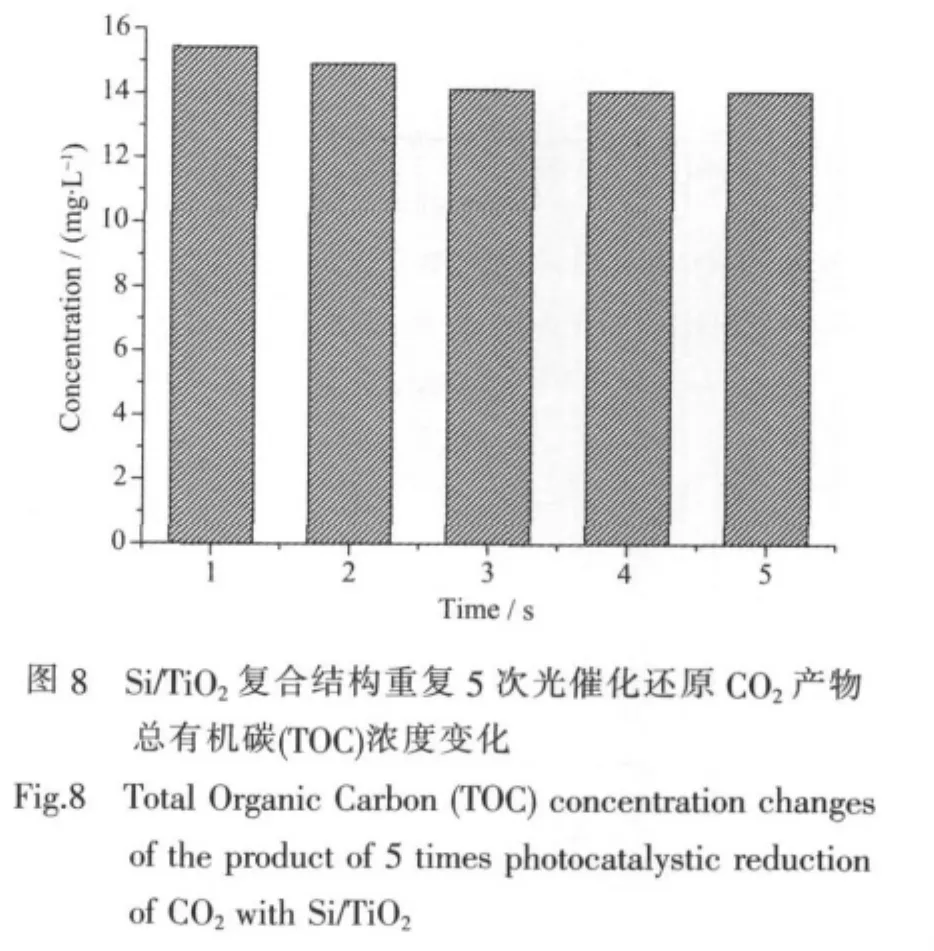
为研究所制得的Si/TiO2复合结构催化剂的稳定性,我们将所制得的3 cm×3 cm Si/TiO2复合结构催化剂在不安装滤光片的氙灯照射下进行CO2光催化还原反应1 h(其他条件同2.5),重复5次。对5次光催化还原反应的产物进行总有机碳 (TOC)分析,以表征催化剂效率。
从图8中可以观察到,5次重复光催化还原产物的TOC含量从15.4 mg·L-1下降到14.1 mg·L-1,降低为原来的91.6%。这表明,所制得的Si/TiO2复合结构催化剂可以较好的保持其催化活性,即具有较好的稳定性。
2.4 光催化还原机理
研究发现,尽管XRD结果中并不能显示出R相 (禁带宽度约为3.0 eV,即可以吸收波长不大于413.3 nm)的衍射信号,但是在大于400 nm波长的可见光照射下,单独使用TiO2纳米管阵列依然可以实现一定量CO2的还原转换,这可能是由于TiO2中存在少量R相(<5wt%)的结果。此外,近年来一些研究报道也表明TiO2R/A相的复合也可有效的分离光生载流子并提高光催化活性:李灿等[24]发现TiO2表面为A跟R的混合相时,其催化效率最高可达纯R相的4倍,并认为这是由于A/R相结的存在可以促进光生电子从R相的导带迁移到A相的俘获中心从而提高电荷分离效率所致。覆盖Si膜的TiO2纳米管阵列在650℃下退火后,TiO2由A相和R相组成,A/R相结有效提高了其光催化性能。
在TiO2纳米管阵列上覆盖一层Si膜后,光催化反应中大量的可见光得以吸收,在TiO2和Si半导体中均可产生光生电子-空穴对。杨培东等[18]曾研究了n-Si/TiO2,p-Si/TiO2界面上光生载流子的运动规律,发现载流子在带弯效应的作用下获得有效的分离。因为禁带宽度越小,光生电子-空穴复合的几率就越大,因此Si这种窄禁带半导体的光催化活性极弱。而研究中发现Si与TiO2复合形成的Si/ TiO2异质结结构,使其具有更大的负起始电位和开路电压,为其光解水提供足够大的阴极电位,从而得到了更高效的光催化剂。这与Si较小的禁带宽度和Si/TiO2界面的带弯效应密不可分。Si/TiO2体系在光催化还原CO2过程中,参与反应的光生电子能量对于还原产物的选择性至关重要。
为了深入揭示Si/TiO2的光催化还原机理,Si和TiO2的导带/价带带边电位采用Mulliken电负性公式计算:
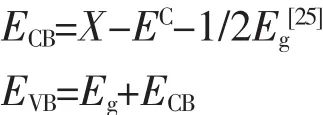
其中,ECB和EVB分别为半导体的导带电位和价带电位,X为半导体的绝对电负性,EC为氢的电子自由能(~4.5 eV),Eg为半导体的禁带宽度。半导体的最大电负性X为化合物中元素绝对电负性的几何平均值,其中元素的绝对电负性为该元素解离能和电子亲和能的算术平均值,而元素的解离能和电子亲和能数据可从相关手册中查到。相关数据及计算结果如表1所示。
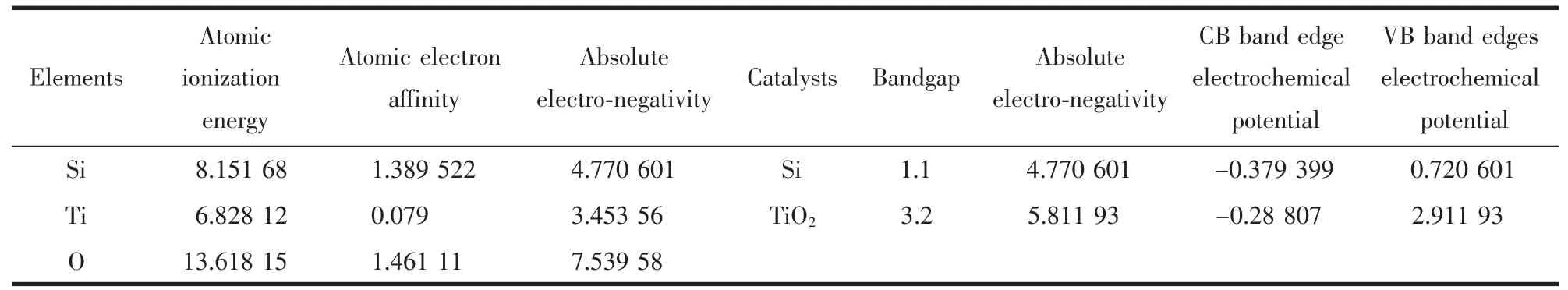
表1 Si,Ti,O原子的电子亲和能、原子解离能和绝对电负性以及Si,TiO2半导体的绝对电负性、禁带宽度和导带、价带的带边电位参数Table 1 Relevant parameters of Ti,O,Si atoms(ionization energy,atomic electron affinity and absolute electronegativity)and TiO2,Si semiconductors(absolute electronegativity,bandgap and electrochemical potentials of CB/VB band edges)
相关数据摘自物化手册[26]。
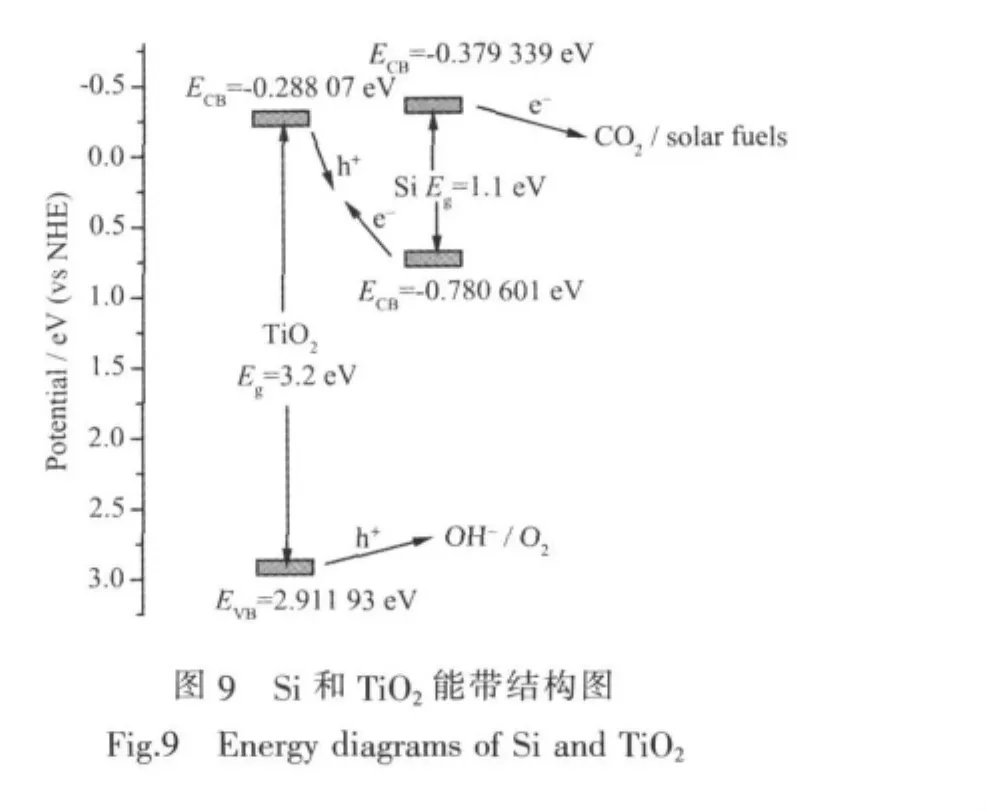
通过计算可得知,Si半导体导带的带边电位为-0.379 339 eV(NHE),即光生电子的单电子势能为-0.379 339 V,低于CO2/HCOOH的还原电位(-0.199 V,NHE)[22],因此光生电子具有足够的能量来还原CO2。因此,Si中的光生电子(Si e-)移动到Si/水溶液界面,发生氧化反应还原CO2生成有机物,Si/TiO2复合结构载流子的流动特征如图9所示。
图9显示了在光照下Si/TiO2界面的载流子移动特征。TiO2只能在紫外光下被激发,而硅在紫外光跟可见光下都能被激发。Si中的光生电子(Si e-)移动到Si/水溶液界面,发生氧化反应从而还原CO2生成有机物,与此同时,Si中的光生空穴(Si h+)移动到Si/TiO2结并与TiO2e-复合。因此,Si/TiO2复合结构能使光生电子-空穴有效分离,因为它在结处的能带结构减少了光照下电子-空穴对的复合。
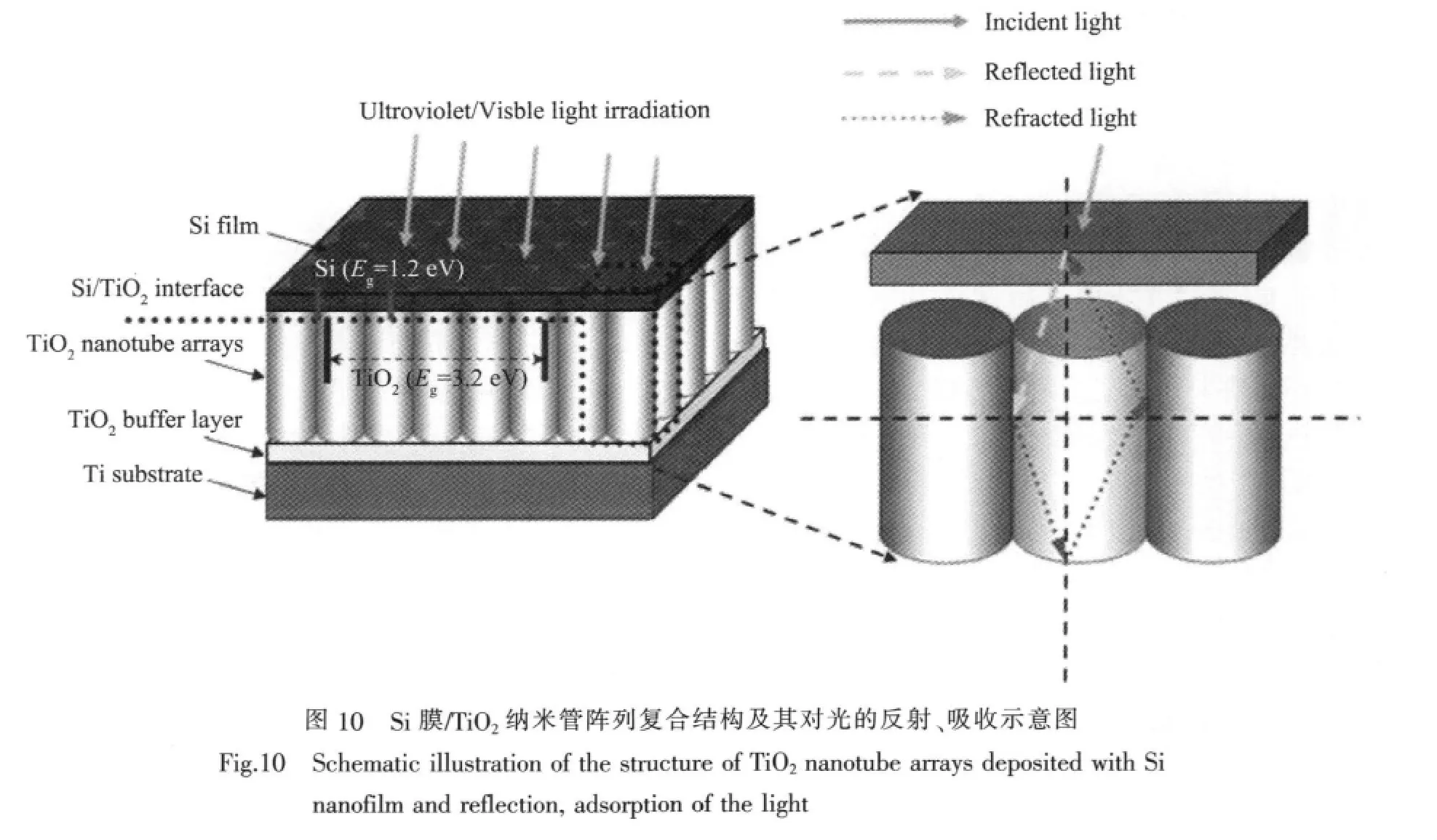
另外,覆盖于TiO2纳米管阵列表面的晶化Si层可大幅度吸收可见光及紫外光能量以降低整个光催化体系的能量耗散。透过Si层的可见/紫外光进入纳米管阵列后发生一系列反射过程,进一步被TiO2和Si所吸收并生成相应的光生电子/空穴,进而强化了整个系统对光能的收集及利用(如图10所示)。
3 结 论
我们以阳极氧化法制备了TiO2纳米管阵列,用CVD法在其上部沉积一层Si膜,经退火,制备了晶化的Si膜/TiO2纳米管阵列复合结构。该结构中,TiO2纳米管孔径约为70 nm,孔壁约为16 nm,管长度约为270 nm,Si膜厚度约为300 nm。Si膜的存在使得该结构除了可以吸收紫外光外还可以吸收可见光,扩大了光吸收范围,Si膜覆盖下的TiO2纳米管阵列可以多次反射入射光,通过延长光的有效路径增加对光的吸收,Si/TiO2异质结和TiO2锐钛矿/金红石相结的存在有效地提高了电子空穴的分离能力,增加了其光催化活性。实验结果表明,覆盖一层Si膜后光催化效率得了较大提高。经过5次循环实验,Si膜/TiO2纳米管阵列仍可保持91.6%的催化活性,具有较好的稳定性。
[1]Lal R.Energy Environ.Sci.,2008,1:86-100
[2]Hansen J,Kharecha P,Beerling D,et al.J.Open Atmos. Sci.,2008,2:217-231
[3]Hansen J E.Environ.Res.Lett.,2007,2:024002-
[4]Youssef B,Rodrigo S G,Abdelhamid S.Adsorption,2011, 17:395-401
[5]Hara K,Kudo A,Sakata T.J.Electroanal.Chem.,1995,391 (1/2):141-147
[6]PENG Yan-Li(彭艳丽),ZHAO Hua-Zhang(赵华章),YANG Qin-Zheng(杨亲正),et al.Chem.Bioengin.(Huaxue Yu Shengwu Gongcheng),2010,7(27):10-13
[7]Tsuneoka H,Teramura K,Shishido T,et al.Phys.Chem., 2010,114:8892-8898
[8]Liu Q,Zhou Y,Kou J H,et al.J.Am.Chem.Soc.,2010, 132:14385-14387
[9]Inoue T,Fujishima A,Konishi S,et al.Nature,1979,277: 637-638
[10]Adachi K,Ohta K,Mijuma T.Sol.Energy,1994,53:187-190
[11]Anpo M,Yamashita H,Ichihashi Y,et al.J.Phys.Chem.B, 1997,101:2632-2636
[12]Thampi K R,Kiwi J,Graetzel M.Nature,1987,327:506-508
[13]Varghese O K,Paulose M,LaTempa T J,et al.Nano Lett., 2009,9(2):731-737
[14]Yan S C,Ouyang S X,Gao J,et al.Angew.Chem.Int.Ed., 2010,49:6400-6404
[15]Zhao Z H,Fan J M,Wang Z Z.J.Clean.Prod.,2007,15: 1894-1897
[16]Morisaki H,Watanabe T,Lwase M,et al.Appl.Phys.Lett., 1976,29(6):338-340
[17]Li G,Liu F,Zhang Z.J.Alloys Compd.,2010,493:L1-L7
[18]Hwang Y J,Boukai A,Yang P D.Nano Lett.,2009,9:410-415
[19]Gong D,Grimes C A,Varghese O K,et al.J.Mater.Res., 2001,16(12):3331-3334
[20]HUANG Hong(黄宏),YAN Wen-Wei(颜文伟),ZONG Li-Qiang(宗利强).Fujian Envir.(Fujian Huanjing),1999,16(5): 33-34
[21]Chung C K,Liao M W,Lai C W.Thin Solid Films,2009, 518:1415-1418
[22]Mallet J,Molinari M,Martineau F,et al.Nano Lett.,2008,8 (10):3468-3474
[23]Roy S C,Varghese O K,Paulose M,et al.ACS Nano.,2010,4 (3):1259-1278
[24]Zhang J,Xu Q,Feng Z C,et al.Angew.Chem.Int.Ed., 2008,120:1766-1769
[25]Chang X F,Ji G B,Sui Q,et al.J.Hazard.Mater.,2009, 166:728-733
[26]Lide D R.Handbook of Chemistry and Physics,87th ed. Florida:CRC Press,2006-2007.
Photocatalytic Reduction of CO2over TiO2Nanotube Arrays Covered with Si Thin Film
LIU You-Song1ZHANG Bin1ZHU Lei1CHANG Xiao-Feng1LI Jian-Sheng2JI Guang-Bin*,1
(1College of Materials Science and Technology,Nanjing University of Aeronautics and Astronautics,Nanjing 211100,China)
(2College of Environment and Biology Engineering,Nanjing University of Science and Technology,Nanjing 210094,China)
In the current study,the composite structure of Si(thin film)/TiO2(nanotube arrays)has been fabricated via annealing amorphous TiO2(nanotube arrays,synthesized by anodizing titanium foil)on which was coated by Si film through chemical vapor deposition (CVD)method,and the photocatalytic reduction of CO2for hydrocarbon compounds(such like formic acid)conversion on as-prepared Si/TiO2structure has been initially investigated as well.The structure of Si/TiO2nanotube arrays was characterized by X-ray powder ray diffraction(XRD),scanning electron microscopy (SEM),Raman spectra (Raman)and transmission electron microscopy (TEM).The length, diameter and wall thickness of as-prepared TiO2nanotube arrays were measured at about 270 nm,70 nm and 16 nm,respectively.The thickness of the crystallized Si film was tested at around 300 nm.The amount total organic carbon as well as formic acid produced in the liquid phase was detected by high performance liquid chromatography (HPLC)and total organic carbon analyzer(TOC).It was found that the photocatalytic property was enhanced obviously after Si deposition.The TOC content increased from 21.2 mg·L-1to 29.5 mg·L-1under Xe lamp irradiation with 400 nm cut filter for 2 h.The improvement of photocatalystic property may due to the high light adsorption and low photogenerated electron and hole recombination of the heterojunction of Si and TiO2.The photocatalytic circulating experiment shows that the photocatalyzer we prepared can keep 91.6%of its photocatalystic property after 5 times reaction.
Si;TiO2;photocatalytic reduction;CO2;formic acid;TOC
O643.36
A
1001-4861(2011)08-1555-09
2011-01-18。收修改稿日期:2011-04-15。
国家自然科学基金(No.51078184)和 江苏省自然科学基金(No.BK2010497)资助项目。
*通讯联系人。E-mail:gbji@nuaa.edu.cn

