Al3+掺杂对Li2FeSiO4结构和电化学性能影响的研究
兰建云 赵敏寿*,,2 王艳芝 乔玉卿
(1燕山大学环境与化学工程学院,秦皇岛 066004)
(2燕山大学亚稳态材料制备技术与科学国家重点实验室,秦皇岛 066004)
Al3+掺杂对Li2FeSiO4结构和电化学性能影响的研究
兰建云1赵敏寿*,1,2王艳芝1乔玉卿1
(1燕山大学环境与化学工程学院,秦皇岛 066004)
(2燕山大学亚稳态材料制备技术与科学国家重点实验室,秦皇岛 066004)
以CH3COOLi·2H2O、C6H8O7·H2O、FeC6H5O7·5H2O、Al2(SO4)3·18H2O和C8H20O4Si为起始原料,采用水热辅助溶胶凝胶法及二次煅烧合成了Li2Fe1-xAlxSiO4/C(x=0.00、0.01、0.03、0.05)正极材料。用IR、XRD、FE-SEM、EDS等方法对材料的晶体结构进行了表征,用ZetaPAL粒度分析仪测量了其粒径分布范围,用SQUID(超导量子干涉仪)测定了样品的磁性,用恒流充/放电对其电化学性能进行了测试。结果表明:n乙酸锂∶n柠檬酸=4∶1、掺Al3+量为3%,80℃回流24 h,350℃恒温煅烧5 h,700℃恒温13 h,所得试样颗粒集中分布在150 nm左右且未出现团聚。在0.1C(16 mA·g-1)、0.2C、0.5C下的首次放电比容量为127 mAh·g-1、103.6 mAh·g-1和91 mAh·g-1,15次循环后无明显衰减,具有很好的循环稳定性。
正极材料;Li2FeSiO4;Al3+掺杂;磁性测定;粒度分布
为解决传统化石能源逐渐枯竭、环境污染、全球气候变暖等问题,及倡导建立资源节约型、环境友好型社会;开发大型储能设备以利用水、风、核、潮汐、太阳等可再生清洁能源,是缓解当今资源与环境矛盾的重要举措。锂离子二次电池作为当今化学电源中比能量最高的电源,不但在车载电源和电动工具电源,而且作为动力型储能电源也具有其自身的优点,近年来得到各国高度关注。目前锂离子二次电池负极材料的实际容量远高于正极材料,正极材料比能量低成为制约锂离子电池车载实用化的技术瓶颈。鉴于此,新型聚阴离子型正极材料硅酸盐体系 (Li2MnSiO4理论容量高达333 mAh·g-1)受到国际科研界的青睐。且硅、铝、铁资源丰富(地壳含量分别为第二、三、四位)、无毒、无污染、安全(Si-O键能大于P-O键,不易分解产生氧),有望成为下一代锂离子电池正极材料。2004年,Nytén等[1]首次合成了Li2FeSiO4正极材料,60℃、10 mA·g-1下首次充电容量达165 mAh·g-1。2008年,Nishimura等[2]采用HR-XRD(高解析X射线衍射)和SAED(选区电子衍射)对Li2FeSiO4的结构进行了精确鉴定,认为FeO4、SiO4四面体并非同向排列。介于Si的电负性比P更低,使Fe3+/Fe2+电对的电位降低[1];与磷酸盐材料相比,硅酸盐因具有较窄的禁带[3-5]而有较高的电子电导率;但FeO4、SiO4四面体非同向排列导致Li+扩散通道曲折,使硅酸盐体系的锂离子扩散速率很低,影响其应用。目前发现对Li2FeSiO4进行非电中性体相掺杂金属元素能够提高其电化学性能[6-8]。Furusawa等[9]和Caudron等[10]发现LiAlSiO4薄膜具有较高的Li+扩散速率,Nagel等[11]研究发现Li-Al-Si材料具有较高的电子电导率,张鸿等[12]实验证实了固体氧化物锂离子导电材料LiAlSiO4的Li+电导率较高;而且Al3+的离子半径接近于Fe3+的离子半径,故本研究欲通过水热辅助溶胶凝胶法[13]合成并体相掺杂Al来提高Li2FeSiO4的Li+扩散速率;以期获得性能良好的锂离子电池正极材料。
1 实验部分
1.1 试样制备
按一定化学计量比称取多组分析纯的CH3COOLi·2H2O、C6H8O7·H2O(天津凯通试剂)、FeC6H5O7·5H2O(天津科密欧试剂)和C8H20O4Si(天津北方试剂厂)。以乙醇和微量去离子水为溶剂,先用去离子水将FeC6H5O7·5H2O在50℃溶解片刻,待溶液呈现浅绿色时将乙酸锂醇溶液加入反应器中,搅拌片刻后加入柠檬酸溶液继续溶解,直到溶液中的柠檬酸铁完全溶解,然后将C8H20O4Si醇溶液缓慢滴入反应器。80℃恒温回流状态下反应24 h后冷却得凝胶。真空干燥、压片后在N2保护下于350℃保温5 h,再于700℃恒温13 h;随炉温冷却至室温即得不同含碳量的Li2FeSiO4/C正极材料。其中,在常压敞口反应器内反应制得的前躯体烧结所得样品标记为A,在常压惰性全混流反应器中制得的前躯体烧结所得样品标记为B。
在优化配比的基础上,按一定物质的量比称取Al2(SO4)3·18H2O、在相同实验条件下采用常压惰性全混流反应器制得不同配比的Li2Fe1-xAlxSiO4/C(x= 0.01、0.03、0.05)正极材料。
1.2 试样表征
试样采用RIGAKU D/max-2500/pc X-射线衍射仪进行物相分析,40 kV、100 mA、Cu靶Kα辐射(λ= 0.154 06 nm),扫描范围10°~80°;采用S-4800型场发射扫描电子显微镜(FM-SEM)对试样进行形貌分析,加速电压 20 kV;采用 Magnetic Property Measurement System(SQUID)XL-7型超导量子干涉仪对试样中的铁磁与亚铁磁成分进行了检测;采用激光粒度仪ZetaPAL(布鲁克公司)对其粒径分布进行了测定。
1.3电性能测试
以NMP(N-甲基吡咯烷酮)为分散剂,按活性物质、乙炔黑、粘结剂(PVDF)质量比80∶15∶5混合研磨,涂于铝箔上(1.5~2.0 mg·cm-2),然后120℃真空干燥12 h得正极涂片;以锂片为负极,1 mol·L-1的LiPF6/EC(碳酸乙烯酯)+DEC(碳酸二乙酯)(1∶1,V/V)为电解液,聚丙烯多孔膜(Celgard2400)为隔膜,在氩气手套箱中装配成柱状模拟电池,于BTS-5 V 10 mA电化学测试仪上恒流充放电测试,电压范围2.0~4.5 V。
2 结果与分析
2.1 IR表征
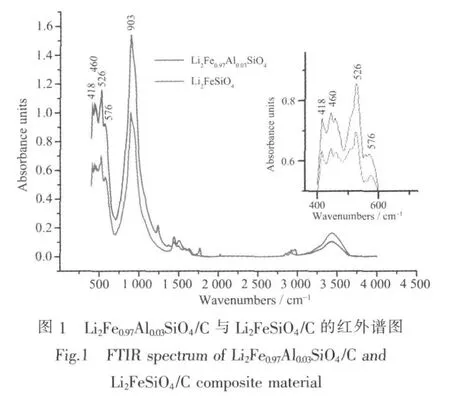
图1为采用水热辅助溶胶凝胶法所合成Li2Fe0.97Al0.03SiO4/C与Li2FeSiO4/C的红外谱图。谱图中,900 cm-1左右为四面体SiO4中Si-O键的伸缩振动吸收峰,526 cm-1及576 cm-1附近为O-Si-O键的弯曲振动吸收峰;在418 cm-1与460 cm-1附近为LiO4四面体的伸缩振动吸收峰。掺杂Al的试样与纯样的谱图基本匹配,未发现其他杂质的吸收峰;与龚正良等[14]所合成的Li2FeSiO4试样红外谱图中的吸收峰基本对应,说明掺杂Al未改变试样中各元素在晶格中的成键关系。
2.2 XRD分析
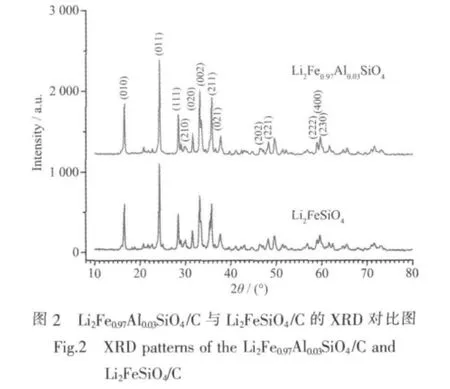
图 2为 Li2Fe0.97Al0.03SiO4与 Li2FeSiO4的 XRD图。从图中可以看出,掺杂试样与未掺杂试样的晶面衍射峰吻合的很好,且晶面峰与Dominko等[15]所得试样的XRD图中的晶面峰相吻合。即:说明微量Al3+是掺杂进入Li2FeSiO4晶格体相中而未以其他相的形式存在于试样中。
2.3 SQUID磁性测量
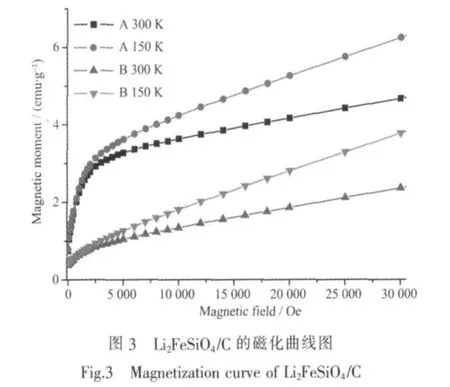
Li2FeSiO4/C中铁磁或亚铁磁物种的相对含量对试样电化学性能的发挥具有阻碍作用,所以在试样制备过程中应尽量避免其产生。本实验采用SQUID测定了试样的磁性,所得磁化曲线如图3所示。在不含铁磁簇的情况下磁化曲线应该为直线[16],低磁场区磁化曲线的弯曲程度反映了材料中铁磁簇的相对含量。由图3可知,在大气环境下合成的试样A在低磁场区的弯曲程度很大,而在惰性环境下合成的试样B在低磁场区也接近呈线性关系,即弯曲程度很小,说明试样中几乎不含铁磁簇相。
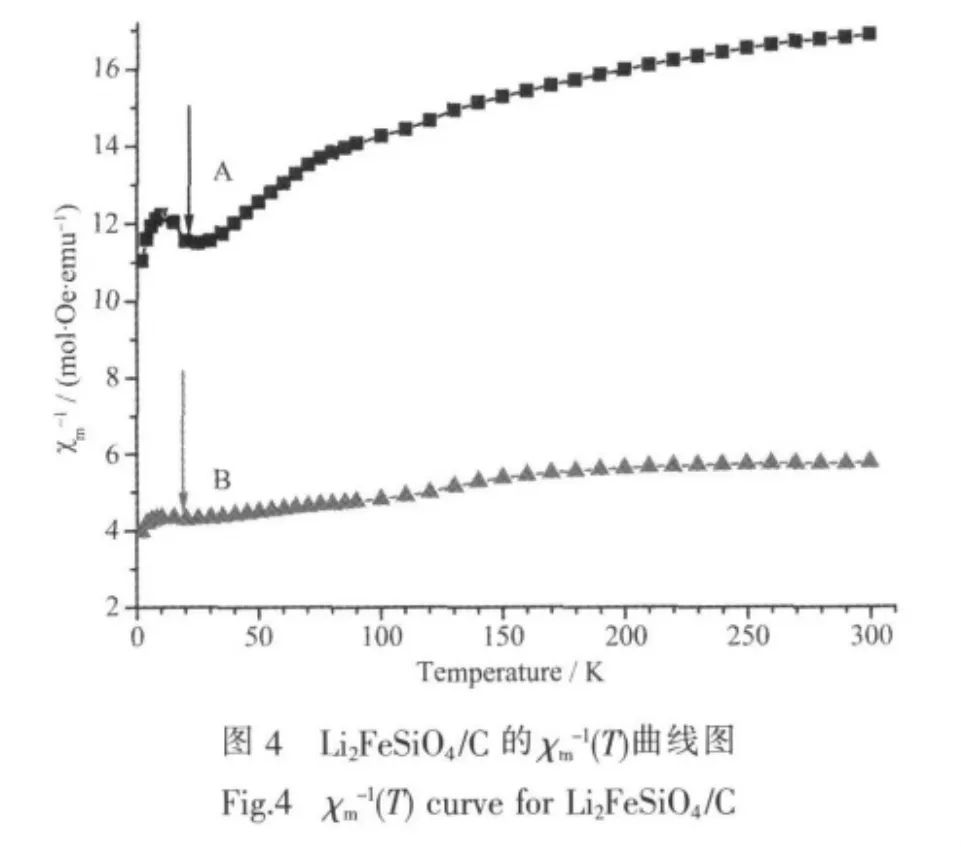
在惰性环境下水热辅助溶胶凝胶法合成的样品A的摩尔磁化率χm约为10-2emu·mol-1·Oe-1,而在大气环境下合成的样品B的摩尔磁化率约为1.1 emu·mol-1·Oe-1左右,磁化率大说明样品中含有铁磁性杂相。反铁磁转变点如图4中的箭头所示,转变温度(奈尔温度TN)约为23 K,在奈尔温度以上,Li2FeSiO4/C顺磁性,在奈尔温度以下表现为反铁磁性。与试样B的曲线相比,试样A在奈尔温度以下出现较大弯曲现象,即试样A中含有较多的铁磁性成分;也就是说采用惰性合成(试样B)可以很好地避免试样中Fe3+的产生,这样才有利于试样电化学性能的提高。
2.4 FE-SEM及EDS分析
图 5为 Li2Fe0.97Al0.03SiO4/C与 Li2FeSiO4/C的SEM图。比较图(a)与(b)可知,试样Li2Fe0.97Al0.03SiO4/C颗粒均匀,未出现团聚现象,试样Li2FeSiO4/C颗粒分布不规则且出现团聚现象。图6为试样Li2Fe0.97Al0.03SiO4/C的EDS分析图,由面扫描图(c)可以看出,Al元素均匀地分布在试样中。EDS分析结果显示,Fe与Al的质量百分含量分别为27.45%和0.47%,原子百分比为10.33%和0.36%,接近实验设计的掺杂比例,表明Al已均匀地分布在Li2FeSiO4试样中。

2.5 粒度分布测量
锂离子电池电极材料颗粒的粒径大小和粒度分布均匀性对材料电化学性能具有重要的影响。粒径越小,粒度分布越集中,材料的电化学性能就越好。图7是Li2Fe0.97Al0.03SiO4/C与Li2FeSiO4/C材料的粒度分布图。由图可知,掺杂试样粒径在150 nm左右且粒度分布集中,未掺杂试样Li2FeSiO4/C粒径较大(500~600 nm左右)且分布范围较广。作者认为,两种试样均达到纳米级范围,这得益于溶胶凝胶法使各元素处于分子级水平混合;再者就是采用了二次煅烧工艺,探索出各阶段最佳保温时间(5 h与13 h);这样既保证了固相反应能够充分完成,又避免了煅烧时间过长而使颗粒团聚。从图中还可以看出,Al3+的掺杂能够有效地减小试样的颗粒直径,能够缩短Li+从颗粒内部扩散到表面参加电化学反应的距离,从而有利于试样电化学性能的提高。
2.6 电化学性能
图8为Li2Fe0.97Al0.03SiO4的首次、第二次和末次充放电曲线图。从图中可以看到,试样在第一次放电时约在3 V左右出现一个微小平台,在以后放电过程中约在2.78 V左右出现放电平台;Nytén等[1]也在充放电过程中观察到类似情况,作者认为这种放电平台的微小转变可能是起因于试样在充放电过程中原子在晶体结构中的微小调整,这样使晶体结构更加有序化;有利于提高Li+的脱嵌速率,使材料的电化学性能更佳。
图9是醋酸锂与柠檬酸不同配比下所合成的Li2FeSiO4/C在0.1C下的循环性能曲线图。由图可知,在醋酸锂与柠檬酸的物质的量之比为4∶1时,试样的放电比容量较好,其容量远高于两者比为1∶1和2∶1的其他两种配比。作者认为,柠檬酸含量增加,前躯体在惰性气氛中煅烧产生的纳米碳粒过多,降低了有效电化学活性物种所占比例,不利于充放电过程中Li+的扩散,反而使试样的电化学性能降低。在此实验中,柠檬酸起胶凝和助溶作用。作者发现,若再减少柠檬酸含量,柠檬酸铁就不能溶解充分而影响凝胶中各元素的均匀性,进而使所得试样的循环性能欠佳。
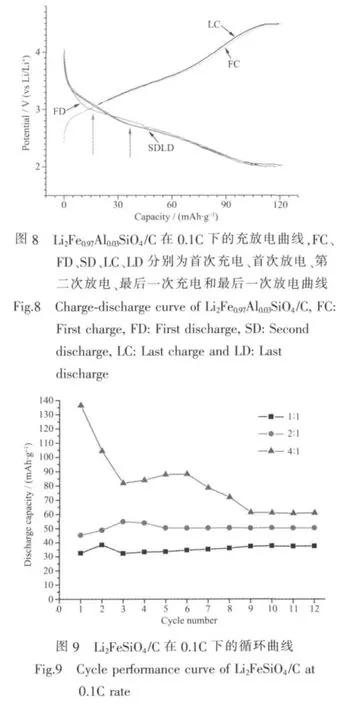
图 10是Li2Fe1-xAlxSiO4/C(x=0.01~0.05)在 0.1C下的循环性能曲线图。由图可知,当掺杂量x=0.03时,试样循环稳定性最好,放电比容量远高于其它两种配比,20次循环也没有任何衰减现象出现。作者认为,适量的掺Al量能够有效提高Li+的扩散速率,得益于在脱锂时Al附近的Li+因库伦效应而优先脱出晶体,接着Fe2+转变为Fe3+而使更多的Li+参与到脱出过程中,进而提高Li+的脱出速率;但是,因为Al与Fe的离子半径接近,Al含量增加可能导致晶格中过多的Fe位被Al取代,而在充放电过程中Al的化合价不变,即Al是电化学惰性的,这样在嵌锂时Al就会阻碍Li+进入晶格 (库伦效应),进而影响试样的比容量。也就是说,最佳掺杂量是由脱锂过程与嵌锂过程共同作用的,掺杂量过多或过少均会影响试样的电化学性能。再者掺杂试样比容量的提高,也得益于掺杂Al使试样颗粒粒径减小,粒度分度集中,如图7所示。
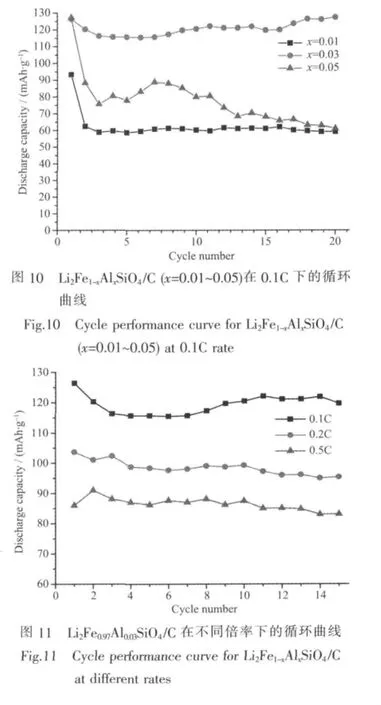
图11为Li2Fe0.97Al0.03SiO4/C在不同倍率下的循环曲线图。从图中可以看出,放电比容量随放电倍率的增大而减小;在0.1C、0.2C、0.5C下的最大放电比容量分别为127、103.6和91 mAh·g-1,但循环稳定性均优于试样Li2FeSiO4/C在0.1C下的循环稳定性,这得益于掺杂Al使试样颗粒细化和在晶体中造成缺陷,有利于Li+的脱嵌过程,缩短了Li+在试样中的扩散路径。
3 结 论
(1)优化了Li2FeSiO4/C试样中的碳含量、掺杂量和合成工艺,得出较好的合成条件为:惰性环境80℃回流24 h,350℃恒温煅烧5 h,700℃恒温13 h;
(2)采用SQUID定性的检测了试样中铁磁成分的相对含量,得出在惰性环境下合成的Li2FeSiO4试样几乎不含铁磁性物质成分,奈尔温度为23 K左右;
(3)采用激光粒度分布仪测定了试样的粒度分布,在掺Al3+量为3%时,试样粒度分布集中、粒径最小,即150 nm左右;
(4)用IR、XRD、FE-SEM对试样晶体结构和表面形貌进行了分析,发现掺Al3+未改变晶体晶面峰间的相对位置;掺杂试样Li2Fe0.97Al0.03SiO4粒径减小,有利于Li+的扩散;
(5)在掺Al3+量为0.03时,试样的电化学性能最好,在0.1C、0.2C、0.5C下的最大放电比容量分别为127、103.6和91 mAh·g-1,15次循环后无明显衰减,具有很好的容量保持率。
[1]Nytén A,Abouimrane A,Armand M,et al.Electrochem.Commun.,2005,7:156-160
[2]Nishimura S I,Hayase S,Kanno R,et al.J.Am.Chem.Soc., 2008,130:13212-13213
[3]Hu J Z,Xie J,Zhao X B,et al.J.Mater.Sci.Technol., 2009,25(3):405-409
[4]Dompablo M A,Armand M,Tarascon J M,et al.Electrochem. Commun.,2006,8:1292-1298
[5]Larsson P,Ahuja R,Nytén A,et al.Electrochem.Commun., 2006,8:797-800
[6]Deng C,Zhang S,Yang S Y,et al.J.Power Sources,2011, 196(1):386-392
[7]Zhang S,Deng C,Fu B L,et al.J.Electroanal.Chem.,2010, 644(2):150-154
[8]Fan X Y,Li Y,Wang J J,et al.J.Alloys Compd.,2010, 493:77-80
[9]Shin-ichi F,Satoshi S,Kaduhiro S,et al.Solid State Ionics, 2004,167:325-329
[10]Caudrona E,Bauda G,Besse J P,et al.Solid State Ionics, 1994,70-71(1):629-635
[11]Nagel W,Böhm H.Solid State Commun.,1982,42(9):625-631
[12]ZHANG Hong(张鸿),LI Zhong-Lan(李中兰),JIA Yan-Jun (贾艳军),et al.World Sci-Tech R&D(Shijie Keji Yanjiu Yu Fazhan),2007,29(4):1-4
[13]WANG Juan(王娟),LI Chen(李晨),XU Bo(徐博).Chem. Ind.Eng.(Huaxue Gongye Yu Gongcheng),2009,26(3):273-277
[14]GONG ZHeng-Liang(龚正良).Thesis for the Doctorate of Xiamen University(厦门大学博士论文).2007.
[15]Dominko R,Arcon I,Kodre A,et al.J.Power Sources, 2009,189:51-58
[16]Zaghib K,Ravet N,Gauthier M,et al.J.Power Sources, 2006,163:560-566
Effect of Al3+Doping on Structure and Electrochemical Performance of Li2FeSiO4
LAN Jian-Yun1ZHAO Min-Shou*,1,2WANG Yan-Zhi1QIAO Yu-Qing1
(1College of Environmental and Chemical Engineering,Yanshan University;Qinhuangdao,Hebei 066004,China)
(2State Key Laboratory of Metastable Science and Technology,Qinhuangdao,Hebei 066004,China)
Adopting CH3COOLi·2H2O,C6H8O7·H2O,FeC6H5O7·5H2O,Al2(SO4)3·18H2O and C8H20O4Si as starting raw material,Li2Fe1-xAlxSiO4/C (x=0.00,0.01,0.03,0.05)electrode material was prepared by hydrothermal assisted sol-gel method and two-step heating solid-state reaction.The structure of the material was studied by IR,XRD, FE-SEM and EDS.The magnetic performance of the material was tested by superconducting quantum interference device (SQUID)and the distribution of the material′s particle size was measured by ZetaPAL laser particle size analyzer.The results show that the electrochemical performance is desirable when the molar ratio of lithium acetate and citric acid was 4∶1 and the dopant of Al3+was 3%,and the solution was refluxed at 80℃for 24 h,then dried.The precursor was calcined for 5 h at 350℃and 13 h at 700℃,and the size of the composite was about 150 nm and aggregation phenomenon wasn′t found.The discharge capacity of initial cycle is 127 mAh·g-1,103.6 mAh·g-1and 91 mAh·g-1under the ratio of 0.1C (16 mA·g-1),0.2C and 0.5C,respectively and there is no significant degradation even after 15 times cycling,and the cycle stability of material is very well.
positive material;Li2FeSiO4;Al3+-doped;measurement of magnetic property;distribution of particle size
O614.111;O614.81+1;O613.72;TM912.9
A
1001-4861(2011)08-1497-06
2011-03-06。收修改稿日期:2011-04-18。
燕山大学亚稳态材料制备技术与科学国家重点实验室基金(No.MM022)资助项目。
*通讯联系人。E-mail:lanjianyun0713@sina.com

