掺杂Fe2O3对吸附相反应技术制备TiO2的形貌和光催化性能的影响
王 挺 吴礼光*, 蒋 新
(1浙江工商大学环境科学与工程学院,杭州 310012)
(2浙江大学化学工程与生物工程学系,杭州 310027)
掺杂Fe2O3对吸附相反应技术制备TiO2的形貌和光催化性能的影响
王 挺1吴礼光*,1蒋 新2
(1浙江工商大学环境科学与工程学院,杭州 310012)
(2浙江大学化学工程与生物工程学系,杭州 310027)
利用吸附相反应技术制备得到了掺杂不同浓度的Fe2O3的TiO2复合光催化剂。通过透射电子显微镜(TEM)、紫外可见光谱和X射线衍射(XRD)研究不同掺杂浓度对TiO2形貌和结晶过程的影响,并利用3种波长光源下的甲基橙光降解实验考评了各个复合光催化剂的催化活性。结果表明,掺杂后复合光催化剂中Fe2O3分散性较好较均匀。在TiO2紫外可见吸收光谱中由于Fe2O3的掺杂而出现了红移,而且随着掺杂浓度增加红移越来越明显,复合光催化剂的禁带宽度也越来越小。在焙烧过程中无定形Fe2O3或Fe3+进入了TiO2的晶格结构,从而抑制了TiO2的结晶过程。半导体禁带宽度的减少以及TiO2结晶过程的抑制作用,都导致紫外光下复合光催化剂催化活性的降低。但Fe2O3的掺杂也使得复合光催化剂在可见光区出现了一定的光催化活性。
吸附相反应技术;Fe2O3掺杂;TiO2;光降解;甲基橙
0 引 言
随着全球性环境恶化的日益突出,近30年来大量光催化氧化技术的研究关注在有机化合物的矿化或者是降解[1-2]。由于具有优异催化的性能,小粒径的TiO2粒子,尤其是具有量子尺寸的TiO2粒子(粒径在10 nm以下)逐渐成为半导体光催化研究的重点之一[3-4]。例如,当TiO2的粒径从16 nm减小为8 nm时,其催化活性可提高6倍以上[5]。针对制备小粒径的TiO2纳米粒子,人们提出了很多研究方法。其中吸附相反应技术(Adsorption phase synthesis,APS)是一种新型的微反应器技术,它能有效地在较小尺度范围调控粒子粒径[6-7]。利用该技术,作者所在的研究小组已经在纳米SiO2的表面制备了粒径在2~7 nm的TiO2粒子[8-9]。这些小粒径、高分散的TiO2粒子在降解甲基橙水溶液和气相甲苯中表现出了较高的活性[10-12]。在相同条件下,吸附相反应技术得到的TiO2的光催化活性要远高于浸渍法得到的催化剂[10]。在甲苯的降解过程中,吸附相反应技术得到的光催化剂的活性也略高于商用P25光催化剂[12]。
然而TiO2具有较宽的能带(金红石型3.2 eV,锐钛矿型3.0 eV)和较窄的吸收光谱,其受光激发产生的截流子(光生电子和空穴)往往非常容易复合[13-14]。人们已经提出了很多抑制截流子复合来提高TiO2光催化活性的方法,如贵金属沉积[15],半导体耦合[16]以及金属离子掺杂[17]等。其中半导体耦合不仅能有效的抑制截流子复合而且可以拓宽TiO2的吸收光谱,从而得到广泛关注。半导体耦合中采用的大多是具有宽吸收光谱带的半导体[18],如CdS(2.5 eV),CdSe (1.7 eV)以及Fe2O3(2.2 eV)等。考虑到对环境的友好因素以及半导体本身的稳定性等原因,Fe2O3往往是TiO2半导体耦合研究中最受关注的氧化物之一[19-20],掺杂了Fe2O3的TiO2复合光催化剂不仅催化活性有所提高,而且其吸收光谱也可达到可见光区域的波长范围。
本工作在前期工作的基础上[10-12],首先选择了光催化降解甲基橙和气相甲苯反应中,活性最高催化剂的制备和焙烧条件。进一步设计了不同浓度Fe2O3掺杂的TiO2复合光催化剂的制备实验,研究不同浓度的Fe2O3加入对吸附相反应技术得到TiO2粒径等形貌、吸收光谱以及结晶过程的影响,并结合紫外和可见3种波长光源下的甲基橙光降解反应,考评了掺杂了Fe2O3的加入对TiO2光催化活性的影响。
1 实验部分
1.1 TiO2/Fe2O3/SiO2的制备
取0.5 g亲水性、大比表面积的纳米级载体SiO2,200 mL无水乙醇,1.5 mL去离子水和不同量的NaOH置于三口烧瓶中,在不同温度下搅拌吸附、反应。由于SiO2的选择性吸附作用,其表面逐渐形成富集了NaOH的吸附水层。在吸附达到平衡后,加入不同浓度的硝酸铁乙醇溶液(50 mL)。硝酸铁扩散到碱性氛围的吸附水层中,进行反应形成Fe(OH)3/ SiO2(反应时间2 h)。而后将得到的Fe(OH)3/SiO2重新分散于200 mL乙醇中,加入1.5 mL水,待吸附平衡后加入50 mL钛酸丁酯(2.15 g)的乙醇溶液,酞酸丁酯在吸附水层中,通过水解、缩聚反应在吸附层中形成TiO2得到TiO2/Fe(OH)3/SiO2。反应5 h后,经过多次离心、再分散、洗涤并烘干,最后700℃焙烧5 h,得到各个TiO2/Fe2O3/SiO2样品。
1.2 光降解甲基橙实验
称取0.28 g 吸附相反应技术制备的TiO2纳米复合光催化剂,量取40 mL浓度为4 mg·L-1的甲基橙溶液,40 mL缓冲溶液和720 mL去离子水,置于带磁力搅拌的反应器中,控制水浴温度为30℃,吸附0.5 h。吸附平衡后,用波长为254和365 nm的紫外灯以及日光灯(30 W)照射进行光降解,每隔半小时进行取样,离心分离,取上层清液,利用可见光分光光度仪(721型,上海第三分析仪器厂)测定甲基橙的吸光度(测定波长490 nm)并求出其浓度变化。同时进行各个波长光源照射下的空白实验,以扣除空白实验的影响。
1.3 实验试剂与表征
实验试剂:二氧化硅(平均粒径12 nm,比表面积200 m2·g-1,Degussa公司AEROSIL200),钛酸丁酯(分析纯,常州蓝天化工厂),无水乙醇(分析纯,上海试剂一厂),甲苯(分析纯,杭州化学试剂有限公司)。
将少量样品分散在一定量乙醇中,超声分散后取数滴滴于带有有机膜的铜网上,待溶液挥发完全后进行TEM分析(工作电压100 kV),TEM分析采用日本的JEOL公司的JEM-200CX。样品的XRD分析在日本Rigaku公司的D/max-rA转靶X射线多晶衍射仪上进行。采用Cu Kα(λ=0.154 06 nm),功率为1 600 W(40 kV×40 mA),采用固体探测器(Sol-X)测量X射线强度,并通过高斯方程拟合XRD图中2θ= 45°~52°的衍射峰,利用Scherrer公式来计算得到TiO2的晶粒粒径。样品的紫外可见吸收光谱测量是将样品压制成片,在装有积分球的紫外可见光-近红外分光光度计(TU-1901,北京普析通用仪器有限责任公司)上进行,BaSO4作参比,测量范围250~600 nm。
2 结果和讨论
2.1 TEM形貌分析
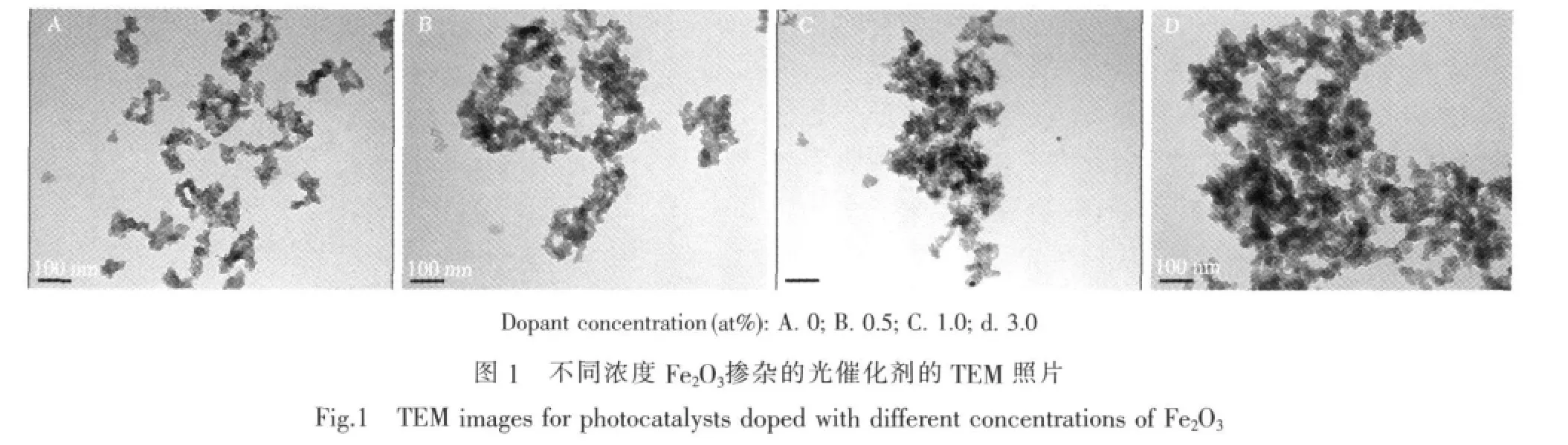
从图1可以看出,掺杂了Fe2O3的TiO2复合粒子的形貌与未掺杂的TiO2/SiO2形貌没有明显的差异,仅仅硅胶表面的黑点和黑色的区域有所增加。这说明掺杂的Fe2O3在复合粒子中有较好的分散性。随着Fe2O3掺杂量增加,样品形貌中黑色区域变得略微明显。
2.2 紫外可见吸收光谱分析
紫外可见吸收光谱中,300~450 n m处的强吸收是TiO2的吸收引起的。对比未掺杂TiO2的吸收曲线,可以看到Fe2O3的掺杂使TiO2吸收波段产生了明显的红移现象,且Fe2O3掺杂的浓度越大,红移现象越明显。另外,仔细观察复合光催化剂的吸收曲线发现,当Fe2O3的掺杂浓度超过2.0at%时,样品紫外光谱图中460~500 nm的位置出现了非常微弱的吸收峰,根据文献这是Fe2O3吸收导致的。而掺杂浓度低于2.0at%时,则吸收曲线里面没有出现这个峰。这也间接说明了掺杂后的Fe2O3在复合光催化剂中的分散性非常好。
根据半导体紫外可见吸收光谱的研究[10,21],UVVis谱图中通过吸收带拐点处切线(即吸收带边直线区延长线)与零吸收值水平线(Abs=0)相交,交点的横坐标所指波长即为所测半导体的光吸收阀值λg,并利用公式:λg=1 240/Eg,求出半导体的禁带宽度Eg(如表1所示)。
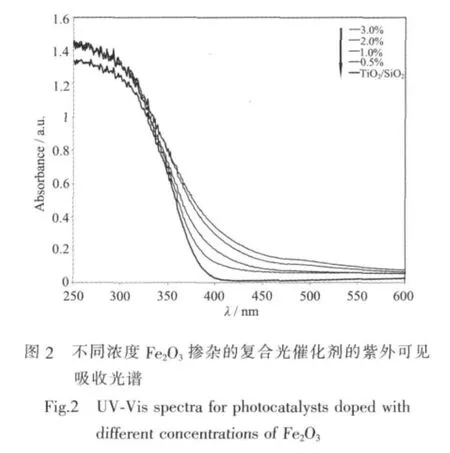
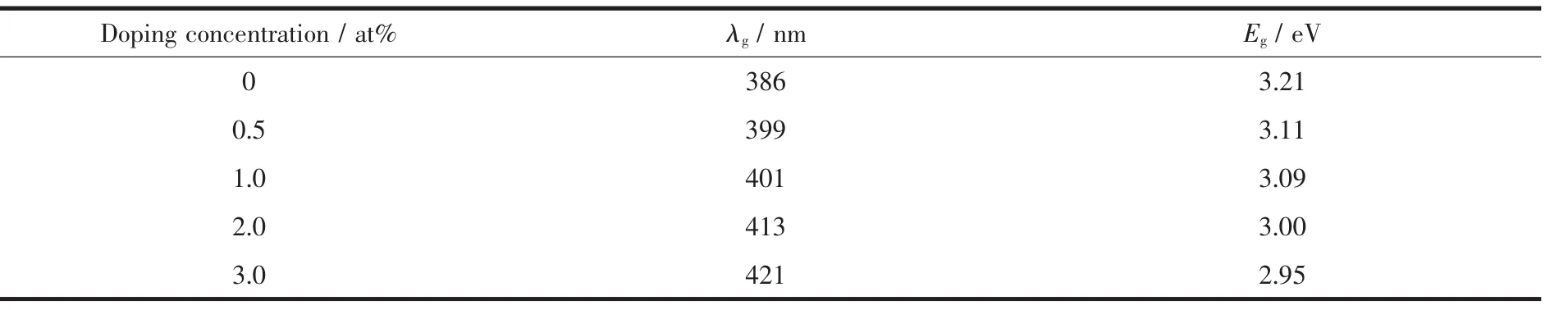
表1 Fe2O3的掺杂浓度对复合光催化剂的最大吸收波长λg和禁带宽度Eg的影响Tabel 1 λgand Egof photocatalysts doped with different concentrations of Fe2O3
表1的数据进一步显示,经过Fe2O3掺杂后,TiO2的光吸收阀值都随之增加,其吸收光谱也有了明显地拓宽。掺杂了2.0at%的Fe2O3后,λg超过了400 nm到达了可见光波段范围,这说明Fe2O3-TiO2复合光催化剂具有了一定的可见光下的光催化活性。但掺杂后复合光催化剂的禁带宽度Eg有了一定的减少,表明了复合光催化剂的光催化活性可能会比未掺杂TiO2要有所降低。
2.3 XRD分析
图3是不同浓度Fe2O3掺杂后复合光催化剂的XRD图。由图中可以看出,掺杂后复合光催化剂的图谱中没有出现Fe2O3或者是文献中提到的Fe2TiO5等的结晶峰。结合TEM和UV-Vis光谱分析结果,作者认为吸附相反应技术得到的复合光催化剂中,Fe2O3粒径非常小且分散性良好,甚至可能以原子态级分布于TiO2的晶格中,因此在XRD分析中得不到Fe2O3的结晶峰。另一方面,这也说明了复合催化剂中Fe2O3良好的分散性,从而验证了TEM和紫外可见吸收光谱分析中得到的结论。
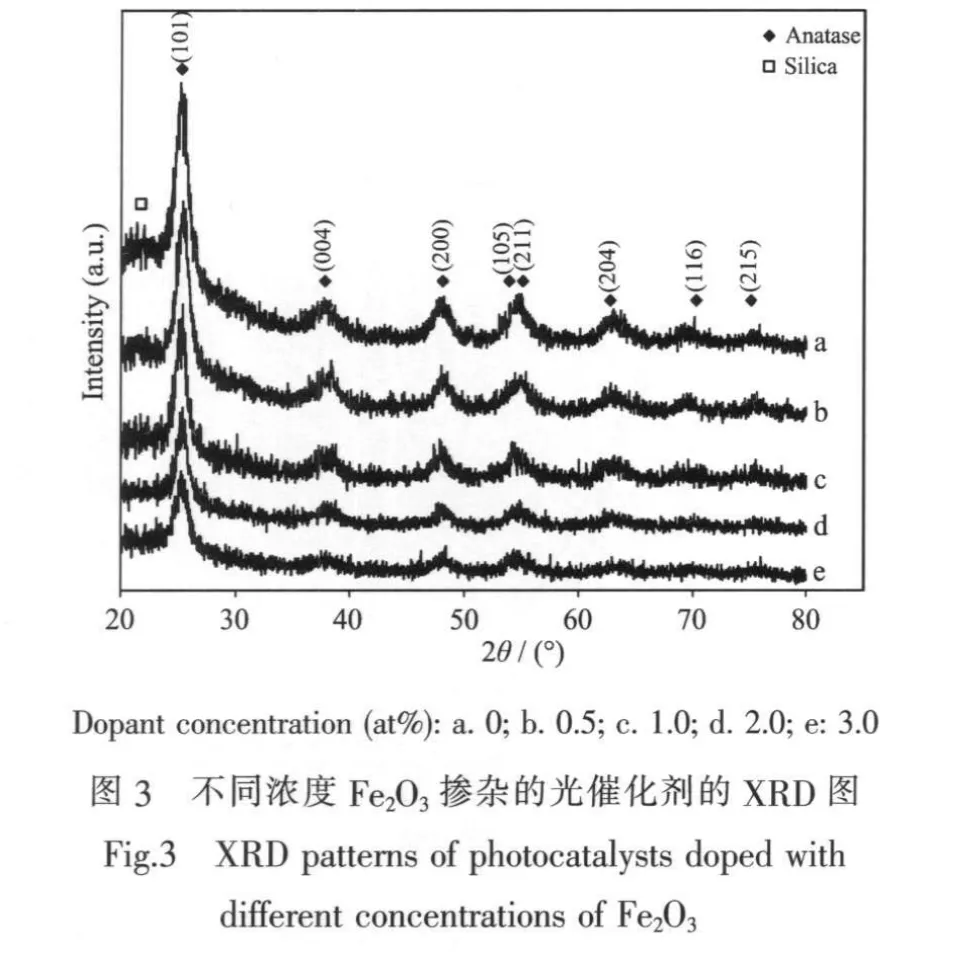
对比未掺杂的TiO2的XRD图,可以发现掺杂后复合粒子中的TiO2也都呈现均匀的锐钛矿型结晶,但其结晶峰的强度都有不同程度地减弱,且掺杂浓度越大,减弱的越明显。根据文献中对于铁掺杂TiO2的复合光催化剂的研究[22-25],这可能是因为Fe2O3或者Fe3+进入TiO2晶格而导致的。由于Fe3+与Ti4+离子半径近似,在复合光催化剂的制备和焙烧过程中较易进入TiO2的晶格而破坏其连续结构,使得TiO2的结晶过程得到明显地抑制。掺杂浓度越高,其进入TiO2晶格的Fe3+等越多,其抑制作用越明显。
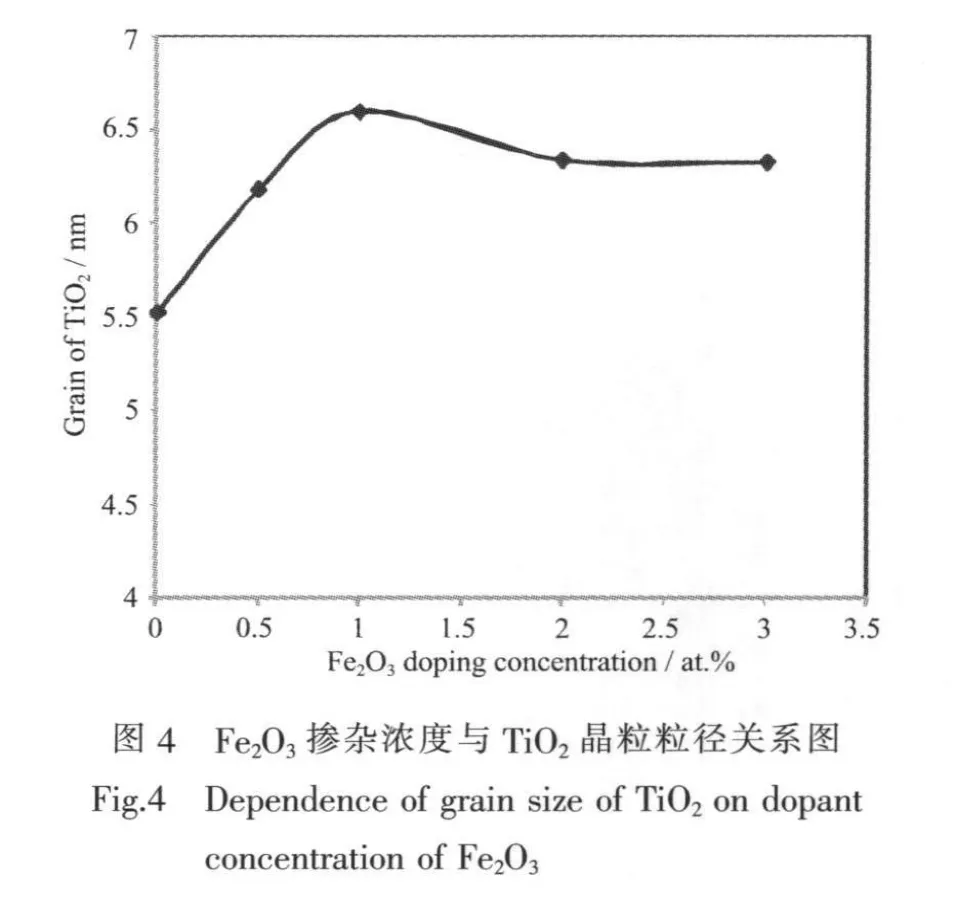
对各个催化剂XRD图中的48°峰高的锐钛矿峰得到半高宽,并利用Scherrer公式计算TiO2的晶粒粒径(图4)。
图4的结果显示,掺杂了Fe2O3后虽然TiO2结晶过程被明显地抑制,但其晶粒粒径变化不大,即使较高浓度的Fe2O3的掺杂量下,复合光催化剂中的TiO2的晶粒粒径也维持在6 nm左右,略大于未掺杂的TiO2的晶粒粒径。
2.4 短波紫外光源下(254 nm)光催化降解实验
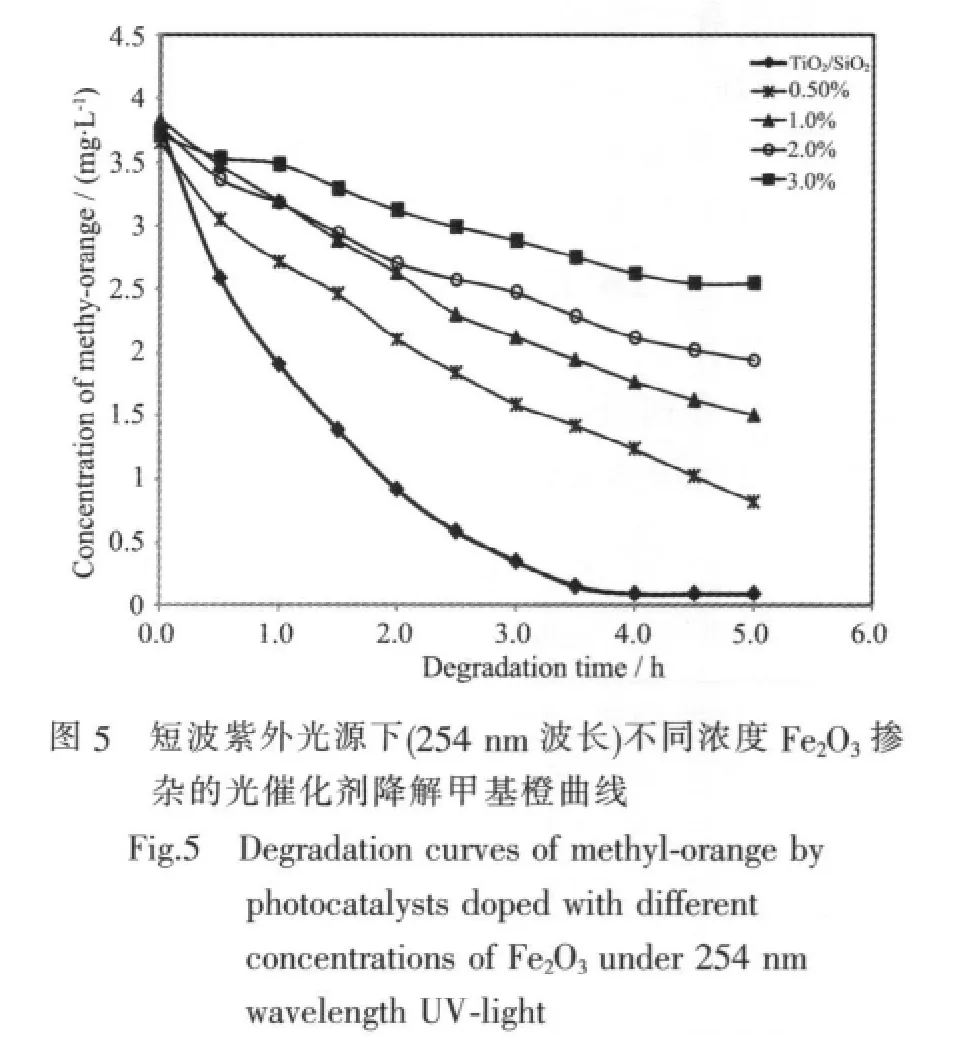
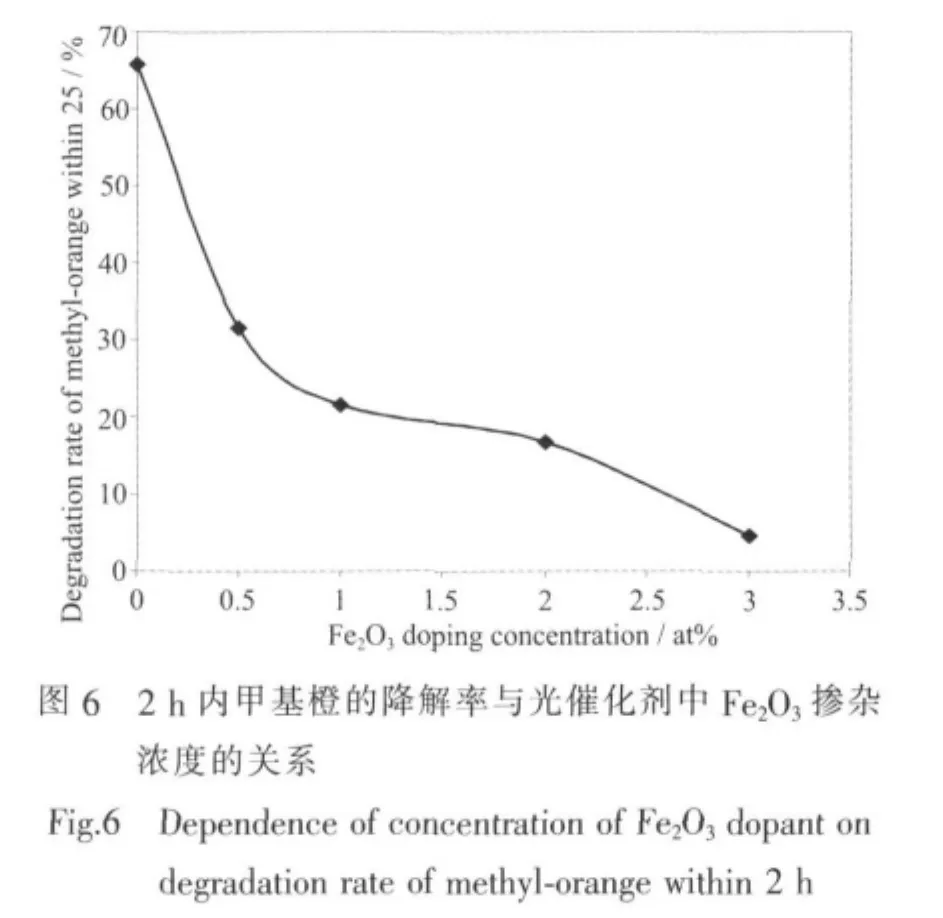
由图5的短波长光源下的甲基橙降解曲线可以看出,掺杂Fe2O3后,复合光催化剂的活性较未掺杂的TiO2/SiO2光催化剂的活性有明显地降低。而且随着掺杂浓度的增加,复合光催化剂的活性降低的很快,这和文献中铁掺杂提高TiO2光催化活性的结论不一致[22-25]。为了更直观地对比各个催化剂的活性,作者将图5中的降解曲线进行拟合后,计算得到催化剂在2 h内对甲基橙的降解率(图6)。
从图6可以更清楚地看出,随着Fe2O3的掺杂TiO2的光催化活性降低的很明显,作者认为这是由于吸附相反应技术得到的TiO2结构和性能上的特点导致。根据铁掺杂的TiO2光催化过程的研究可知[22-25],铁的加入对光催化活性有着截然不同的2种作用:一方面铁的加入在TiO2表面引入了一定量作为光生截流子的捕获中心的缺陷,如Fe进入TiO2晶格之后形成的缺陷。这就抑制光生电子和空穴的复合,提高TiO2的光催化活性;另一方面,Fe的掺杂抑制了TiO2从无定形到锐钛矿的晶型转变,活性较高的锐钛矿型TiO2的减少又会导致其光催化活性的降低。在大部分Fe掺杂的文献中[22-25],第一方面对光催化的促进作用占主导地位,因此Fe的掺杂可以较好地提高复合光催化剂的活性。
而由前期 TiO2/SiO2光催化过程研究[10-12]可知,吸附相反应技术得到的TiO2粒径一般为1~7 nm,且高度分散在载体SiO2的表面,表面的晶格缺陷数量较多,其催化活性非常高,在气相甲苯催化中体现了优于商用P25催化剂的活性[12]。因此吸附相反应技术制备过程中,Fe掺杂后对TiO2表面缺陷数量的影响不大,也就是说Fe的加入对TiO2光催化活性的促进作用不大。而此时掺杂对TiO2结晶过程的抑制则大大削弱了光催化活性。掺杂的Fe2O3浓度越高,对TiO2结晶过程抑制作用越显著,因而其复合光催化剂的活性降低的越明显。
2.4 长波段紫外光(365 nm)和可见光(日光灯)下光催化降解实验
根据UV-Vis、XRD和254 nm波长的紫外光降解结果,当掺杂量为2at%时,Fe2O3的掺杂既能使得复合光催化剂的吸收光谱红移致可见光波段,又对TiO2的结晶过程和短波紫外光下的降解活性抑制作用较小。因此,作者选取了2at%Fe2O3掺杂的复合光催化剂进行长波段紫外光和可见光两个条件光降解研究,同时进行同样条件下未掺杂的TiO2/SiO2的降解实验作为对比(图7)。
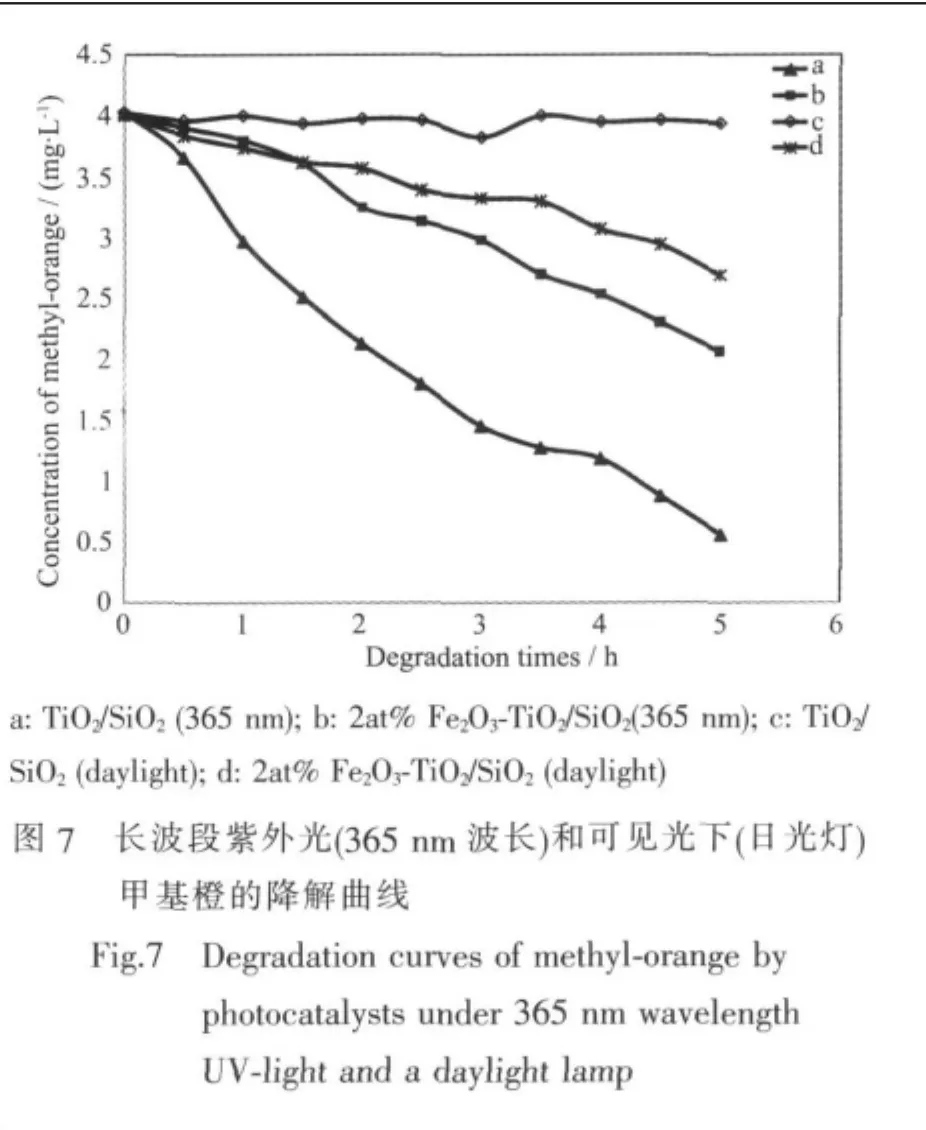
由上图可以看出,在365 nm波长的紫外光下,未掺杂的TiO2/SiO2的活性仍高于掺杂了Fe2O3的复合光催化剂。这可能是因为当波长小于385 nm左右的紫外光照射下,掺杂和未掺杂的TiO2都能有效地被激发。因此,复合光催化剂较小的禁带宽度以及Fe2O3的掺杂对TiO2晶型转变的阻碍作用,同样导致复合光催化剂的活性低于未掺杂的TiO2/SiO2光催化剂。但对比图5和图7可以发现,长波段紫外光下的未掺杂TiO2/SiO2与掺杂Fe2O3复合光催化剂的活性差异要小于短波段紫外光下两者的差异。
在可见光的照射下,Fe2O3掺杂的复合光催化剂有一定的光催化活性,而未掺杂的TiO2则不能降解甲基橙。这就说明掺杂了Fe2O3之后,能有效地拓宽TiO2的光谱响应,使复合光催化剂在可见光区具有光催化活性,这个结果也再一次证明了光催化剂的紫外可见吸收光谱得到的结论。从图中可以看出,文中Fe2O3掺杂的复合光催化剂在可见光光照下的光催化活性不是很高。这可能是因为Fe2O3的加入抑制了TiO2从无定形到锐钛矿型的晶型转变过程。也可能是因为实验中的光源是日光灯,强度较弱而导致。对提高掺杂TiO2的可见光下的催化活性还需进一步研究。
3 结 论
复合光催化剂的制备和焙烧过程中,Fe2O3或Fe3+能够进入TiO2的晶格结构,所以掺杂后TiO2形貌基本保持不变。但TiO2连续晶格结构的破坏大大抑制了复合光催化剂中TiO2结晶过程,这就导致了2种波长紫外光照射下,掺杂后复合催化剂的光催化活性弱于未掺杂的TiO2。经过Fe2O3掺杂后,TiO2的光吸收阀值(λg)有了明显地拓宽,当掺杂量在2.0at.%时,λg到达了可见光波段范围。因此,复合光催化剂在日光灯的照射下也具有一定的光催化活性。
[1]WU Zhong-Biao(吴忠标),JIANG Xin(蒋新),ZHAO Wei-Rong(赵伟荣).Principle and Application of Environmental Catalysis(环境催化原理及应用).Beijing:Chemical Industry Press,2006.
[2]Herrmann J M.Catal.Today,1999,53:115-129
[3]Zhang Z B,Wang C C,Zakaria R,et al.J.Phys.Chem.B, 1998,102:10871-10878
[4]Kim K D,Kim H T.J.Eur.Ceram.Soc.,2003,23:833-838
[5]Dina F,John K,David A.J.Phys.Chem.,1989,93:5851-5854
[6]Dekany I,Nagy L,Turi L,et al.Langmuir,1996,12:3709-3715
[7]WANG Ting(王挺),JIANG Xin(蒋新),HUANG Huan-Cong (黄焕聪).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao), 2010,26(7):1153-1158
[8]WANG Ting(王挺),JIANG Xin(蒋新),WANG You-Wen (王幼文).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2003,24(11):1929-1932
[9]Jiang X,Wang T.J.Am.Ceram.Soc.,2008,91:46-50
[10]Jiang X,Wang T.Environ.Sci.Technol.,2007,41:4441-4446
[11]Wang T,Jiang X,Wu Y X.Ind.Eng.Chem.Res.,2009,48: 6224-6228
[12]Wang T,Jiang X,Wu Y.X.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2008,24(5):817-822
[13]GAO Lian(高濂),ZHENG Shan(郑珊),ZHANG Qing-Hong (张 青 红 ).Nano-titanium Dioxide Photocatalysts and Application(纳米氧化钛光催化材料及应用).Beijing: Chemical Industry Press,2003.
[14]Hoffmann M R,Martin S T,Choi W,Bahneman D W.Chem.Rev.,1995,95:69-96
[15]Subramanian V,Wolf E E,Kamat V P.J.Am.Chem.Soc., 2004,126:4943-4950
[16]Vogel R,Hoyer P,Weller H.J.Phys.Chem.,1994,98:3183-3188
[17]Yu J G,Xiang Q J,Zhou M H.Appl.Catal.B,2009,90: 595-602
[18]Fujii H,Ohtaki M,Eguchi K,Arai H.J.Mater.Sci.Lett., 1997,16:1086-1088
[19]Pal B,Sharon M,Nogami G.Mater.Chem.Phys.,1999,59: 254-261
[20]Zhou W,Fu H G,Pan K,et al.J.Phys.Chem.C,2008,112: 19584-19589
[21]Dong F,Zhao W R,Wu Z B.Nanotechnology,2008,19: 365607(10pp)
[22]Zhu J F,Zheng W,He B,et al.J.Mol.Catal.A,2004,216: 35-43
[23]Zhou M H,Yu J G,Cheng B.J.Hazard.Mater.,2006,137: 1838-1847
[24]Zhou M H,Yu J G,Cheng B,et al.Mater.Chem.Phys., 2005,93:159-163
[25]Zhu J F,Chen F,Zhang J L,et al.J.Photochem.Photobiol. A,2006,180:196-204
Influence of Fe2O3Doping on Morphology and Photocatalytic Activity of TiO2Prepared by Adsorption Phase Synthesis
WANG Ting1WU Li-Guang*,1JIANG Xin2
(1College of Environmental Science and Engineering,Zhejiang Gongshang University,Hangzhou,310012,China)
(2Department of Chemical Engineering,Zhejiang University,Hangzhou 310027,China)
TiO2photocatalysts doped with Fe2O3were prepared by adsorption phase synthesis (APS).The influence of Fe2O3concentration on morphology and crystallization of TiO2was explored by TEM,UV-Vis and XRD.The activities of these photocatalysts were evaluated by photodegradation of methyl-orange irradiated under three wavelengths of light.The results suggest that the distribution of Fe2O3in composite photocatalysts is homogeneous.Red shifts appear in UV-Vis absorpion of TiO2after Fe2O3doping and the red shift becomes obvious with increasing,in concentration of Fe2O3,thus leading to decrease in the band gap of composite photocatalysts.Due to the entry of amorphous Fe2O3or Fe3+into lattice structure of TiO2,the crystallization of TiO2is restricted.Both the decrease of band gap and the restriction on TiO2doped with Fe2O3would depress the activity of photocatalysts when irradiated at two wavelengths of UV light.However,Fe2O3doping also leads to a certain activity of photocatalysts under visible light.
adsorption phase synthesis;doping of Fe2O3;TiO2;photodegradation;methyl-orange
O643.36;O614.41+1;O614.81+1;TQ03
A
1001-4861(2011)08-1477-06
2011-02-09。收修改稿日期:2011-04-29。
国家自然科学基金(No.20806071和20876144)资助项目。
*通讯联系人。E-mail:wulg64@hotmail.com

