环糊精及其衍生物对普鲁兰酶抑制机理的研究
于 博,张焕新,金征宇,*,徐学明,谢正军
(1.江南大学食品科学与技术国家重点实验室,江南大学食品学院,江苏无锡214122; 2.江苏畜牧兽医职业技术学院食品科技系,江苏泰州225300)
环糊精及其衍生物对普鲁兰酶抑制机理的研究
于 博1,张焕新2,金征宇1,*,徐学明1,谢正军1
(1.江南大学食品科学与技术国家重点实验室,江南大学食品学院,江苏无锡214122; 2.江苏畜牧兽医职业技术学院食品科技系,江苏泰州225300)
通过研究不同条件下环糊精抑制普鲁兰酶活性的差异,探讨其对普鲁兰酶抑制的机理。结果表明,疏水性空腔对芳香族氨基酸的包合作用是环糊精与普鲁兰酶相互作用的内在因素,空腔大小、侧链基团、浓度、pH与温度都明显地影响了环糊精与普鲁兰酶的相互作用。同时考察了不同环糊精浓度下的普鲁兰酶内源性荧光光谱,分析了环糊精对普鲁兰酶结构与微环境的影响。
环糊精,普鲁兰酶,疏水性空腔,芳香族氨基酸残基,荧光光谱
1 材料与方法
1.1 材料与仪器
α-环糊精(α-CD)、β-环糊精(β-CD)、γ-环糊精(γ-CD)、葡萄糖基-β-环糊精(G1-β-CD)和麦芽糖基-β-环糊精(G2-β-CD)sigma公司;普鲁兰酶 无锡杰能科生物有限公司;其他试剂 国产分析纯。
V-1800分光光度计 上海美普达公司;AB135-S型电子分析天平、Delta320 pH计 梅特勒-托利多仪器有限公司;HH-2型恒温水浴锅 金坛市荣华仪器制造有限公司;F-7000荧光光谱仪 日本Hitachi公司。
1.2 实验方法
1.2.1 普鲁兰酶活性的测定 在0.5mL,1%的普鲁兰溶液中加入0.5mL适当稀释的普鲁兰酶溶液,反应体系为pH的乙酸缓冲液,50℃反应30min,采用DNS法测定还原糖的生产量,一个酶活力单位定义为每分钟分解普鲁兰多糖生成相当于1μmol葡萄糖的酶量。相对剩余酶活力(RRA)定义为添加环糊精及其衍生物时的酶活力与空白酶活力之比。普鲁兰酶使用前经过实验室进一步纯化。
1.2.2 荧光光谱测定 普鲁兰酶的荧光光谱用Hitachi F-7000荧光光谱仪测定,激发波长选择295nm,发射波长为200~400nm,激发和发射波长狭缝宽度设定为5nm,扫描速度为12000nm/min,室温下测定荧光光谱。
2 结果与讨论
2.1 环糊精种类对环糊精抑制普鲁兰酶活性的影响
由图1可知,在普鲁兰酶水解体系中加入各种环糊精后,普鲁兰酶的水解活性都受到了明显的抑制。β-环糊精及其衍生物对普鲁兰酶的活性抑制明显强于α-环糊精和γ-环糊精,由于环糊精与酶的相互作用与环糊精特有疏水性空腔有关,因此环糊精的空腔与普鲁兰酶分子是否匹配决定了其对酶活性的影响能力。三种常见的环糊精α-环糊精、β-环糊精和γ-环糊精的疏水性空腔直径分别为0.47~0.53nm、0.6~0.65nm和0.75~0.83nm,其空腔外部圆周直径以及空腔高度也各不相同,这些因素都影响到了环糊精分子与酶分子相互作用。由图1可知,α-环糊精、β-环糊精和γ-环糊精加入后,普鲁兰酶的活性分别下降了约10%、90%和20%。这表明,β-环糊精分子具有更容易进入酶分子空间的几何尺寸,其疏水性空腔更加适合与酶分子的芳香族氨基酸发生包合作用。当β-环糊精接枝上分支糖基后,其对普鲁兰酶的抑制能力发生了明显的变化。由图1可知,β-环糊精、葡萄糖基-β-环糊精和麦芽糖基-β-环糊精精加入后,普鲁兰酶的活性分别下降了约90%、70%和50%。随着分支侧链的延长,环糊精抑制酶活性的能力递减。这主要是因为分支侧链通过α-1,6糖苷键接枝到母体β-环糊精后,增加了环糊精疏水性空腔与普鲁兰酶作用位点的空间位阻,而且分支链长的增加不仅会增加空间位阻,更会影响到母体环糊精疏水性空腔固有的几何尺寸与极性。根据实验结果可知,β-环糊精对普鲁兰酶的抑制作用最强。为进一步了解环糊精与普鲁兰酶相互作用的影响因素,下面的实验主要考察不同条件下β-环糊精对普鲁兰酶活性的影响。

图1 环糊精种类对环糊精抑制普鲁兰酶活性的影响
2.2 环糊精浓度对环糊精抑制普鲁兰酶活性的影响
在普鲁兰酶的水解体系中,分别添加不同浓度的β-环糊精,考察普鲁兰酶活性与β-环糊精浓度间的相关性。由图2可知,随着β-环糊精浓度的增加,普鲁兰酶的活性呈下降的趋势。在环糊精浓度达到1mmol/L后,普鲁兰酶的失活速率增加;当环糊精浓度达到10mmol/L时,普鲁兰酶的剩余酶活不足33%。这表明β-环糊精与普鲁兰酶的相互作用具有浓度依赖效应,低浓度时,β-环糊精与普鲁兰酶分子的相互作用并没有引起酶分子的活性构象的变化;随着β-环糊精浓度的增加,与普鲁兰酶分子相互作用的疏水性空腔增加,致使酶分子的活性构象发生扭曲,酶活性逐渐丧失。
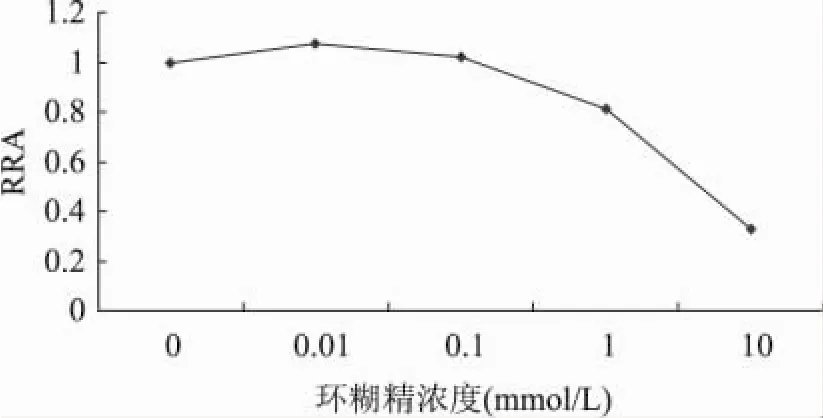
图2 环糊精浓度对环糊精抑制普鲁兰酶活性的影响
2.3 pH对环糊精抑制普鲁兰酶活性的影响
由图3可知,pH对环糊精抑制普鲁兰酶活性的影响呈先增强后降低的趋势,在pH4~6范围内,环糊精对普鲁兰酶抑制作用最强,当pH为5时,普鲁兰酶的剩余酶活降至13%左右。pH的变化不仅会改变酶分子活性中心的必需基团的解离程度,而且会影响酶分子的构象变化。因此,pH4~6时的普鲁兰酶分子更适合与环糊精发生相互作用。这也说明,环糊精与普鲁兰酶的相互作用,不仅与环糊精自身的疏水性空腔有关,还与酶分子自身的性质有关。
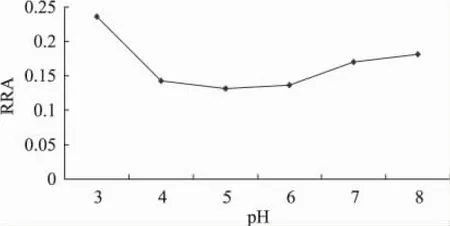
图3 pH对环糊精抑制普鲁兰酶活性的影响
2.4 温度对环糊精抑制普鲁兰酶活性的影响
由图4可知,温度对环糊精抑制普鲁兰酶活性的影响呈先增强后降低的趋势,当温度达到60℃时,普鲁兰酶的剩余酶活降至约11%。温度的变化同样影响了酶自身的构象变化,因而影响了酶与环糊精疏水性空腔的相互作用。当温度升高时,酶分子间的聚集比低温下变得松散,有利于环糊精分子进入到酶分子中,从而与更多的疏水性氨基酸发生复合作用,导致酶活性构象的丧失。
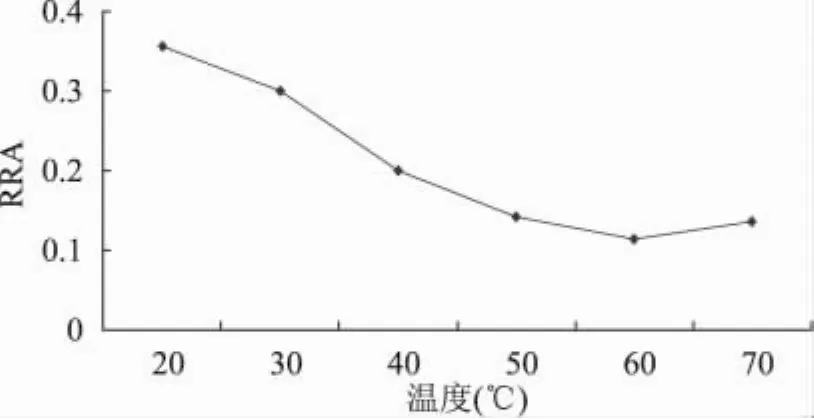
图4 温度对环糊精抑制普鲁兰酶活性的影响
2.5 环糊精对普鲁兰酶微环境与结构的影响
大部分的酶分子中都含有芳香族氨基酸如色氨酸、酪氨酸和苯丙氨酸,而这三类氨基酸因侧链生色基团的不同而具有不同的荧光特性。其中色氨酸的荧光强度最大,酪氨酸次之,苯丙氨酸最小。在酶构象的研究中,常常根据芳香族氨基酸的荧光特性来推测酶分子的构象以及微环境变化。由于色氨酸残基对微环境变化敏感,因此色氨酸残基常作为酶分子的内源性荧光探针来研究不同条件下酶分子构象和微环境变化的信息。由图5可知,在295nm激发波长下,普鲁兰酶的最大发射波长在340nm处。随着β-环糊精浓度的不断增加,荧光强度明显增强。这主要是由于随着环糊精的加入,疏水性空腔逐渐增加,其与普鲁兰酶分子的芳香族氨基酸残基之间的包合作用不断增加,一方面保护了荧光体的单重态,避免了溶液中如氧自由基的猝灭,并束缚分子自由度,增大其辐射速率;另一方面,环糊精的疏水性空腔提供一个更加非极性的微环境,增强了荧光量子效率。这也进一步证明了疏水性空腔与芳香族氨基酸残基之间的包合作用是环糊精抑制普鲁兰酶活性的内在驱动力。从图5还可以看到,随着环糊精浓度的增加,发射光谱发生了蓝移,最大波长由340nm蓝移至337nm,这表明环糊精的加入改变了普鲁兰酶分子的结构和微环境。酶分子致密的结构逐渐变得松散,先前埋藏在酶分子内部的一部分色氨酸残基暴露在一个更加非极性的环糊精中,酶分子活性所处微环境的疏水性增加,活性构象发生改变,从而导致普鲁兰酶的活性降低。

图5 环糊精对普鲁兰酶内源性荧光的影响
3 结论
本实验通过考察不同条件下环糊精对普鲁兰酶活性的影响。研究发现,疏水性空腔是环糊精及其衍生物与普鲁兰酶相互作用的内在因素。疏水性空腔与普鲁兰酶的芳香族氨基酸残基形成了复合物,改变了普鲁兰酶本身的活性构象,导致了普鲁兰酶的失活。环糊精疏水性空腔的几何尺寸是环糊精与普鲁兰酶相互作用的重要影响因素,其决定了二者相互匹配的效率。体系的pH与温度影响了普鲁兰酶与环糊精的相互作用,其主要是由于酶自身结构随pH与温度变化而变化,导致了环糊精与普鲁兰酶结合位点的改变。环糊精衍生物中,侧链基团的引入增加了空间位阻,降低了环糊精疏水性空腔与普鲁兰酶的结合率。
[1]金征宇,徐学明,陈寒青,等.环糊精化学—制备与应用[M].北京:化学工业出版社,2009:1-3.
[2]HAMILTON L M,KELLY C T,FOGARTY W M.Review: cyclodextrins and their interaction with amylolytic enzymes[J]. Enzyme Microb Tech,2000,26(8):561-567.
[3]PINOTSIS N,LEONIDAS D D,CHRYSINA E D,et al.The binding of β-and γ-cyclodextrins to glycogen phosphorylase b: kinetic and crystallographic studies[J].Protein Sci,2003,12(9): 1914-1924.
[4]HARPER J B,EASTON C J,LINCOLN S F.Cyclodextrins to increase the utility of enzymes in organic synthesis[J].Curr Org Chem,2000,4(4):429-454.
[5]EASTON C J,HARPER J B,HEAD S J,et al.Cyclodextrins to limit substrate inhibition and alter substrate selectivity displayed by enzymes[J].J Chem Soc Pakistan,2001,1(6):584-587.
[6]LÓPEZ-NICOLÁS J M,NU'NˇEZ-DELICADO E,PÉREZLÓPEZ A J,et al.Reaction’s mechanism of fresh apple juice enzymatic browning in the presence of maltosyl-β-cyclodextrin[J].J Incl Phenom Macrocycl Chem,2007,57(1-4):219-222.
[7]LÓPEZ-NICOLÁS J M,PÉREZ-LÓPEZ A J,CARBONELL -BARRACHINA,et al.Kinetic study of the activation of banana juice enzymatic browning by the addition of maltosyl-βcyclodextrin[J].J Agric Food Chem,2007,55(23):9655-9662.
[8]LÓPEZ-NICOLÁS J M,NU'NˇEZ-DELICADO E,SÁNCHEZFERRER Á,et al.Kinetic model of apple juice enzymatic browning in the presence of cyclodextrins:the use of maltosyl-βcyclodextrin as secondary antioxidant[J].Food Chem,2007,101 (3):1164-1171.
[9]尤新.淀粉糖品生产与应用手册[M].北京:中国轻工业出版社,2010:21-22.
[10]王建一,林松毅,张旺,等.玉米葡萄糖全糖粉制备过程中的糖化及脱色技术研究[J].食品科学,2008,29(10): 263-266.
[11]MARSHALL J J.Inhibition of pullulanase by Schardinger dextrins[J].FEBS Lett,1973,37(2):269-273.
[12]IWAMOTO H,OHMORI M,OHNO M,et al.Interaction between pullulanase from Klebsiella pneumoniae and cyclodextrins[J].J Biochem,1993,113(1):93-96.
[13]IWAMOTO H,OHMORI M,OHNO M,et al.Comparison of the binding of β-CD with pullulanase from Klebsiella pneumoniae as studied by equilibrium and kinetic fluorometry[J].J Biochem,1994,116(6):1264-1268.
Insight into inhibition mechanism of cyclodextrin and its derivatives on pullulanase
YU Bo1,ZHANG Huan-xin2,JIN Zheng-yu1,*,XU Xue-ming1,XIE Zheng-jun1
(1.State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Food Science Department,Jiangsu Animal Husbandry and Veterinary College,Taizhou 225300,China)
Effects of different cyclodextrins on the activity of pullulanase were investigated to explore the inhibition mechanism of cyclodextrin on pullulanase in this work.The results indicated that the interaction between β-CD and pullulanase molecules was due to the formation of inclusion complexes between hydrophobic cavities and aromatic amino acid residues of pullulanase and was influenced by geometric dimension of hydrophobic cavities,side chain groups of cyclodextrin,concentration,pH and temperature.Meanwhile,the effect of cyclodextrin on the structure and microenvironment of pullulanase was analyzed by the intrinsic fluorescence spectroscopy.
cyclodextrin;pullulanase;hydrophobic cavities;aromatic amino acid residues; fluorescence spectroscopy
TS201.2+3
A
1002-0306(2011)03-0109-04
环糊精(Cyclodextrins,CDs)是由环糊精葡萄糖基转移酶(Cyclodextrin glycosyltransferase,CGTase)作用于淀粉而生成的一类环状低聚糖,其具有一个环外亲水、环内疏水且有一定尺寸的立体手性空腔结构,能与极性相似、分子大小匹配的不同类型客体分子形成主客体复合物[1]。在很多生物反应中,环糊精可以与底物或催化反应的酶分子基团形成复合物,从而影响反应速率或反应平衡[2-3]。在一些生物反应中,环糊精通过增溶反应底物或激活酶加快反应速率[4-5];而在另一些反应中,环糊精会成为酶反应的抑制剂[6-8]。生物大分子复合物是近年来研究的热点,随着酶与有机小分子之间的相互作用的研究日益深入,环糊精作为酶反应的激活剂或抑制剂,其作用机制亟需进一步深入研究。普鲁兰酶(Pullulanase,E.C.3.2.1.41)是淀粉酶家族的一个重要成员,其在食品工业尤其是高葡萄糖浆、超高麦芽糖浆、啤酒发酵以及淀粉改性等领域应用广泛。它能专一性水解α-1,6糖苷键,并可以将最小单位的支链分解,最大限度地利用具有分支的淀粉原料[9-10]。研究发现,在普鲁兰酶的水解体系中,β-环糊精的加入会使普鲁兰酶的活性大大降低[11],而且动力学实验证明β-环糊精是普鲁兰酶的竞争性抑制剂[12-13]。但是,环糊精抑制普鲁兰酶活性的机制仍不清楚,其相互作用的影响因素也需要进一步的探索。因此,本实验主要通过研究不同条件下环糊精对普鲁兰酶活性的影响规律,探讨环糊精对普鲁兰酶抑制的机理。
2010-11-17 *通讯联系人
于博(1981-),男,博士,研究方向:碳水化合物。
国际科技合作计划(2007DFA31120);江苏省自然科学基金创新学者攀登项目(BK2008003)。

