恶性实体瘤患者自体CIK细胞的体外大量扩增后的免疫表型变化
张 静,李永萍,张荣生,李雪梅
(大理学院附属医院,云南大理 671000)
恶性实体瘤患者自体CIK细胞的体外大量扩增后的免疫表型变化
张 静,李永萍,张荣生,李雪梅
(大理学院附属医院,云南大理 671000)
目的:回顾性分析我院2009年1月至2010年5月行细胞因子诱导的杀伤细胞(CIK)治疗的59例实体瘤患者的自体CIK细胞体外扩增后免疫表型的变化,为恶性实体瘤患者开展CIK细胞治疗提供实验依据。方法:采集59例恶性实体瘤患者外周血单个核细胞,培养体系加入IFN-γ、CD3McAb及IL-2三种细胞因子体外诱导,培养10~14 d;用流式细胞仪分别检测CIK细胞培养前后的免疫表型,进行配对t检验。结果:CIK细胞培养后单个核细胞,CD3+细胞,CD3+CD4+细胞,CD3-CD56+细胞,CD3+CD56+细胞均较培养前增加,差异有统计学意义(P<0.05)。CD3+CD8+细胞,虽然较前增加,但差异无统计学意义(P>0.05),CIK细胞中CD3+,CD3+CD4+,CD3+CD8+,CD3-CD56+表型的细胞比率与培养前相比均有所下降,差异有统计学意义(P<0.05),但CD3+CD8+细胞比率与培养前差异无统计学意义(P>0.05)。而CIK细胞的纯度从培养前(9.90±8.96)%增至(46.55± 19.25%),差异有统计学意义(P<0.05)。结论:恶性实体瘤患者自体CIK细胞体外扩增后,CIK细胞纯度显著增加。
恶性实体瘤;CIK细胞;免疫表型
细胞因子诱导的杀伤细胞(Cytokine-induced killer,CIK)是人外周血单个核细胞在体外经抗CD3单克隆抗体、干扰素γ(IFN-r)、白细胞介素L-2,重组白细胞介素-2(rhIL-2)等多种细胞因子刺激后获得的一群异质细胞,其具有“增殖速度快、杀瘤活性高、杀瘤谱广、对多重耐药肿瘤敏感、不受免疫抑制剂的影响、对正常骨髓造血毒性小”等优势〔1〕,目前在临床上广泛用于肿瘤的过继免疫治疗。我院从2009年11月开始开展CIK细胞治疗肿瘤。本文就我院2009年11月至2010年5月行CIK治疗的59例术后和晚期实体瘤患者的自体CIK细胞扩增后免疫表型的变化进行总结,以期为恶性实体瘤患者开展CIK细胞治疗提供更完整的实验依据。
1 材料与方法
1.1 病例选择 行CIK治疗的实体瘤患者59例。分别为肝癌14例,甲状腺癌3例,肾癌1例,肺癌11例,胃癌4例,结直肠癌14例,食道癌2例,胆囊癌1例,胰腺癌1例,乳腺癌1例,宫颈癌1例,甲状腺癌3例,纤维肉瘤1例,恶性黑色素瘤1例,脑胶质瘤1例。
1.2 CIK细胞扩增〔2〕根据文献〔2〕方法,略作调整。血细胞分离机封闭式管道采集单个核细胞,无血清RPMI1640培养基调整细胞数为1×106个/mL,第1天加入IFN-γ(1 000 U/mL),培养24 h后加入rhIL-2(300 U/mL),CD3单抗(75 μg/mL)继续培养,每隔4 d更换培养基,调整细胞数为1×106个/ mL,补加rhIL-2(300 U/mL),每8 h在补加rhIL-2的同时补加CD3单抗(350 ng/mL),10~14 d开始收集CIK细胞。
1.3 免疫表型鉴定 调节PBMC或CIK细胞浓度为5×105/L,加入异硫氰酸荧光素标记单克隆抗体(抗CD3,CD4,CD8,CD56)上流式细胞仪检测。
表1 CIK细胞培养前后细胞数量的变化(±s)
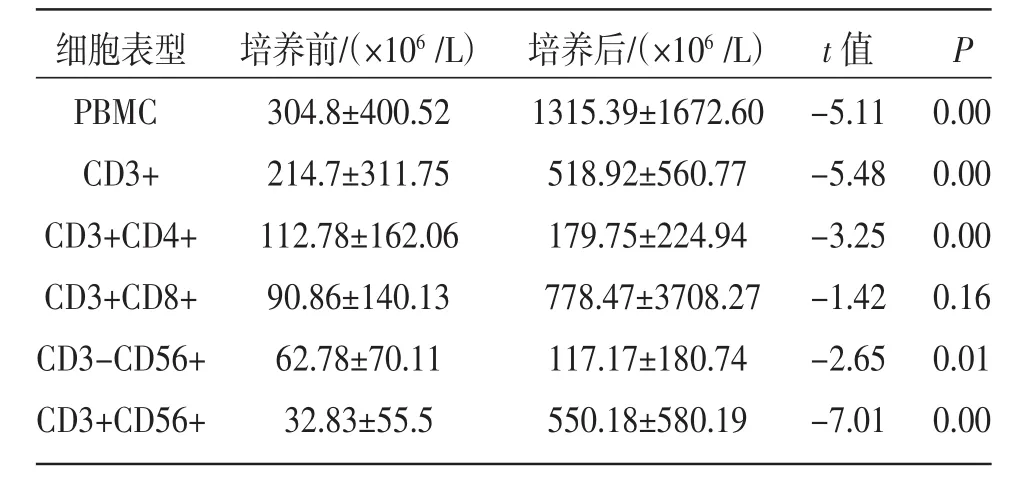
表1 CIK细胞培养前后细胞数量的变化(±s)
细胞表型PBMC CD3+ CD3+CD4+ CD3+CD8+ CD3-CD56+ CD3+CD56+培养前(/×106/L)304.8±400.52 214.7±311.75 112.78±162.06 90.86±140.13 62.78±70.11 32.83±55.5培养后(/×106/L)1315.39±1672.60 518.92±560.77 179.75±224.94 778.47±3708.27 117.17±180.74 550.18±580.19 t值P -5.11 -5.48 -3.25 -1.42 -2.65 -7.01 0.00 0.00 0.00 0.16 0.01 0.00
表2 CIK细胞培养前后免疫表型变化(±s)
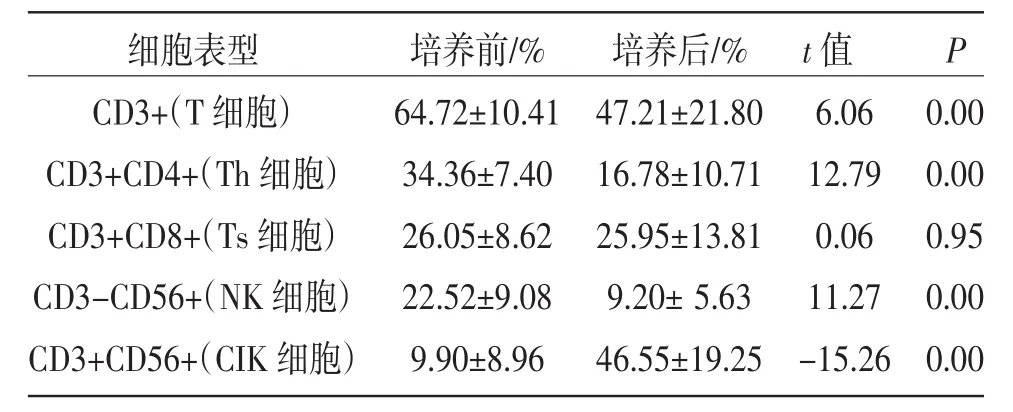
表2 CIK细胞培养前后免疫表型变化(±s)
细胞表型CD3+(T细胞)CD3+CD4+(Th细胞)CD3+CD8+(Ts细胞)CD3-CD56+(NK细胞)CD3+CD56+(CIK细胞)培养前/% 64.72±10.41 34.36±7.40 26.05±8.62 22.52±9.08 9.90±8.96培养后/% 47.21±21.80 16.78±10.71 25.95±13.81 9.20±5.63 46.55±19.25 t值P 6.06 12.79 0.06 11.27 -15.26 0.00 0.00 0.95 0.00 0.00
2 结果
2.1 CIK细胞扩增 由表1可见经10~14 d培养后单个核细胞,CD3+细胞,CD3+CD4+细胞,CD3-CD56+细胞,CD3+CD56+细胞均较培养前增加,差异有统计学意义(P<0.05)。CD3+CD8+细胞,虽然较培养前扩增,但差异无统计学意义(P=0.16)。
2.2 CIK细胞免疫表型变化 比较单个核细胞(PBMC)和自体CIK细胞免疫表型(见表2),可见CIK细胞中CD3+,CD3+CD4+,CD3+CD8+,CD3-CD56+表型的细胞与培养前相比均有所下降,差异有统计学意义(P<0.05),但CD3+CD8+细胞与培养前差异无统计学意义(P=0.95)。而CIK细胞的纯度从培养前(9.90±8.96)%增至(46.55±19.25)%(CIK细胞的纯度指流式细胞分析时CD3+CD56+细胞所占的百分数),差异有统计学意义。
3 讨论
过继性免疫治疗是肿瘤生物治疗的一种,在肿瘤综合治疗中有很重要的作用。继淋巴因子激活杀伤细胞(LAK)、浸润肿瘤淋巴细胞(TIL)及CD3单抗激活的杀伤细胞(CD3AK)后,1991年,斯坦福大学的Schmidt-Wolf〔1〕等首先报道了一类由多种细胞因子诱导的杀伤细胞,即细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK)。CIK细胞能大量地扩增,比LAK细胞具有更强的肿瘤杀伤活性,CIK细胞的杀瘤作用日益受到重视。
目前认为CD3+CD56+细胞是CIK细胞中的主要效应细胞,CD3+CD56+细胞的增加预示CIK细胞抗肿瘤能力增强〔3〕。潘春华等〔4〕报道经IFN-γ、CD3McAb及IL-2三种细胞因子体外诱导健康人单个核细胞培养20 d,CIK细胞的纯度为(36.36± 4.6)%;张国庆等〔5〕观察了23例恶性肿瘤患者外周血单个核细胞在体外经扩增后,CIK细胞的纯度由扩增前的(3.77±1.92)%增加到扩增后的(33.67± 18.04)%。国内有学者〔6-7〕观察细胞培养时间与CIK细胞表达的关系,结果显示,在14~21 d呈高表达的平台期。提示此期间CIK细胞具有较强的抗肿瘤能力,进行临床应用可取得较好的疗效。本研究进一步表明:恶性实体瘤患者自体CIK细胞经IFN-γ、CD3McAb及IL-2三种细胞因子体外诱导,培养10~14 d,细胞数量明显增多,CIK细胞的纯度显著增加。这与其他学者的报道基本一致。
〔1〕Schmidt-Wolf I G,Negrin R S,Kiem HP,et al.Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity〔J〕.J Exp Med,1991,174(1):139-149.
〔2〕朱建平,徐鸣,汝美华.CIK细胞临床应用技术规范探讨〔J〕.中国医药生物技术,2007,2(2):148-150.
〔3〕Schmidt-Wolf I G,Lefterova P,Mehta B A,et al.Phenotypic characterization and identification of effector cells involved in tumor cell recognition of cytokine-induced killer cells〔J〕.Exp Hematol,1993,21(13):1673-1679.
〔4〕潘春华,罗荣城.CIK细胞的表型分析及生物学活性研究〔J〕.解放军医学杂志,2003,28(11):1030-1032.
〔5〕张国庆,焦顺昌,林星石,等.恶性肿瘤患者外周血淋巴细胞体外扩增后亚群的变化〔J〕.军医进修学院学报,2008,29(3):184-186.
〔6〕康自珍,蔡海波,雷俊英,等.体外大量扩增CIK细胞的研究〔J〕.细胞与分子免疫学杂志,2002,18(5):493-495.
〔7〕吴昌平,蒋敬庭,邓海峰,等.CIK细胞体外培养的免疫表型〔J〕.江苏医药,2005,31(9):644-646.
Immunophenotype Changes of Auto-Cytokine Induced Killer Cells from Patients with Malignant Solid Tumor after Amplification in Vitro
ZHANG Jing,LI Yongping,ZHANG Rongsheng,LI Xuemei
(Affiliated Hospital of Dali University,Dali,Yunnan 671000,China)
Objective:To retrospectively analyze the changes of immunophenotyping of auto-cytokine induced killer cells from 59 patients with malignant solid tumor after amplification from January 2009 to May 2010,and to provide experimental evidence to CIK therapy for malignant solid tumor patients.Methods:Peripheral blood mononuclear cells(PBMC)of 59 patients with malignant solid tumor were collected.PBMC were cultivated for 10-14 days in vitro with traditional cultivating system added IFN-γ,CD3McAb and IL-2.Then,immunophenotype changes of CIK cells before and after culture were measured with flow cytometry(FCM).The results then were conducted with matched t test.Results:After cultured,the PBMC,CD3+cells,CD3+CD4+cells,CD3-CD56+cells, CD3+CD56+cells increased significantly compared with that of before(P<0.05).CD3+CD8+cells showed slight but not significant increase(P>0.05).The percentage of CD3+,CD3+CD4+,CD3-CD56+phenotype cells declined with statistical significance(P<0.05),while the percentage of CD3+CD8+cells had no significant difference(P>0.05).The purity of CIK cells after being cultured(46.55±19.25)%was significantly higher(9.90±8.96)%.Conclusion:The purity of CIK cells from patients with malignant solid tumor increased significantly after amplification in vitro.
cytokineInduced killer cells;malignant solid tumor;immunophenotype
R73-36+1[文献标志码]A[文章编号]1672-2345(2011)08-0039-02
2011-03-22
张静,主治医师,主要从事肿瘤生物治疗研究.
(责任编辑 张 焕)

