PTSD促进大鼠中缝背核细胞色素c表达
罗斐斐喻 博韩 芳*石玉秀
(1中国医科大学基础医学院病理与病理生理学研究所,沈阳110001;2中国医科大学基础医学院组织学与胚胎学教研室,沈阳110001;3中国医科大学附属盛京医院神经外科,沈阳 110004)
PTSD促进大鼠中缝背核细胞色素c表达
罗斐斐1,2喻 博3韩 芳1,2*石玉秀1,2
(1中国医科大学基础医学院病理与病理生理学研究所,沈阳110001;2中国医科大学基础医学院组织学与胚胎学教研室,沈阳110001;3中国医科大学附属盛京医院神经外科,沈阳 110004)
目的 研究创伤后应激障碍(PTSD)大鼠中缝背核神经元细胞色素C(Cyt-c)的表达变化。方法 应用无连续单一刺激(SPS)方法建立PTSD大鼠模型,随机分为SPS刺激后1d、4d、7d和对照组,应用酶组织化学法和RT-PCR方法观察中缝背核神经元Cyt-c的表达变化。结果 光镜酶细胞化学法和RT-PCR法显示中缝背核神经元Cyt-c染色阳性细胞于SPS刺激后1d明显高于对照组,4d逐渐增高,并于7d达到高峰。电镜下显示Cyt-c阳性反应产物主要分布在中缝背核神经元线粒体膜,SPS刺激后可见Cyt-c释放到胞浆中。结论 SPS刺激引起Cyt-c在PTSD大鼠中缝背核神经元呈过表达。
创伤后应激障碍; 中缝背核; 细胞色素C; 酶组织化学; RT-PCR
创伤后应激障碍(posttraumatic stress disorder,PTSD)是指由于异常威胁性或灾难性心理创伤延迟出现和长期持续的精神障碍,其临床表现以再度体验创伤为特征,并伴有情绪的易激惹和回避行为[1],其生物学机制主要包括以下三个方面:皮质类固醇激素受体功能下调,去甲肾上腺素能及加压素能系统的兴奋,以及5-HT能系统的缺陷[2]。5-HT能阳性细胞广泛分布于中缝核各部,尤以中缝背核部位密集[3],因此中缝背核可能在 PTSD的发病中起重要作用。
中缝背核(dorsal raphe nucleus,DRN)位于脑桥上部向上至中脑动眼神经核尾侧部,在中央灰质的腹侧。目前有报道表明:PTSD患者存在脑桥体积的缩小及灰质密度的减少[4]。为此,本文旨在研究中缝背核神经元线粒体凋亡途径的关键点-细胞色素C(cytochrome c,Cyt-c)的表达变化,以揭示PTSD后脑桥体积的缩小及灰质密度的减少是否由于存在中缝背核神经元的凋亡。
以往,由于缺乏理想的动物模型,使 PTSD的基础研究受到了很大限制。SPS模型[9]作为PTSD动物模型的确认,为深入研究应激障碍的发病机制提供了行之有效的方法。本实验即采用国际公认的SPS模型作为PTSD动物实验的模型。
材料和方法
1.实验动物及大鼠模型的建立
用6周-7周龄雄性Wistar大鼠(中国医科大学实验动物中心提供)40只,实验起始体重(180±20)g,12h光亮/黑暗条件、22℃-25℃环境温度,分隔喂养,食物和水可自由摄取;随机分为4组,即连续单一刺激(single prolonged stress,SPS)的 1d、4d、7d组及正常对照组。
PTSD样大鼠模型的建立:采用日本文部省召开的“基础和临床的研究进展”的会议[9]确定的关于PTSD模型SPS刺激后无干扰喂养的方法。SPS刺激是指将大鼠连续进行下述步骤处理,即:大鼠禁锢2后,立即强迫游泳20min(水深40cm,水温25℃)。经过15min的恢复,乙醚麻醉至意识丧失,在笼子中不再给予任何刺激,常规饲养直至取材。
2.Cyt-c酶组织化学染色
灌流取材:分别取SPS 1d、4d、7d及正常对照组大鼠进行灌流固定。大鼠经2%戊巴比妥腹腔注射麻醉后,暴露心脏,左心室插管,剪开右心耳,先以生理盐水 300ml快速灌冲,再灌注 0.25%戊二醛与2%多聚甲醛的混合液(0.01mol/L PBS配制)进行固定,取出中缝背核组织,并浸人同种固定液中继续固定 1h,然后浸于 Holt’液(30%蔗糖,0.1mol/L PBS配制)中至沉瓶底。于恒冷箱冰冻切片机中行冠状切片,片厚14μm,实验前,切片用梯度递减蔗糖缓冲液脱糖。
孵育液的配制:采用 Seligman法配制,细胞色素C 10mg;过氧化氢酶 1mg;0.2mol/L PBS 5ml;DAB[5]10mg;蒸馏水 5ml。
酶组织化学染色:将各组切片分别置于上述孵育液中,37℃振动恒温水浴箱中孵育1h,中间换一次液,孵育反应后,用双蒸水漂洗2-3次,充分洗净后甘油明胶封片,OL YMUPS光镜下镜检、摄片。
酶活性图像分析:使用LUZEXF计算机图像分析仪(日本)测Cyt-c的活性,进行定量分析。每组随机抽取切片8张,每张切片测3个视野,测量表示酶反应强度的积分光密度值。测定视野越亮,所测值越大,酶活性越小,反之,酶活性越大。最后,对所得数据进行统计学分析。
3.电镜酶化学术观察Cyt-c的释放
切片孵育后用二甲胂酸钠缓冲液漂洗,1%OsO44℃固定30-60 min,常规脱水,包埋,经半薄切片、超薄切片厚70μm,JEM1200EX透射电镜下观察。
4. RT-PCR 检测
将各组大鼠麻醉后断头取脑,分离中缝背核,加入1ml Trizol溶液(TaKaRa)裂解,按 Trizol试剂盒说明书提取总RNA。以DNA/RNA测定仪测定RNA的纯度和浓度。按逆转录合成试剂盒说明合成cDNA待用。β-actin作为内参照,目的片段为542bp,引物序列为 :5’-GTC ACCCACACTGTGCCCATC-3’( 上游);5’-ACAGAGTACTTGCGCTCAGCAG-3’(下游)。Cyt-c 的目的片段为 683bp,引物序列为 :5’-GCCTACCCATTCCA ACTTGGTC-3’( 上 游 );5 ’-AA TTA TTGAAGCAG ATCAGTTTTCG-3’(下游)。在自动电泳凝胶成像分析仪成像并分析。mRNA相对表达=样品扫描值/β-actin扫描值。
4.统计学处理
所得数据使用 SPSS13.0统计软件进行分析。计量资料用(±s)表示,采用ANOVA法进行统计分析,P<0.05表示具有统计学意义。
结 果
1.中缝背核Cyt-c阳性细胞的光镜变化
Cyt-c的反应产物为棕黄色颗粒,结果显示,于正常对照组(图1A)大鼠中缝背核神经元胞质内呈均匀分布,胞核反应阴性,细胞轮廓清晰可见。与正常对照组相比,SPS1d(图 1B)、4d(图 1C)、7d(图1D)的中缝背核神经元Cyt-c阳性细胞逐渐增多,光密度逐渐增强,因此Cyt-c的活性表达增强(表1),于SPS 7d时阳性细胞最多(图1D,P<0.05),Cyt-c阳性反应产物弥散分布于胞质中。
表1 不同时间点中缝背核Cyt-c表达情况(±s)Table 1 DRN Cyt-c expression at different time(IOD)(±s)

表1 不同时间点中缝背核Cyt-c表达情况(±s)Table 1 DRN Cyt-c expression at different time(IOD)(±s)
注:*与Cyt-c正常组比较(compared with Cyt-c control group)P<0.05。
组(Group) IOD Control 72.7380 ±5.9737 SPS1d 90.3020 ±9.1195*SPS4d 114.1500 ±9.7309*SPS7d 131.0900 ±9.1487*
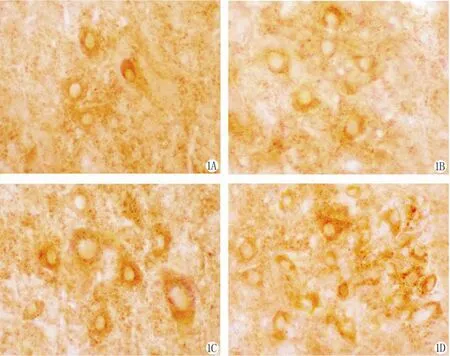
图1 PTSD大鼠不同时间点中缝背核Cyt-c的表达变化。×400Fig.1 DRN Cyt-c expression at different time in PTSD rats. ×400
2.透射电镜观察中缝背核神经元Cyt-c的变化
对照组中缝背核神经元线粒体形态结构保持良好,阳性产物主要分布在线粒体内(图2A)。SPS刺激后可见线粒体肿胀,空泡变形,嵴断裂,外膜破裂,Cyt-c阳性反应产物从线粒体内外膜释放到细胞浆中(图 2B)。
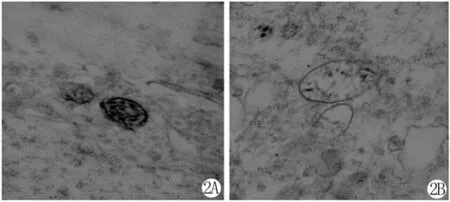
图2 中缝背核神经元线粒体的超微结构。2A:正常组,2B:SPS-7dFig.2 The ultramicrostructure ofmitochondria in DRN by TEM.2A:control group,2B:SPS-7d
3.RT-PCR结果
以β-actin(图3)作为内参照,Cyc-c在分子水平呈现对照组、SPS-1d组、SPS-4d组和 SPS-7d组表达逐渐增高,于SPS-7d达到高峰,并维持较高水平(表 2,图 3)。
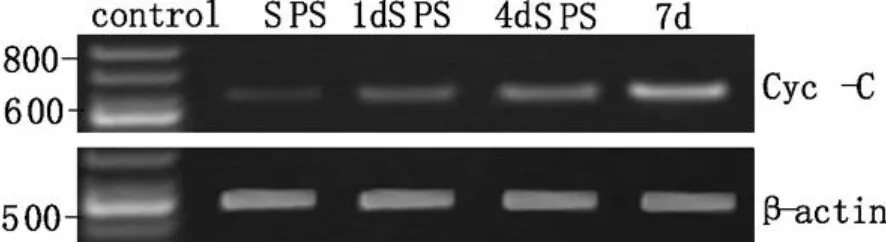
图3 PTSD大鼠不同时间点中缝背核β-actin和Cyt-c mRNA的表达变化Fig3.β-actin mRNA expression and Cyc-c mRNA expression in DRN of PTSD-like rats by RT-PCR
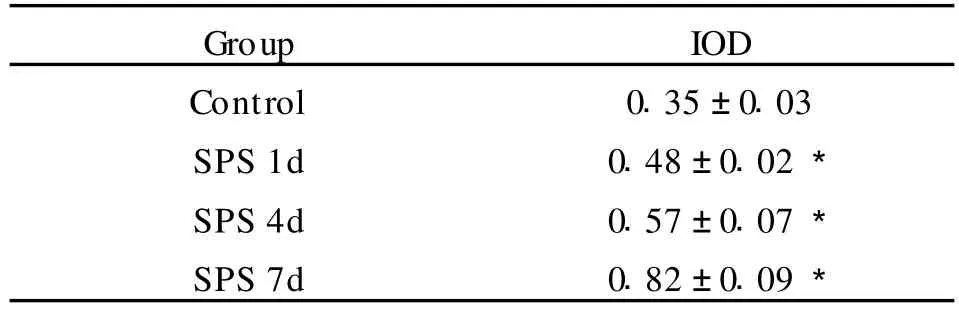
表2 模型组和对照组Cyc-c mRNA表达分析结果Table 2 Analysis of Cyc-c mRNA in the model group and control group
讨 论
近年来,随着战争、社会暴力事件、重大交通事故和自然灾害等创伤意外的不断增多,PTSD发病率越来越高,严重影响了患者生活质量和社会稳定。不同于一般的应激反应及其它精神疾病,PTSD以神经化学物质的改变为主要特点,主要包括血中糖皮质激素浓度异常低下和儿茶酚氨水平增高[6,7]。5-HT功能低下导致去甲肾上腺素能系统活性增高,从而出现 PTSD的警觉性增高、焦虑、惊跳反应[8]。中缝背核作为脑内5-HT能细胞的主要集中地,其功能失调在PTSD发生机制中发挥了重要作用。
线粒体呼吸链Cyt-c既参与线粒体能量代谢,释放到胞浆中又直接参与细胞凋亡的调节。大量实验研究发现Cyt-c从线粒体释放到细胞浆是多种细胞凋亡的共同表现,而Cyt-c基因敲除的细胞能对刺激因素诱导的凋亡具有明显的耐受性,Cyt-c是线粒体介导的细胞凋亡途径中不可缺少的重要因子,在凋亡过程中起着关键作用[10]。
本研究利用光电镜酶组织化学技术及RT-PCR方法,研究了PTSD大鼠SPS模型Cyc-c的表达变化,从结果表明Cyc-c的表达呈现1d,4d和7d逐渐升高的趋势,即在凋亡高峰出现Cyt-c的释放达到最多.电镜观察到SPS7d组,线粒体Cyt-c大量释放。Cyt-c释放到细胞浆中后与凋亡蛋白酶激活因子(Apaf-1)的梭基端WD-40重复序列结合,同时胞浆中的dATP和(或)A TP与Apaf-1的核苷酸结合结构域结合,从而促进Apaf-1构象变化并发生同源寡聚化。Apaf-1与procaspase-9结合而使procaspase-9募集。Cyt-c,dATP,Apaf-1和 procaspase-9组成聚合体,称为凋亡体(apoptosome)。凋亡体使procaspase-9激活,procaspase-9一旦激活就能激活其下游的procaspase-3进人内源性和外源性凋亡途径的最后通路,最终导致细胞死亡[11]。
综上所述,本研究观察到SPS刺激后大鼠中缝背核神经元线粒体Cyt-c的释放增多,可以提示PTSD大鼠中缝背核神经元可能存在细胞凋亡,从而导致中缝背核功能失调,产生了PTSD不同的精神症状,为揭示PTSD的发病机制提供了一定的实验依据。本文观察从蛋白和分子水平观察到线粒体Cyt-c的释放,为继续研究 PTSD大鼠中缝核神经元的线粒体凋亡通路提供了依据。
[1]刘婷婷,丁金兰,刘宁宇,等.杏仁核与创伤后应激障碍发病机制的相关性.解剖科学进展,2009,15(3):329-332
[2]H.M. van Praag. The cognitive paradox in posttraumatic stress disorder:a hypothesis.Prog Neuropsychopharmacol Biol Psychiatry,2004,28:923-935
[3]罗振国,韩庆国,张小云.大鼠脑中缝核的免疫细胞化学特性研究.深圳大学学报,2000,17(1):63-64
[4]Carrion VG,Weems CF,Watson C,et al.Converging evidence for abnormalities of the prefrontal cortex and evaluation of midsagittal structures in pediatric posttraumatic stress disorder:An MRI study.Psychiatry Research Neuroimaging,2009,172:226-234
[5]肖冰,韩芳,石玉秀.创伤后应激障碍模型大鼠杏仁核COX及Caspase 3 mRNA表达的变化.解剖科学进展,2009,15(4):353-356
[6]Harvey BH,Brand L,Jeeva Z,et al.Cortical/hippocampal monoamines,HPA-axis changes and aversive behavior following stress and restress in an animal model of post-traumatic stress disorder.Physiol Behav,2006,87(5):881-890
[7]Sapolsky RM.Glucocorticoids and hippocampal atrophy in neuropsychiatric disorders.Arch Gen Psychiatry,2000,57(10):925-935
[8]Southwick SM,Krystal J H,Bremner JD,et al.Noradrenergic and serotonergic function in postttaumatic stress disorder.Arch Gen Psychiatry,1997;54:749-758.
[9]肖冰,韩芳,石玉秀.PTSD样行为异常大鼠杏仁核Ca2+/CaM的改变.中国组织化学与细胞化学杂志,2009,18(4):359-363
[10]Li K,Li Y,Shelton JM,et al.Cytochrome c deficiency cause sembryonic lethality and attenuates sterss-induced apoptosis.Cell,2000,101(4):389-399
[11]Mronga T,Stahnke T,Goldbaum O.Mitochondrial pathway is involved in hydrogen-peroxide-induced apoptotic cell death ofoligodendrocytes.Glia,2004,46(4):446-455
PTSD promotes expression of cytochrome c in the dorsal raphe nucleus of the rats
Luo Feifei1,2,Yu Bo3,Han Fang1,2,Shi Yuxiu1,2*
(Department ofHistology and Embryology,College of B asic Medical Sciences,China Medical University,S henyang110001,China)
Objective To study the expression of cytochrome c(Cyt-c)in the dorsal raphe neurons of posttraumatic stress disorder(PTSD)-like rats.Methods Forty normal adult male Wistar rats were randomized into:normal control group and single prolonged stress(SPS)group(1d,4d,and 7d).Enzymohistochemistry and RT-PCR techniques were used to detect the expression of Cyt-c in the dorsal raphe neurons.Results The activity of Cyt-c was observed by light microscopy.The expression of cyt-c mRNA in the dorsal raphe neurons gradually increased at 1d,4d and 7d after exposure to SPS compared with that of the control group,reaching the maximum at 7d.Cyt-c products were found to be distributed mainly in the mitochondria membrane,but more Cyt-c products were found in the cytoplasm at 7d after SPS stimulation by transmission electronmicroscopy.Conclusion SPS stimulation causes the overexpression of Cyt-c in the dorsal raphe neurons.
Posttraumatic stress disorder; Dorsal raphe neuron; Cytochrome c; Enzymohistochemistry; RT-PCR
R329
A
10.3870/zgzzhx.2011.01.009
2010-10-10
2010-11-01
国家自然科学基金资助项目(30600341);教育部博士点基金资助项目(20092104110016)
罗斐斐,女(1985年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

