水螅芽体发育与头部再生进程间的相互作用
金 灿 潘红春
(安徽师范大学生命科学学院,重要生物资源保护与利用研究安徽省重点实验室,生物环境与生态安全安徽省高校省级重点实验室,芜湖 241000)
水螅芽体发育与头部再生进程间的相互作用
金 灿 潘红春
(安徽师范大学生命科学学院,重要生物资源保护与利用研究安徽省重点实验室,生物环境与生态安全安徽省高校省级重点实验室,芜湖 241000)
目的 观察具有单个芽体的大乳头水螅(Hydra magnipapillata)头部再生进程,探讨水螅头部结构的再生进程与芽体发育过程之间可能存在的相互作用。方法 选取具有单个年幼芽体的水螅体,在水螅母体上紧贴芽体着生部位的上方进行切除手术,观察母体头部再生进程。通过ABTS细胞化学染色法检测水螅基盘分子标志物过氧化物酶的表达,观察水螅芽体基盘与母体间的结构联系。结果 水螅母体伤口在手术后2h内愈合。随着再生时间的延长,出现两种不同命运的芽体发育方式。一种情况是水螅芽体基盘紧贴母体手术切口,芽体发育成熟后可正常脱离母体;在芽体脱离母体前母体头部再生进程被抑制,在芽体脱落后母体头部再生进程重新启动、且在其后48h内母体头部再生完成。另一种情况是水螅芽体基盘组织与母体手术切口不产生结构联系而向外突出生长,母体头部再生进程完全停止,芽体胃区与母体相连且芽体发育成熟后不脱离母体。结论 靠近水螅母体手术伤口的年幼芽体能延迟或阻断母体头部的再生进程,而手术切口也可能干扰了发育成熟的芽体与母体脱离的正常机制。
大乳头水螅; 无性出芽生殖; 再生; 基盘过氧化物酶
刺胞动物门水螅纲的淡水水螅是非常适合进行个体发育和形态发生调控机制研究的模式生物,主要基于两个方面的因素:一是水螅为低等的两胚层动物;二是因为水螅具有简单的单个体轴的极性体制,一个极为由口、垂唇和口周围的数根触手组成的口区,另一极为由柄和位于身体末端的基盘构成的足区,口区和足区之间为胃区,其中胃区与柄的分界处为出芽区。水螅具有有性和无性两种繁殖方式,在实验室培养条件下,水螅通常以无性繁殖的方式在出芽区产生芽体,发育成熟的芽体脱离母体后成为新生水螅体。已有研究表明,水螅出芽率由喂食频率决定,喂食次数越多,出芽数量越多[1,2]。水螅芽体的最初发生诱因及影响芽体发育速度的主要因子均为喂食频率,但芽体发育成熟后脱离母体的调控机制尚不清楚。
有研究发现佛波醇、甘油二酯及氯化锂等物质能阻止水螅芽体基盘的形成,芽体不能脱离母体、而成为与母体相连的身体分支[3-6];培养液中钙离子浓度偏低或在培养液中添加钡离子或锶离子亦能阻止芽体与母体脱离[7]。上述研究结果说明水螅芽体与母体的分离能受到外界因素的干扰,对从侧面探讨水螅芽体脱离母体的调控机制有所帮助,但从水螅体本身研究芽体从母体脱落的调控机制尚未见报道。基于此,本文为探讨手术切口对水螅芽体发育进程的影响,选取具有单个年幼芽体的水螅体,在水螅母体上紧贴芽体着生部位的上方进行切除手术,观察芽体发育及母体头部再生进程,探讨水螅母体头部再生进程与芽体形成过程之间可能存在的相互作用。
材料和方法
1 实验材料
实验用水螅为本实验室培育的大乳头水螅(Hy dra magnipapillata)单克隆无性繁殖系,原种采自安徽省芜湖市汀堂公园水塘(31021’39.2”N,118022’51.46”E)。实验前水螅每 3d 喂食一次卤虫幼体(A rtemiasp.),喂食1h后更换培养液,然后维持在温度22±0.5℃的光照培养箱中(光照强度=2000LX,LD:HD=12h:12h)。
2 实验方法
2.1 水螅的切断手术
实验组选取100只具有单个年幼芽体(芽体未长触手,第 4-5阶段的芽体[1,8])的成体水螅(图1A),用单面刀片紧贴水螅芽体着生部位的上方进行切断手术,将水螅切成前、后两段(图1B)。手术后的水螅后段放入装有水螅培养液的小烧杯中,并置于22±0.5℃的黑暗培养箱内培养。
对照组挑取100只无芽体水螅(图1C),用单面刀片在水螅胃区和水螅柄的分界处(出芽区)进行切断手术将水螅切成前、后两段(图1D),对照组的后续处理同实验组。
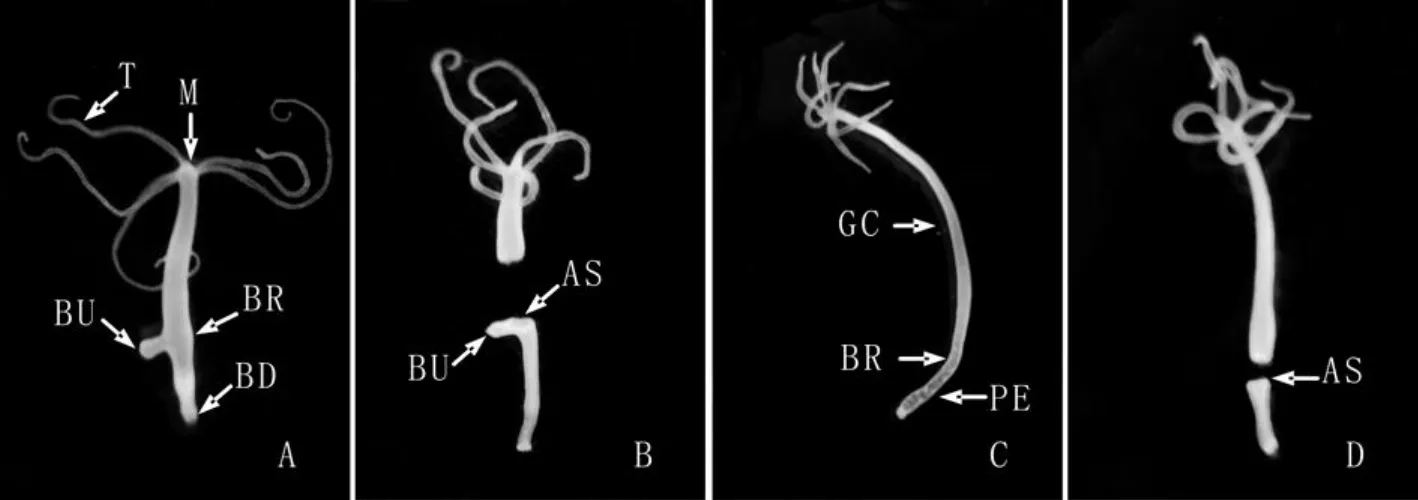
图1 实验组大乳头水螅头部切断手术前(A,10X)、后(B,10X)个体形态及对照组无芽体水螅切断手术前(C,10X)、后(D,10X)个体形态.示触手(T),口(M),芽体(BU),出芽区(BR),基盘(BD),切口部位(AS),胃区(GC)及水螅柄(PE)Fig.1 The normal polyp bearing a young bud(A,10X),the polyp which was sectioned just apical to the bud(B,10X),the normal hydra body without any bud(C,10X)and the polyp which was cut just at the budding region(D,10X).Tentacle(T),mouth(M),bud(BU),budding region(BR),basal disc(BD),amputation section(AS),gastral cavity(GC)and peduncle(PE)
2.2 水螅头部再生及芽体发育过程观察
分别在切断手术之后的 0h、4h、8h、16h、24h 观察由切断手术得到的水螅后段再生头部的进程以及芽体发育进程,之后每24h观察一次。每次观察时拍照记录并更换水螅培养液。
2.3 基盘分子标志物基盘过氧化物酶表达的检测
通过ABTS细胞化学染色法检测水螅基盘分子标志物过氧化物酶的表达,观察水螅芽体基盘与母体间的结构联系。将水螅置于白色陶瓷比色板上(每孔1只水螅),每孔分别加入350 l新鲜配制的ABTS染色混合液(655mmol/L柠檬酸、345mmol/L柠檬酸盐和1%ABTS溶液各700l,70l 0.3%H2O2,双蒸水定容至7ml)[9-11],反应20min后用双蒸水洗涤2次,加入300l 2%NaF溶液,然后通过Olympus数码显微镜观察和拍照。
结 果
1 水螅芽体发育进程与头部再生进程
所有实验组水螅母体的伤口在手术后2h内均可愈合,随着再生时间的延长,出现两种不同命运的芽体发育方式。一种命运是水螅芽体基盘紧贴母体手术切口,芽体发育成熟后可正常脱离母体;另一种命运是水螅芽体基盘组织与母体手术切口不产生结构联系而向外突出生长,母体头部再生进程完全停止,芽体胃腔与母体相连且芽体发育成熟后不脱离母体(表1)。

表1 切断手术后芽体发育的两种命运Table 1 Two types of development fates of the bud after amputation
1.1 芽体发育命运之一:芽体发育成熟后可正常脱离母体、但脱离母体前抑制母体头部再生进程
实验组水螅切断手术后,随着再生时间的延长,母体切口逐渐愈合(图2B),再生48h时已可以看到芽体与母体连接处出现较浅缢痕(图2F),从基盘分子标志物过氧化物酶的表达区域可以清楚地看出芽体的基盘组织与母体直接接触(图3),72h时缢痕明显、芽体基盘着生于母体切口处且芽体即将脱离母体(图2G),芽体发育96h后脱离母体,母体在芽体脱落后48h时母体头部再生完成,也就是说实验组水螅自切断手术后144h才完成头部再生。而对照组水螅自切断手术后48h之内头部再生就已经完成(图4)。
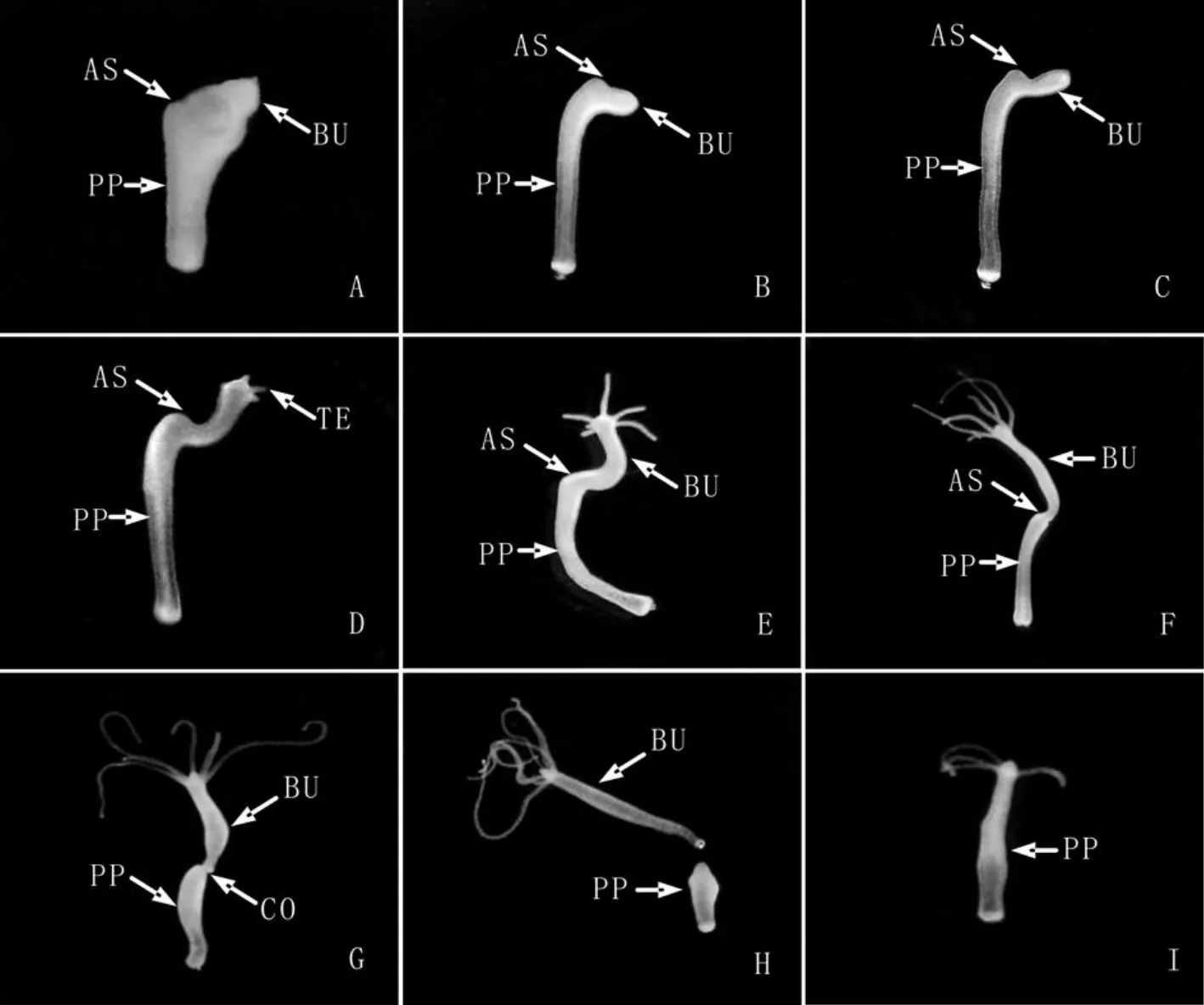
图2 切断手术后芽体最终要与母体分离、但芽体与母体分离前母体头部的再生进程被抑制的水螅个体的形态学变化.0h(A,8X),4h(B,8X),8h(C,8X),16h(D,8X),24h(E,8X),48h(F,8X),72h(G,8X),96h(H,8X),144h(I,8X),手术切口(AS),芽体 (BU),触手 (TE),基盘 (BD),水螅母体 (PP),缢痕 (CO)Fig.2 The morphological change of the cut parent polyps of which the head regeneration process was inhibited before the bud detaching.0h(A,8X),4h(B,8X),8h(C,8X),16 h(D,8X),24 h(E,8X),48 h(F,8X),72 h(G,8X),96 h(H,8X),144 h(I,8X),amputation section(AS),bud(BU),tentacle(TE),basal disc(BD),the parent polyp(PP)and constriction(CO)

图3 切断手术后最终要脱离母体的芽体与母体切口处的连接方式(A,30X)以及芽体和母体各自基盘过氧化物酶的表达(B,20X;C,80X).示切口部位(AS),芽体基盘(BBD),芽体基盘过氧化物酶的表达区域(BBP),母体基盘过氧化物酶的表达区域(BP),水螅母体(PP),芽体(BU),缢痕(CO)Fig.3 Structural connection between the bud’s basal disc(A,30X)and the parent polyp,and the expression of peroxidase in the bud’s basal disc and the parent polyp’s basal disc(B,20X;C,80X). Amputation section(AS),the basal disc of bud(BBD),the expression of peroxidase in the basal disc of bud(BBP),the expression of peroxidase in the basal disc of parent polyp(BP),the parent polyp(PP),bud(BU),constriction(CO)

图4 无芽体水螅切断手术后头部再生进程.每张图右上角插图为各再生时间段水螅的切口部位放大图,0h(A,8X),4h(B,8X),8h(C,8X),16h(D,8X),24h(E,8X),48h(F,8X),手术切口(AS),基盘(BD),触手(TE)Fig.4 The head regeneration process of budless hydra body after amputation. The illustration in the right upper corner of every figure is the enlarged view of hydra’s amputation section,0h(A,8X),4h(B,8X),8h(C,8X),16h(D,8X),24h(E,8X),48h(F,8X),amputation section(AS),basal disc(BD),tentacle(TE)
1.2 芽体发育命运之二:芽体胃区与母体相连且芽体发育成熟后不脱离母体
实验组水螅2h内伤口愈合,芽体朝向手术切口方向弯曲生长(图5A-E),切断手术48h时芽体长出基盘组织(图5F),96h芽体基盘形状明显并向外突出生长于母体外(图5H),从基盘分子标志物过氧化物酶的表达区域可以清楚地看出芽体的基盘组织与母体出芽区域不直接接触(图6),芽体的胃区与水螅母体相连,整体呈倒“Y”形(图5J-L),芽体发育成熟后与母体相连不脱落,母体本身头部的再生进程完全停止。
2 倒“Y”形水螅喂食前后胃腔状态及出芽过程
对倒“Y”形水螅连续观察并于切断手术后的168h开始喂食,由于卤虫无节幼虫体色为淡黄色,可根据水螅胃腔颜色明显观察到两个胃腔均有消化能力,表明芽体胃腔与原母体胃腔相通(图7)。
由于喂食,倒“Y”形水螅开始出现第一代芽体,72h后芽体发育成熟脱落。第一代芽体出芽部位为原水螅母体出芽区,并着生于母体出芽区外侧,第一代芽体发育成熟后正常脱离母体,表明原芽体已经与母体形成一个整体(图8)。
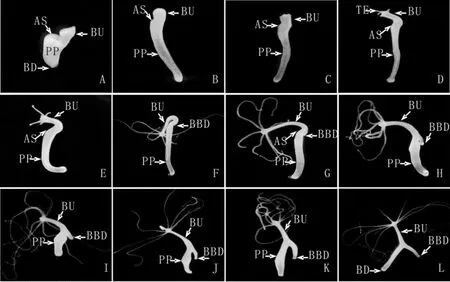
图5 切断手术后母体头部的再生被完全抑制、同时芽体不与母体分离的水螅个体的形态学变化.0h(A,15X),4h(B,15X),8h(C,15X),16h(D,15X),24h(E,15X),48h(F,15X),72h(G,15X),96h(H,15X),144h(I,10X),168h(J,10X),192h(K,10X),216h(L,10X),手术切口(AS),芽体(BU),母体基盘(BD),触手(TE),芽体基盘(BBD),水螅母体(PP)Fig.5 The morphological change of the cut parent polyps of which the head regeneration process was inhibited completely.0h(A,15X),4h(B,15X),8h(C,15X),16h(D,15X),24h(E,15X),48h(F,15X),72h(G,15X),96h(H,15X),144h(I,10X),168h(J,10X),192h(K,10X),216h(L,10X),amputation section(AS),bud(BU),the basal disc of parent polyp(BD),tentacle(TE),the basal disc of bud(BBD)and the parent polyp(PP)
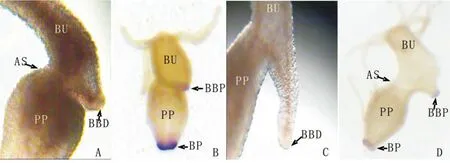
图6 切断手术后最终不与母体脱离的芽体与母体切口处的连接方式(A:切除手术后72h,40X;C:切除手术后96h,30X)以及芽体和母体各自基盘过氧化物酶的表达(B:切除手术后72h,20X;D:切除手术后96h,20X).手术切口(AS),芽体基盘(BBD),芽体基盘过氧化物酶的表达区域(BBP),母体基盘过氧化物酶的表达区域(BP),水螅母体(PP),芽体(BU)Fig.6 Structural connection between the bud’s basal disc and the parent polyp(A:72h after amputation,40X;C:96h after amputation,30X),and the expression of peroxidase in the bud’s basal disc and the parent polyp’s basal disc(B:72h after amputation,20X;D:96h after amputation,20X).Amputation section(AS),the basal disc of bud(BBD),the basal disc of parent polyp(BD),the expression of peroxidase in the basal disc of bud(BBP),the expression of peroxidase in the basal disc of parent polyp(BP),bud(BU)

图7 倒“Y”形水螅喂食前后胃腔状态.喂食前(A,10X),喂食后30min(B,10X),喂食后1h(C,10X),喂食后24h(D,10X).示卤虫(AR),芽体(BU),母体基盘(BD),芽体基盘(BBD),水螅母体(PP)Fig.7 The gastral cavity of the inverted Y-shaped hydra before and after feeding. Before feeding(A,10X),30 min after feeding(B,10X),1 h after feeding(C,10X),24 h after feeding(D,10X),A rtemiasp.(AR),bud(BU),the basal disc of parent polyp(BD),the basal disc of bud(BBD)and the parent polyp(PP)
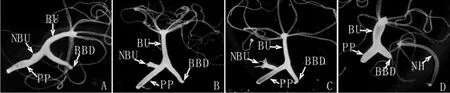
图8 倒“Y”形水螅第一代芽体的发育过程.阶段1芽体(A,10X),阶段6芽体(B,10X),阶段8芽体(C,10X),芽体脱离母体(D,10X),第一代芽体(NBU),芽体(BU),母体基盘(BD),芽体基盘(BBD),水螅母体(PP),第一代芽体脱离母体形成的新生水螅个体(NH)Fig.8 The formation process of first-generation bud in the inverted Y-shaped hydra. stage 1 bud(A,10X),stage 6 bud(B,10X),stage 8 bud(C,10X),parent polyp and a detached bud(D,10X),first-generation bud(NBU),bud(BU),the basal disc of parent polyp(BD),the basal disc of bud(BBD),the parent polyp(PP)and new hydra body(NH)
讨 论
水螅进行无性出芽生殖时其出芽区体壁向外形成芽突,芽突长度逐渐增加(芽突的胃腔与母体是相通的),直至其尖端出现垂唇和触手而成为成形的芽体,随后芽体与母体的连接部位体壁出现缢缩而隔断芽体胃腔与母体胃腔,最后发育成熟的水螅芽体脱离母体成为新生水螅体[1]。本研究在水螅母体上紧贴芽体着生部位的上方进行切除手术后,出现两种不同命运的芽体发育方式。一种情况是水螅芽体基盘紧贴母体手术切口,芽体发育成熟后可正常脱离母体(图2);另一种情况是水螅芽体基盘组织与母体手术切口不产生结构联系而向外突出生长,芽体胃区与母体相连且芽体发育成熟后不脱离母体而形成倒“Y”形水螅体(具有2个基盘和1个头的水螅体,图5L)。上述研究结果显示芽体能够脱离母体水螅的先决条件是芽体与母体直接接触的部位外胚层细胞要分化成能高量表达基盘特异性过氧化物酶的粘液细胞,即芽体与母体直接接触的部位要分化成基盘组织。另外 Zeretzke等[7]采用钙离子浓度偏低的培养液成功阻止水螅芽体与母体正常分离而诱导出“H”形水螅个体(具有2个基盘和2个头的水螅体,芽体的基盘不直接与母体接触而向外突出)和“Y”形水螅个体(具有1个基盘和2个头的水螅体,芽体与母体直接接触的部位没有分化出基盘组织)的相关实验也证实了这一判断。以上几种水螅芽体与母体不脱离的畸形水螅个体有一个共性,就是芽体与母体直接接触部位无特殊细胞分化、而与该处母体组织是均一性组织,因而可能难以产生芽体脱离母体的调控信号。还有一种可能性也值得考虑,正常情况下水螅进行无性出芽生殖时芽体发育成熟后必然要脱离母体,然而本实验在紧贴芽体上方的位置进行切除手术造成了大部分水螅个体的成熟芽体不能正常脱离母体(图5),因此有可能是这个特殊位置的手术切口干扰了发育成熟的芽体与母体脱离的正常机制。
本文实验结果表明,在母体头部的再生进程中,切口附近芽体的存在抑制了母体头部的再生进程,表现为母体头部再生进程的延迟(芽体脱落后,头部再生进程才开始启动,图2)或母体头部再生进程的完全停止(倒“Y”形水螅体,图5)。一般认为水螅体内存在4种成形素(头部形成抑制物,头部形成激活物,基盘形成抑制物和基盘形成激活物)调控其头部和基盘的形成,这4种物质顺水螅体轴按浓度梯度分布,头部形成抑制物和头部形成激活物在水螅体头部浓度最大,而基盘形成抑制物和基盘形成激活物浓度在基盘位置最大[12,13]。依照该理论,在水螅芽体的发育过程中,在水螅芽体与母体接触的区域应该分布大量基盘形成激活物;而本研究中紧贴芽体上方的手术切口(此切口应该再生母体头部)的再生进程受到抑制或阻断,似乎该处头部形成抑制物应该高表达,所以从这点推断,水螅芽体基盘区域的基盘形成激活物会不会与头部形成抑制物是同一物质呢?还有待进一步研究。
[1]Fischer AB,Hofmann DK.Budding bud morphogenesis,and regeneration inCarybdea marsupialisLinnaeus,1758(Cnidaria:Cubozoa). Hydrobiologia,2004,530/531:331-337
[2]Dunn KW.The effect of host feeding on the contribution of endosymbiotic algae to the growth of green hydra.Biol Bul.,1988,175:193-201
[3]P′erez F. Effects of cantharidin and phorbol ester on bud formation in Hydra vulgaris. Int J Dev Biol,1996,suppl.1:273
[4]Müller WA. Diacylglycerol induced multiple head formation inHydra.Development,1989,105:309-316
[5]Müller WA. Ectopic head and foot formation inHydra:Diacylglycerol induced increase in positional value and assistance of the head in foot formation.Differentiation,1990,42:131-143
[6]Hassel M,Berking S.Lithium ions interfere with pattern control inHydra vulgaris. Roux′s Arch Dev Biol,1990,198:382-388
[7]Zeretzke S,Pérez F,Velden K,et al. Ca2+-ions and pattern control in Hydra.Int J Dev Biol,2002,46:705-710
[8]Joann JO,Campbell RD.Budding inHydra attenuata:bud stages and fate map.Journal of Experimental Zoology,2005,200(3):417-428
[9]徐金金,潘红春,金灿等.大乳头水螅基盘再生进程中过氧化物酶的表达.中国组织化学与细胞化学杂志,2010,19(3):269-273
[10]Sabine H,Schaller HC.A new biochemical marker for foot-specific cell differentiation in hydra. Roux’s Dev Biol,1985,194:453-461
[11]Ghaskadbi SS,Shetye L,Chiplonkar S,et al.Ultraviolet irradiation initiates ectopic foot formation in regenerating hydra and promotes budding.Biosci,2005,30(2):177-182
[12]Kukalev AS. Morphogens of hydraHydrasp. Journal of Evolutionary Biochemistry and Physiology,2005,41(1):1-11
[13]Shostak S. Bipolar inhibitory gradients’influence on the budding region ofHydra viridis.Amer Zoo,1974,14:619-632
Interaction Between Bud Development And Head Regeneration Process In Hydra
Jin Can,Pan Hongchun*
(Provincial Key L aboratory of the Conservation and Ex ploitation of Biological Resources&Provincial Key L aboratory of Biotic Environment and Ecological S af ety in A nhui,College of L if e Sciences,A nhui Normal University,W uhu241000China)
Objective To observe the head regeneration process inHy dra magnipapillatawith a single bud and explore the possible interplay between head regeneration and bud development.Methods The hydra polyps bearing a young bud were sectioned just apical to the bud for observing the head regeneration process of the parent polyps. In order to observe the structural connections between the bud’s basal disc and the parent polyp,the cytochemical staining method based on substrate ABTS was used to reveal the expression of the peroxidase in the basal disc.Results The amputation wounds healed in two hours,and there were subsequently two different developmental patterns of the bud:(1)The bud whose basal disc contacted directly with the amputation wound would detach from the parent polyp.However,the head regeneration process in the parent polyp was suspended before the bud detachment then restart and beaccomplished in about 48 hours;and(2)The bud whose gastral region rather than the basal disc contacted directly with the parent polyp’s amputation did not detach from the parent polyp when the bud was fully formed,while the basal disc of the bud grew outside the parent polyp.In addition,the head regeneration process in the parent animal was inhibited completely.Conclusion The young bud near the amputation wound of the parent polyp suspends or prohibis the head regeneration of the parent hydra,and the amputation section may interfere with the mechanism by which the bud separates from the parent polyp.
Hy dra magnipapillata; Asexual reproduction by budding; Regeneration; Peroxidase of basal disc
R329
A
10.3870/zgzzhx.2011.01.019
2010-10-25
2010-12-29
安徽省高等学校省级自然科学研究重点项目(KJ2011A130);安徽师范大学生物大分子进化重点实验室开放基金项目(2006A002);安徽省优秀青年基金资助项目(08040106811)
金灿,男(1984年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

