小鼠pDsRed-Meis1真核表达载体构建及子宫内表达的鉴定
熊 敏 朱桂金
(华中科技大学同济医学院附属同济医院妇产科生殖中心,武汉 430030)
小鼠pDsRed-Meis1真核表达载体构建及子宫内表达的鉴定
熊 敏 朱桂金*
(华中科技大学同济医学院附属同济医院妇产科生殖中心,武汉 430030)
目的 构建小鼠Myeloid ectropic viral integration site 1(Meis1)基因和红色荧光蛋白(Red fluorescence protein,RFP)真核表达质粒,为进一步研究Meis1在生殖系统中的功能提供基础。方法 设计引物,扩增含Meis1片段的克隆质粒中的meis1基因片段,将其插入真核表达载体pDsRed-N1,重组质粒经酶切鉴定后测序,并转染至小鼠子宫;用Western blot及免疫组织化学方法鉴定外源基因Meis1的表达。结果 酶切和测序结果表明,构建的pDsRed-Meis1重组质粒正确;Western blot结果显示,外源性Meis1高表达于孕D2的小鼠子宫;转染后冰冻切片结果显示,带红色荧光蛋白的阳性产物表达于孕D4的小鼠子宫内膜及全层;免疫组织化学结果显示,Meis1阳性产物主要表达于孕小鼠子宫上皮、腺体和基质细胞内。结论 正确构建了pDsRed-Meis1真核表达质粒,并成功转染及高表达于小鼠子宫,为进一步探讨Meis1在生殖系统中的功能提供了有利工具。
meis1基因; 重组质粒; 宫腔内转染
哺乳动物的胚胎着床是一个极其复杂的过程。胚胎的成功植入需要发育良好的胚胎,具有容受性的子宫内膜以及胚胎与子宫内膜之间的交互过程。HOX genes是调节子宫发育和胚胎着床的重要分子,Meis1作为HOX genes的辅助因子近年被发现在胚胎着床方面也发挥重要作用。为研究Meis1在胚胎着床方面的调节功能和分子间相互作用,我们构建了小鼠pDsRed-Meis1真核表达载体。
材料和方法
1.材料
高保真PCR反应试剂盒购于transgene公司,限制性内切酶EcoRI,KpnI和T4 DNA连接酶购于fermentas公司,胶回收试剂盒购于OMIGA公司。引物由上海英骏公司合成,测序由北京诺赛生物有限公司完成。Meis1山羊多克隆抗体,鼠抗β-actin单克隆抗体购于Santacruz公司,opti-MEM培养基Lipofectamine TM2000试剂购于invetrogen公司,免疫组化试剂盒购于博士德公司。BCA蛋白浓度检测试剂盒和ECL发光试剂盒为PIERCE公司产品。Meis1 cDNA购于广州复能基因有限公司。pDsRed-N1由华中科技大学同济医学院李和教授惠赠。
2.实验动物
购于同济医院动物实验中心,清洁级,成熟未育的昆明种小鼠,8-10周龄,体重25-35 g,适应性被饲养7d后,进入实验,自然光照,自由取水和摄食,将雌雄小鼠按2:1的比例合笼,次日9时检查,发现阴栓定为妊娠第1d(D1)。
3.pDsRed-Meis1质粒构建
根据 meis1基因全序列 (Genebank:BC023689.1)设计 PCR 扩增引物,上游:5’TATAGAATTCATGGCGCAAAGGTACG 3’;下游:5’GTTAGGTACCTTTACCAGGCAGCAGC 3’PCR反应条件:95℃5min,95℃30s,58℃40s,72℃120s,35个循环。PCR产物经1%的琼脂糖凝胶电泳后在紫外光下切下目的条带,用omiga胶回收试剂盒回收纯化,经 EcoRI和 KpnI双酶切30min,酶切回收后16℃T4 DNA连接酶连接过夜,用DH5a感受态细菌转化,挑取单克隆菌小提质粒,酶切鉴定条带位置正确后送诺赛基因有限公司测序鉴定。测序正确的质粒大量制备。
4.小鼠宫腔内转染重组质粒
取pDsRed-N1-Meis1重组质粒及空白质粒pDsRed-N1各 l-2μl,脂质体 2μl分别加入 25μl无血清培养基(Opti-MEM)中,混合这两种溶液,使DNA和脂质体终浓度分别为16g/ml和40 g/ml,在室温下孵育20 min,即配制为DNA/脂质体复合物。取妊娠第2d(D2)的小鼠,腹腔注射1%戊巴比妥充分麻醉后固定,作背部正中切口,暴露双侧卵巢及子宫,使用微量注射器分别从近卵巢侧子宫角部向官腔内注入25μl DNA/脂质体复合物,左侧子宫注射空白质粒/脂质体复合物,右侧子宫注射重组质粒/脂质体复合物。用4-0丝线缝合腹腔和皮下。实验小鼠12只。
5.Western blot:转染后Meis1蛋白表达检测:
质粒转染后48-72h,取小鼠子宫标本,150μl三去污裂解液冰上裂解小鼠子宫内膜组织20 min,4℃12,000 r/min离心15min,取上清,BCA法测定蛋白浓度。60g蛋白样品溶解于5×SDS凝胶加样缓冲液后行10%SDS聚丙烯酰胺凝胶电泳(SDSPA GE),后将蛋白条带转移至 PVDF膜。羊抗鼠Meisl多克隆抗体浓度为1:100,羊抗鼠-actin单克隆抗体浓度为1:5000,4℃孵育过夜。用增强化学发光(ECL)进行显色,KODA K Image成像系统western blotting成像。
6.荧光显微镜观察冰冻切片:Meisl-Red蛋白表达的检测
质粒转染后48-72h,取小鼠子宫标本,常规冰冻切片,切片(厚度8μm)。立即荧光显微镜下观察红色荧光表达。
7.免疫组织化学染色:Meisl蛋白表达的检测
质粒转染后48-72h,取小鼠子宫标本,固定,包埋。切片(厚度5μm)常规脱蜡、入水,免疫染色程序严格按试剂盒说明进行。主要步骤:3%H2O2:甲醛封闭内源性过氧化物酶,微波修复抗原,依次加入Meisl的一抗(羊抗鼠多克隆抗,1:150),二抗(兔抗羊多克隆抗体,1:50),辣根过氧化酶链亲和素(1:200),DAB显色,苏木素复染。
结 果
1.表达质粒pDsRed-N1-Meis1的构建及鉴定
质粒构建后,用含阳性克隆的细菌大提质粒,进行PCR,EcoRI和 KpnI双酶切鉴定,结果可见meis1条带(见图1),提示质粒构建正确。送菌液测序,结果显示插入序列无突变(测序图未列出)。
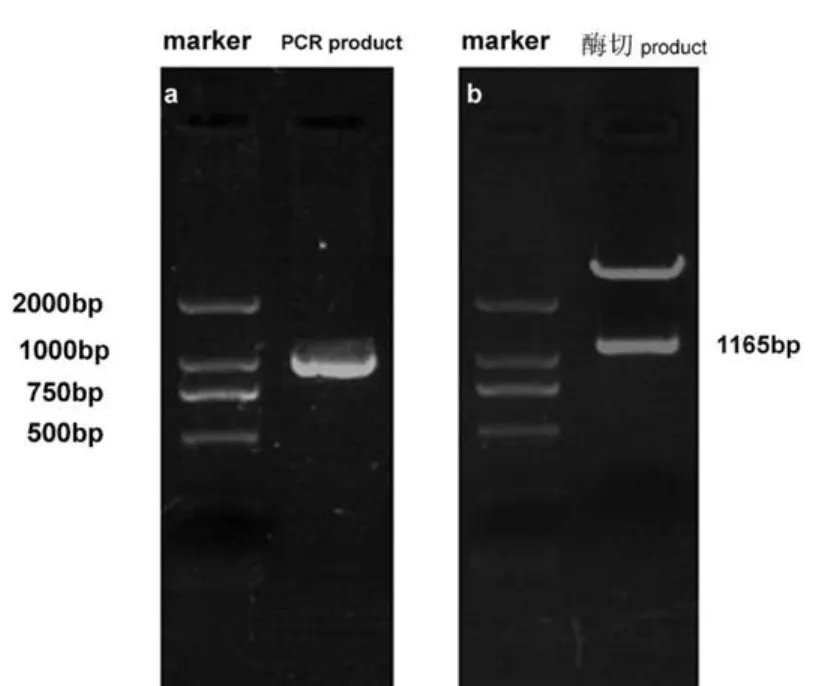
图1 重组质粒pDsRed-Meis1的PCR及酶切鉴定。a:重组质粒pDsRed-Meis1的 PCR鉴定;b:重组质粒pD-sRed-Meis1的酶切鉴定Fig.1 The analysis of the recombinant plasmid pDsRed-Meis1 with PCR(a)and digested by restriction enzyme(b)
2.质粒转染小鼠子宫后Meis1蛋白表达western blotting鉴定
质粒pDsRed-Meis1和空pDsRed-N1质粒转染围着床期小鼠子宫,提取组织总蛋白进行Western blot检测Meis1蛋白的表达,可见构建的pD-sRed-Meis1质粒可以在小鼠子宫高效表达(见图2)。

图2 重组质粒pDsRed-Meis1和空白质粒pDsRed-N1转染小鼠子宫western blot鉴定Fig.2 the expressions of Meis1 protein in pDsRed-Meis1 plasmid and pDsRed-N1 transferred uterus in mice
3.荧光显微镜观察Meis1-Red融合蛋白的表达
冰冻切片立即荧光显微镜下观察Meis1-红色荧光融合蛋白的表达情况。可见融合蛋白成功表达于小鼠子宫内膜及全层(见图3)。

图3 A白光下观察转染pDsRed-Meis1小鼠子宫;B红色荧光蛋白激发光下观察转染pDsRed-Meis1小鼠子宫;放大倍数×100;S:浆膜;L:腔上皮Fig.3 A:transferred pDsRed-Meis1 plasmid uterus in mice under white light;B:transferred pDsRed-Meis1 plasmid uterus in mice under fluorescent light;magnification:×100.S:serosa;L:luminal epithelia.
4.质粒转染小鼠子宫后Meis1蛋白表达免疫组化鉴定
免疫组织化学结果:Meisl表达于子宫内膜腺体、腔上皮和基质细胞。腺体、腔上皮和基质细胞核中均可见褐色颗粒。重组质粒DsRed-Meis1转染组及空白组(见图4)。

图4 重组质粒pDsRed-Meis1和空白质粒pDsRed-N1转染小鼠子宫Meis1的表达.a:重组质粒pDsRed-Meis1转染小鼠子宫Meis1的表达;b:空白质粒pDsRed-N1转染小鼠子宫Meis1的表达Fig.4 murine endometrial Meis1 expression with recombinant pDsRed-Meis1 and empty vector transferred.a:murine endometrial Meis1 expression with recombinant pDsRed-Meis1 transferred;b:murine endometrial Meis1 expression with empty vector pDsRed-N1 transferred.
讨 论
目前,全世界10-15%的育龄夫妇受到不孕症的困扰,不孕症已成为危害人类身心健康最常见的疾病之一。辅助生殖技术(Assisted reproductive technologyART)经过近30年的发展,超排卵新药物及方案的采用和胚胎体外培养技术的完善,使得IVF治疗中获得胚胎的数量和质量得到了保证,但胚胎着床率和临床妊娠率仍未有突破。胚胎植入的相关分子也逐步成为研究热点。众多学者利用基因芯片及基因敲除技术,筛选出一系列与胚胎着床相关的因子。[2]Hoxa10和 Hoxa11是 HOX genes家族中A簇的成员,在子宫的发育和胚胎着床方面发挥重要的作用,是公认的子宫内膜容受性的生物学标志分子。[3]Meis1作为 HOX genes的辅助因子,能与其形成异源二聚体,增加与靶基因的亲和力从而增加转录效率。[4]
有研究表明Meis1在人生理周期子宫内膜上均有表达,且在分泌中期表达最强。在Meis1表达下调的小鼠子宫,胚胎着床率显著下降,表明Meis1在胚胎着床过程中发挥了重要作用。[1]Meis1作为血液系统重要的调节因子[5],新近被发现在视觉系统的形成过程中也发挥了重要作用[6],然而在生殖系统中的研究却较少。为了进一步研究Meis1在生殖系统中的作用及其与HOX基因相互作用的分子机制,我们构建了pDsRed-Meis1真核表达载体,可通过荧光显微镜直接观Meis1在生殖系统中的表达,及用激光共聚焦显微镜观察Meis1与其它相关蛋白的结合情况;DsRed还可以通过免疫共沉淀,为进一步研究蛋白之间的相互作用提供便利工具。
[1]Bei Xu,Dirk Geerts,Kun Qian,et al.Myeloid ecotropic viral integration site 1(MEIS)1 involvement in embryonic implantation.Human Reproduction,23(6):1394-1406
[2]Hanna Achache and Ariel Revel.Endometrial receptivity markers,the journey to successful embryo implantation.Human Reproduction Update,2006.12(6):731-746
[3]Taylor HS.The role of HOX genes in human implantation.Hum Reprod Update,2000,6(1):75-79
[4]Thorsteinsdottir U,Kroon E,Jerome L,et al.Defining roles for HOX and MEIS1 genes in induction of acute myeloid leukemia.Mol Cell Biol,2001,21(1):224-234
[5]Argiropoulos B,Yung E,Humphries PK.Unraveling the crucial roles of Meis1 in leukemogenesis and normal hematopoiesis.Genes Dev,2007,21(22):2845-2849
[6]Erickson T,French CR,Waskiewicz AJ.Meis1 specifies positional information in the retina and tectum to organize the zebrafish visual system.Neural Dev,2010,5:22
Construction of pDsRed-Meis1 expression vector and its expression in murine uterus
Xiong Min,Zhu Guijin
(Reproductive Center,Tongij Hospital,Huazhong University of Science and Technology,W uhan430030,China)
Objective To construct the recombinant plasmid pDsRed-Meis1 and detect its expression in the murine uterus.Methods The full sequence of Meis1 was obtained by PCR.After enzyme digestion by EcoRI and KpnI,ligation overnight by T4 DNA ligase and transformation by DH5a,we obtained the recombinant plasmid of pDsRed-Meis1,which was identified by enzyme digestion and DNA sequencing.The recombinant plasmid was transfected into the murine uterus,and detected by Western blot.Results The recombinant plasmid pDsRed-Meis1 was identified to be correct by PCR,enzyme digestion and DNA sequencing.Western blot and immunohistochemisty revealed that Meis1 expression was significantly increased in pDsRed-Meis1 transfection than in empty vetor transfection.Conclusion The expression vector pDsRed-Meis1 is successfully constructed,which can express Meis1 protein in the murine uterus.
Meis1; Recombinant plasmid; Intrauterus transfection
R361
A
10.3870/zgzzhx.2011.01.007
2010-02-10
2010-04-01
国家973基金资助(2007-CB948104)
熊敏,女(1978年),汉族,博士研究生。
*通讯作者(To whom correspondence should be addressed)

