环介导恒温核酸扩增法的研究和技术方法
李彦媚,赵喜红,徐泽智,徐振波
(1.广州医学院,广东广州 510120; 2.武汉工程大学化工与制药学院绿色化工过程省部共建教育部重点实验,湖北武汉 430073; 3.南海水产研究所,广东广州 510300; 4.华南理工大学轻工与食品学院,广东广州 510640; 5.美国马里兰大学生物医学科学系,马里兰 21201)
环介导恒温核酸扩增法的研究和技术方法
李彦媚1,赵喜红2,徐泽智3,徐振波4,5,*
(1.广州医学院,广东广州 510120; 2.武汉工程大学化工与制药学院绿色化工过程省部共建教育部重点实验,湖北武汉 430073; 3.南海水产研究所,广东广州 510300; 4.华南理工大学轻工与食品学院,广东广州 510640; 5.美国马里兰大学生物医学科学系,马里兰 21201)
核酸扩增是生命科学领域最具价值的工具之一,在临床微生物检测、传染性疾病以及基因诊断方面具有独特的应用价值。传统的检测方法均存在一定的局限性,因此基于核酸扩增的检测方法具有广阔的应用前景。环介导恒温核酸扩增法(loop-mediated isothermal amplification of DNA,简称LAMP)是一种新型的核酸扩增方法,由于其特异性和灵敏度高、简便快捷且成本低廉,因此在可预见的将来,LAMP技术将在核酸扩增领域逐渐取代PCR反应,推动检测技术向更快捷简便,更精确廉价的方向发展。
环介导恒温核酸扩增法,核酸扩增,临床检测
核酸扩增是生命科学领域最具价值的工具之一,在临床微生物检测、传染性疾病以及基因诊断方面具有独特的应用价值。传统的检测方法如常规培养、血清学和免疫学方法(如ELISA)等,均存在一定的局限性,如耗时较长、需要配套的仪器设备、无法解析基因层面的疾病(如对病毒的检测与分析、分子流行病学研究以及各种基因疾病如SNP的鉴别等)。因此基于核酸扩增的检测方法具有广阔的应用前景,主要方法包括∶核酸序列扩增法(nucleic acid sequence-based amplification,NASBA)、自列复制(self-sustained sequence replication,3SR)、链置换扩增法(strand displacement amplification,SDA)、聚合酶链式反应(Polymerase chain Reaction,PCR)以及荧光定量PCR等。但这些方法均在简易性、灵敏度、特异性、快速性等方面存在或多或少的缺陷(表1),因此,开发一种简易快捷,特异灵敏的核酸扩增检测方法成为当务之急。2000年,Notomi等开发出一种新的环介导恒温核酸扩增法(loop-mediated isothermal amplification of DNA,简称LAMP)[1],该方法能够在恒温条件下特异、高效、快速地扩增靶序列。LAMP技术是识别靶目标序列上的6/8个特异区域,设计4/6条引物;在恒温条件下,利用具有链置换活性的DNA聚合酶(Bst酶),通过形成环状结构及链置换,对目标DNA进行大量扩增,形成多种片段的DNA产物。自LAMP方法问世后短短几年,已被广泛应用于生物安全、疾病诊断、食品分析及环境监测等领域。该方法在简便,快速,特异性和灵敏度方面具有显著优势,其主要流程为∶选择靶基因作为检测对象-LAMP反应的建立及优化-LAMP反应的实际应用。本文将按照LAMP的流程,分别对从实验设计到应用进行综述,并着重介绍技术难点及研究经验。
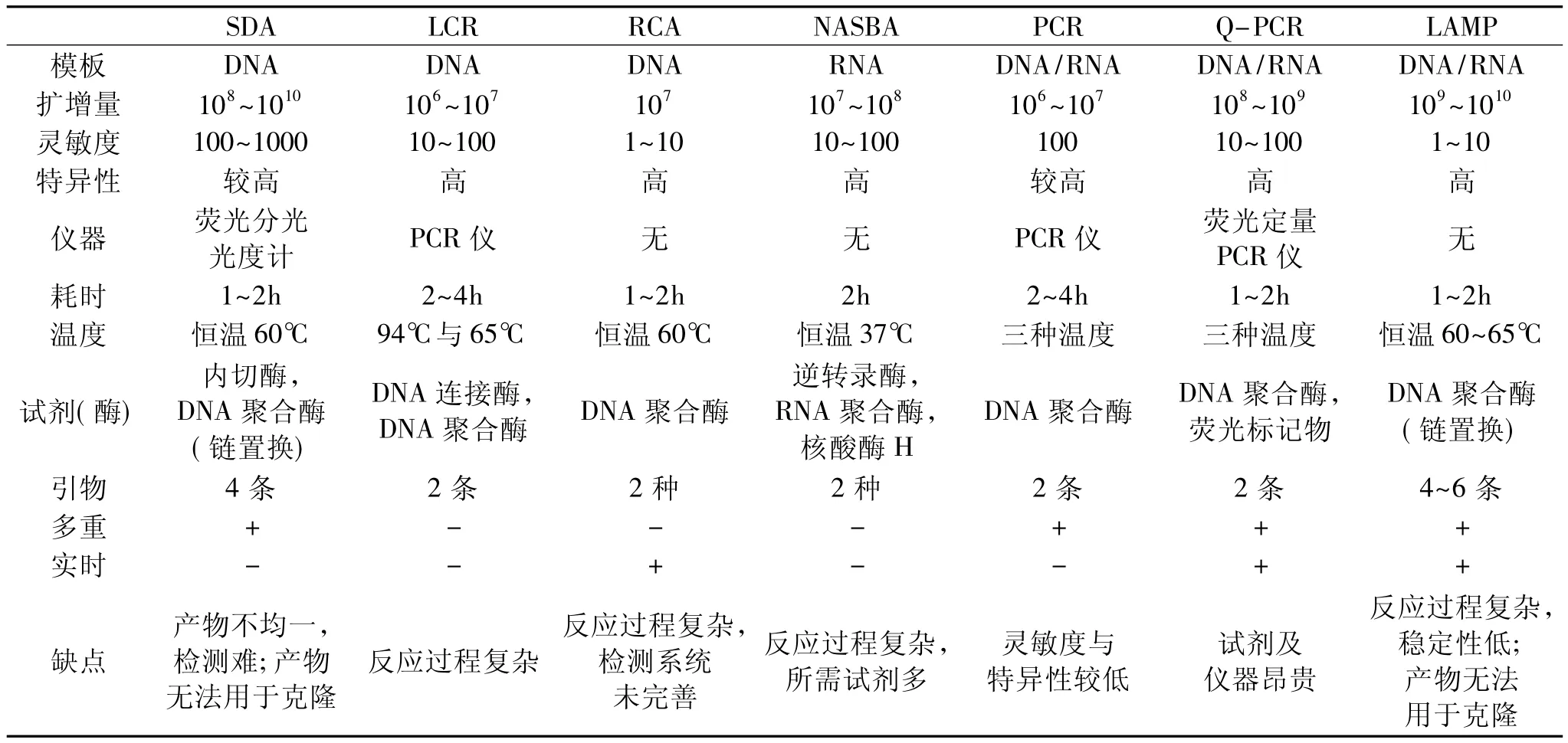
表1 不同核酸扩增技术的特性比较
1 检测对象及靶目标基因的选择
要正确地选择检测对象及其靶目标基因,必须对LAMP的特点,包括其优点与缺点有所了解。首先,LAMP反应扩增效率极高,适合用于快速检测。由于LAMP反应通过形成DNA环与链置换,可在恒温条件下(60~65℃)进行。由于没有温度循环过程中的时间损失,因此反应可在短时间内将少量拷贝的靶基因扩增到109~1010水平(DNA浓度约0.4~0.8g/L)。早期的LAMP反应过程耗时约1~2h,但通过对引物进行改进,可明显提高扩增效率,缩短反应时间;最显著的进展是通过设计环引物(loop primer),加速扩增反应的进行,能缩短反应时间至0.5~1h[2]。另外通过优化引物不同的浓度配比,也能提高反应的扩增效率。第二,LAMP反应结果判断简易快速。LAMP反应的结果除可以通过常规的凝胶电泳结合成像系统进行检测外,由于其高效的扩增效率,反应产物极多,因此还有多种通过直接肉眼观察从而对结果进行判断的方法,使LAMP反应更方便快捷与简便。但同时由于反应产物并非均一,因此LAMP的应用也具有其限制性,包括产物无法用于克隆,检测产物无法进行深入分析与鉴定等。第三,LAMP反应特异性强,灵敏度高,可以取代大多数PCR检测。由于LAMP的特异引物可以严格地识别靶核酸序列上的6个特异区域,通过与该6个独立部位的准确结合进行扩增反应,因此其特异性极高;即使1个核苷酸差异,LAMP也能够区分相应的靶序列进行扩增,基于此原理,LAMP可用于SNP的检测。另外,LAMP反应的灵敏度极高,其灵敏度可达常规PCR的10~100倍(检出限是常规 PCR的1/100~1/10拷贝数),因此在对如培养增生耗时长(如结核杆菌)或病毒载量较低(如对病毒携带者)等进行检测时具有较大优势。同时,与PCR相似,除可直接对DNA进行检测外,还可以通过逆转录(RT)反应,对RNA模板进行检测,一般称之为RT-LAMP;这使其可应用于对RNA病毒的检测。综上,LAMP在检测领域内可取代大多数PCR检测,并获得更高的特异性与灵敏度。第四,实验装置简单,成本较低廉。由于LAMP反应在恒温下就可进行,不需要如PCR仪等的温度循环设备。在LAMP反应实际应用中,仅需要得到稳定热源的设备,如普通的恒温仪或水浴锅即可。因此LAMP方法具有较大的简易性与推广价值,尤其适合基层医疗单位和相对落后地区的常规检测应用。
综上,LAMP反应具有操作方便,高效快速,灵敏特异和廉价简易等优点;但同时也具有仅能用于初筛检测(扩增产物无法用于克隆及深入分析鉴定)和稳定性不高等缺点,因此在选择检测对象时需进行全面考虑。
2 保守扩增序列的选择
在选择检测对象及合适的靶基因后,需选取保守的扩增区域,以便进行引物设计。在此对LAMP的引物和反应原理进行阐述。LAMP技术通过识别靶序列上6个特异区域,分别是 F1/B1,F2/B2和F3/B3,设计4条特殊引物。其中两条为内引物FIP (F1c和F2)和BIP(B1c和B2),F2和B2分别处于扩增片段两端,长度为18~24bp;F1/B1分别位于F2/B2内侧,与其相距30~40bp,长度与F2/B2相当,为18~24bp。另两条为外引物F3和B3,分别为位于F2和B2外侧,长度为17~21bp,仅在LAMP反应的起始阶段起作用。综上,LAMP引物识别的区域约200~250bp,因此用以设计的扩增区域应至少达500bp以上。LAMP反应过程包括哑铃状模板合成阶段、循环扩增阶段、伸长和再循环阶段。首先在哑铃状模板合成阶段,FIP/BIP的F2/B2序列结合到模板DNA的 F2c/B2c上,通过互补序列配对,合成DNA链,形成双链结构。然后,通过F3/B3与模板DNA的F3c/B3c区域互补配对,合成DNA链,启动链置换反应,挤掉上述由FIP/BIP合成的DNA链,而被释放出的DNA链两端均存在互补序列,发生自我碱基配对,通过F1c/B1c和F1/B1互补,形成一个环状结构。这时,被置换下的由FIP/BIP引导的合成链两端自动成环,形成一条两端环状的单链,即哑铃结构。其次,在循环扩增阶段,上述形成哑铃结构的通过自我引导延伸,生成双链茎环结构;FIP的F1c结合到茎环DNA环状结构的F1区域上,合成DNA双链;这时形成了一个过渡性茎环结构DNA,在随后自我引导的链置换DNA合成反应中生成一条茎环DNA和互补的DNA链。这两种结构可通过不断循环反应生成相同的扩增产物;而其中间产物则为下一阶段形成更大片段扩增产物的形成提供模板。最后一步是伸长和再循环阶段,FIP/BIP结合到茎环结构的F1/B1上,通过链置换反应,不断合成新的DNA链,使茎环个数逐渐增加。LAMP反应的关键在于茎环结构的形成与Bst大片段DNA聚合酶作用下的链置换,内引物FIP/BIP通过结合到茎环结构环状区域的互补序列(F1/B1)上,在Bst酶作用下进行不断的链置换反应,最终形成大量不均一的扩增产物,包括上述反应形成一系列反向重复靶序列形成的茎环结构和多环花椰菜样结构片段,形成大小相差100bp左右的DNA混合物,电泳后形成典型的梯状图。
3 引物的设计
LAMP引物的设计是整个反应中最关键的步骤。其设计方法包括观察搜索法与软件设计法,传统的设计方法是观察搜索法,主要基于FIP/BIP中的T-T-T-T序列,在保守扩增序列中找到重复碱基,然后根据引物设计准则进行分析,选择优化的引物对。成功的引物设计包括如下关键因素∶首先,引物间的距离。其中细则包括∶a.成环区,即F2/B2的5'端到B2c/F2c的3'端(外引物F3/B3不参与到主要的环介导扩增反应),长度约为120~180bp;b.环结合区,即F2/B2的5'端到F1c/B1c的5'端,长度约为40~60bp,其中在F2/B2到F1c/B1c之间的区域可设计环引物LF/LB;c.外引物F3/B3到F2/B2需相隔0~20bp,一般选取12~18bp。第二,Tm值。LAMP引物的退火温度是引物的重要参数之一,对于反应的起始和延伸过程都非常重要。总的来说为F1c/B1c>F2/B2>F3/B3,其中F2/B2,F3/B3和LF/LB的Tm值比较一致,对GC含量比较丰富(GC含量大于65%)的模板可取59~61℃,对 AT含量丰富(GC含量小于65%)的可取54~56℃;F1c和B1c的Tm值稍高,对上述两种情况分别取64~66℃与59~61℃。第三,引物的稳定性。在引物设计过程中,需注意避免二级结构的产生,尤其是FIP/BIP较长(约40bp),可采用基因解析软件进行分析;避免3'末端发夹结构和引物间自身的序列互补(如用Primer Explorer软件设计,可通过“dimer check”进行确定);末端稳定性对反应的顺利进行也十分重要,其中F2/B2,F3/B3和LF/LB的3'端与F1c与B1c的5'端比较重要(如用软件设计可通过对各引物末端6碱基的dG值进行筛选);相对来说,F3/B3仅在反应启动阶段起作用,其重要性相对较低。第四,GC含量,一般选择为45%~60%即可。软件设计法主要是通过荣研公司在线的软件设计工具,进行LAMP引物设计流程简述如下∶首先登录荣研公司在线软件设计网页(http∶// primerexplorer.jp/e/),并选择软件版本V3或V 4;输入模板序列,点击“Design”,并在系统设别序列后点击“Generate”生成引物;然后遵循从粗选到细选的规则,在开始的时候可放松挑选的条件,勾选引物,并可点击“Detail”查看引物的详细数据;确定所选引物,优先选择所有5’端和3’dG值小于-4的,另外可选择2~3组,通过实验进行进一步筛选;最后点击“Primer information”进行保存。设计环引物的时候,在引物设计页面,输入上述保存的文件,按照相应操作,则可生成环引物。
4 LAMP反应的建立与优化
4.1 引物的筛选与优化
虽然引物经过上述方法进行设计,但最终对引物的筛选,需通过实际LAMP反应进行。因为即使经过严格的引物设计程序,并使引物符合所有设定条件,但仍会存在一定的问题,分述如下∶a.扩增结果为阴性;根据我们的经验,即使通过网上软件进行设计,并选择最为优化参数的引物套,但在实际LAMP反应中只有约80%~90%能进行扩增。b.非常规扩增;不同的引物套具有不同的扩增效率,在实际过程中,我们发现同一个LAMP反应体系,不同引物使反应结果达到阳性所需的时间不同;而通过实时浊度计的扩增曲线可见,部分引物为非常规扩增,对此应予剔除。在引物的筛选与优化过程中,建议通过实时浊度计并观察扩增曲线,在所设计的引物中选择能特异快速,并符合常规扩增过程的引物套。
4.2 反应体系的优化
LAMP体系对反应具有重要影响,一般常规LAMP体系包括4~6条引物,缓冲液与Bst酶,dNTP,甜菜碱,镁离子(一般用硫酸镁)与模板。其中重要的因素包括∶a.反应体系大小∶一般选取25或50μL体系,根据经验,12.5μL体系仍能成功进行LAMP扩增反应,但稳定性与重现性有所下降。b.引物浓度∶如上述,通过优化引物浓度可有效提高扩增效率。内/外引物的浓度配对比引物的绝对浓度要重要,一般选取4∶1或8∶1。c.dNTP∶与PCR相比,LAMP反应需更高浓度的dNTP,一般终浓度为1~2mmol/L,常用1.4~1.6mmol/L。由于LAMP反应的扩增量是由dNTP决定(而非模板),因此dNTP的浓度对反应具有重要影响。d.镁离子∶在LAMP反应过程中需加入镁离子作为缓冲液,与焦磷酸盐形成沉淀,维持体系稳定;常用5~10mmol/L的硫酸镁。e.甜菜碱∶在体系中加入0.5~1mmol/L甜菜碱有利于维持体系平衡,但其并非LAMP反应所必需,根据经验,即使体系中不加入甜菜碱,LAMP反应也能进行。f.DNA模板∶DNA模板的质量与浓度是反应顺利进行的关键因素。在体系优化过程中,建议使用质量较高的模板DNA,便于提高反应的稳定性与重现性,从而达到对反应参数的掌握。
4.3 反应参数的评估
LAMP反应的主要参数包括灵敏度和特异性。前者是通过选用不同浓度梯度的模板DNA或检测对象,获得LAMP所能检测的最低检出值;可用检测对象(如在细菌中为CFU)或标准DNA量(一般为10~100ng)进行表示。后者则通过在不同种属的检测对象中同时设置LAMP反应对照,从而对LAMP反应的特异性进行说明。对阴性对照样品检测引物特异性时,需适当把反应时间延长(例如增至120min),一般如没有出现阳性结果,则可视为特异;如出现阳性结果,则考虑重新设计引物,甚至更改靶点。
4.4 结果判定
LAMP反应的结果判定包括实时法和终点法。在核酸扩增过程中,随着dNTP的消耗与扩增产物的合成,同时也形成了大量副产物如焦磷酸镁盐沉淀。其化学反应式如下∶

由于LAMP反应极高的扩增效率,因此反应过程中产生了大量的焦磷酸根(可达约10μg),但PCR反应产生的焦磷酸根则不到0.1μmol/L(约0.2μg),而常规可检出的最低浓度是0.5mmol/L(约为4μg),因此LAMP反应通过焦磷酸镁沉淀量与DNA生成量之间的线性关系,可对反应进行实时定量,而PCR反应则需要其他特殊的显色试剂和酶辅助来检测产生的焦磷酸离子。研究表明,焦磷酸镁沉淀在400nm处有吸收峰,利用LAMP反应中焦磷酸镁沉淀与所合成DNA量之间的线性关系,通过实时浊度仪监测沉淀的形成量,对反应中DNA的合成量进行反推,从而对LAMP可进行实时监测和定量[3]。终点法则包括∶a.凝胶电泳∶其中包括直接法和酶切法两种。由于LAMP反应过程扩增大量的非单一片段的产物,因此可以通过凝胶电泳直接进行检测;反应过程中形成大量不均一条带,大小相差100bp左右,在胶上能形成梯状图,反映了产物的条带量;酶切法则可以通过直接利用原有的酶切位点,或在设计引物的时候在TTTT的前后引入酶切位点,通过限制性酶消化来鉴定产物的结构和大小。b.沉淀及荧光判断法∶其中包括焦磷酸镁沉淀、钙黄绿素、Eva Green、SYBR GreenI和HNB等。如上所述,由于LAMP反应过程中形成大量焦磷酸镁沉淀,因此直接通过肉眼观察是否生成白色的焦磷酸镁沉淀,从而对结果进行判断[1-2,4]。扩增反应结束后,向反应小管中加入(1∶100)的SYBR Green I荧光染料。利用荧光染料SYBR Green I与双链DNA结合会发绿色荧光,因此通过向反应产物加入稀释的SYBR Green I(1∶100,约1μL),如反应生成大量的扩增产物,则染料颜色由橙色变为绿色。通过该颜色变化可对结果进行判断,既可在自然光下肉眼观察,也可在紫外灯下进行观察。但由于SYBR Green I能与所有双链DNA进行结合,因此该颜色变化并非LAMP反应特异。而近年来,越来越多的研究报道选用钙黄绿素作为荧光染料。
综上,对LAMP反应结果进行判断有多种方法,可根据实际应用进行选择。
5 LAMP反应的实际应用
5.1 模板DNA的获取
模板DNA是LAMP反应顺利进行的必要因素之一,在优化反应体系过程中可用质量较高的模板DNA,但在实际应用中,出于降低成本与缩短反应时间,因此更倾向于使用简易快捷的DNA提取处理方法,从而使模板DNA的质量有所下降;同时,由于DNA处理步骤的减少,因此模板中可能含有大量杂物因子,对LAMP反应的顺利进行也会造成一定影响。在实际应用中,需考虑模板DNA的质量问题,在保证LAMP反应稳定性与重现性的前提下,尽量选用简易快捷的模板提取和处理方法。
5.2 LAMP反应批间稳定性与重现性
如上所述,LAMP的其中一个不足之处是稳定性与重现性较PCR差,与Q-PCR相当。由于LAMP设计过程繁琐,反应过程复杂,造成其非常规扩增的因素较多,因此其稳定性与重现性较差。但通过优化引物与缓冲液体系,能显著提高LAMP反应的批间稳定性与重现性;在实际应用中,需至少重复三次反应进行验证。
5.3 对交叉污染的预防与处理
与所有核酸扩增方法相似,LAMP反应也存在严重的交叉污染问题,主要集中于扩增产物的交叉污染。由于LAMP反应扩增效率高和产物量大(比常规PCR高10-3~10-4),因此非常容易出现产物污染,操作稍不注意就会出现交叉污染,阴性对照也会出现阳性结果;同时出现污染后较难消除,对实验进程造成较大影响。对交叉污染出现的预防方法最主要是实验流程的空间隔离,例如按照临床扩增实验室标准,把试剂配制,模板处理,扩增反应与结果分析在空间上隔离;其次“不开盖”原则,即在反应后不打开盖子进行检测,主要通过实时浊度仪进行扩增曲线的获取与分析。在出现交叉污染后,一般对于污染处理的方法包括∶a.改变扩增靶点∶由于LAMP反应产物量大,易于造成污染,使引物以污染的产物为模板进行大量扩增;因此通过改变扩增靶点,重新设计引物,则原污染产物无法被新引物识别,从而消除污染现象。b.消除环境中残存的LAMP反应产物,主要方法包括∶对环境进行常规清洁和灭菌杀毒等,包括酒精、DNAZAP等;紫外灯照射,但由于紫外线仅对小于500bp的DNA片段起作用,而LAMP反应后能出现大量大于500bp的产物,因此该方法仅能作为辅助用,并不能彻底解决污染;dUTP/UDG系统,通过UDG酶(0.05U)在一定条件下进行消化(37℃,5min)和灭活(92℃,1min),从而使 dTTP全部为dUTP代替,对低浓度污染(不大于103copies/mL)可进行彻底消除;在一定时期内停止LAMP反应,并注意通风。
6 结语
目前,LAMP反应在食品安全、公共卫生等领域中对常见食源性中毒细菌、流行性病毒、基因诊断等多个方面得到广泛应用[5-13]。由于其特异性和灵敏度高、简便快捷且成本低廉,因此在可预见的将来,LAMP技术将在核酸扩增领域逐渐取代PCR反应,推动检测技术向更快捷简便,更精确廉价的方向发展。
[1]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28 (12):63.
[2]Nagamine K,Hase T,Notomi T.Accelerated reaction by loopmediated isothermal amplification using loop primers[J]. Molecular and Cellular Probes,2002(16):223-229.
[3]Mori Y,Nagamine K,Tomita N,et al.Detection of Loopmediated isothermal amplification reaction by tubidity derived from magnesium pyrophosphate formation[J].Biochemical and Biophysical Research Communications,2001,289(1):150-154.
[4]Maruyama F,Kenzaka T,Yamaguchi N,et al.Detection of bacteria carrying thestx2 gene by in situ loop-mediated isothermalamplification[J].Applied and Environmental Microbilolgy,2003,69(8):5023-5028.
[5]Ohtsuka K,Yanagawa K,Takatori K,et al.Detection of Salmonella enteria in naturally contaminated liquid eggs by loopmediated isothermal amplification and characterization ofSalmonellaisolates[J].Applied and Environmental Microbilolgy,2005,71:6730-6735.
[6]Pham H M,Nakajima C,Ohashi K,et al.Loop-mediated isothermal amplification for rapid detection of Newcastle disease virus[J].J Clin Microbiol,2005,(43):1646-1650.
[7]Ihira M,Yoshikawa T,Enomoto Y,et al.Rapid diagnosis of Human Herpesvirus 6 Infection by a novel DNA amplification method,loop-mediated isothermal amplification[J].J Clin Microbiol,2004,42(1):140-145.
[8]Zhao X,Li Y,Wang L,et al.Development and application of a loop-mediated isothermal amplification method on rapid detectionEscherichia coliO157 strains from food samples[J].Mol Biol Rep,2010,37:2183-2188.
[9]Zhao X,Wang L,Li Y,et al.Development and application of a loop-mediated isothermal amplification method on rapid detection of Pseudomonas aeruginosa strains[J].World J Microbiol Biotechnol(DOI 10.1007/s11274-010-0429-0).
[10]Wang L,Shi L,Alam MJ,et al.Specific and rapid detection of food-borne Salmonella by loop-mediated isothermal amplification method[J].Food Res Int,2008,41:69-74.
[11]Zhao X,Li Y,Chu J,et al Rapid detection ofVibrio parahaemolyticusstrains and virulent factors by loop-mediated isothermalamplification assays[J] .Food Science and Biotechnology,In press.
[12]Zhao X,Li Y,Chu J,et al.Development and application of a rapid and simple loop-mediated isothermal amplification method for food-borneSalmonelladetection[J].Food Science and Biotechnology,In press.
[13]王丽.近海食源微生物产毒特性的基因分析及其快速检测研究[D].华南理工大学,2008.
Development on the techniques of loop-mediated isothermal amplification
LI Yan-mei1,ZHAO Xi-hong2,XU Ze-zhi3,XU Zhen-bo4,5,*
(1.Guangzhou Medical College,Guangzhou 510120,China;2.Key Laboratory for Green Chemical Process of Ministry of Education,School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430073,China;3.South China Fishery Institute,Guangzhou 510300,China; 4.College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China; 5.Department of Microbial Pathogenesis,Dental School,University of Maryland,Baltimore,Maryland 21201,USA)
Clinical detection based on genetic amplification is one of the most valuable tools in bioscience,which had been proved to be applicable in detection of clinical microbes,infectious diseases and gene diagnosis. Limitation on traditional detection methods posed significant obstacles for their broad application.A novel nucleic acid amplification method,designated loop-mediated isothermal amplification(LAMP),known as a rapid,lowcost,easy operating,highly sensitive and specific detection method,had been reported and applied in the field of bacteriological detection.In future,it’s convinced LAMP will replace PCR assays,contributing to more rapid,simple,specific and accurate detection methods.
loop-mediated isothermal amplification;nucleic acid amplification;clinical detection
TS201.2+4
A
1002-0306(2011)11-0514-05
2010-09-26 *通讯联系人
李彦媚(1982-),女,硕士研究生,研究方向:临床基因检测。

