磁性多孔微粒对脂肪酶的固定化
陶维红,杨立荣,徐 刚,邰玉蕾,王 立,吴坚平
(浙江大学化学工程与生物工程学系,浙江 杭州 310027)
研究开发
磁性多孔微粒对脂肪酶的固定化
陶维红,杨立荣,徐 刚,邰玉蕾,王 立,吴坚平
(浙江大学化学工程与生物工程学系,浙江 杭州 310027)
开发了以磁性多孔微粒作为载体固定化脂肪酶的方法,进行了载体的FTIR、XRD、SEM、TEM、BET、TGA和VSM等测定与分析,考察了固定化时间、酶载量和缓冲液pH值等因素对固定化酶在有机相中催化烯丙醇酮转酯化反应性能的影响。结果表明,制备的磁性微粒是以Fe3O4为磁核,呈现多孔,比表面积12.16 m2/g,平均孔径为171.7 nm,磁铁含量38%并为超顺磁性;在酶与载体质量比为1∶1、pH值8.0及固定化时间6 h制得固定化酶的效果最佳,固定化酶的活力回收率可达240%。以其作为载体制备获得固定化酶操作稳定性得到显著提高,重复利用30批次后残余活力为74.5%,而游离酶7批次后仅为37.1%。
磁性多孔微粒;节杆菌脂肪酶;酶固定化;转酯化反应
磁性材料一直被广泛应用于生物技术和医学领域[1]。很多生物活性物质,比如酶、蛋白等[2-7],被固定在磁性载体上,在癌症治疗、基因表达、药物释放等领域[8-10]已获得大量应用。近些年,磁性材料作为生物酶固定化载体被用于酶催化反应发挥着重要作用。将磁性载体用于生物酶的固定化主要优点:所制备的固定化酶较强的磁响应性,从而可以借助外部磁场从反应体系中快速简便地富集、分离、回收固定化酶,随时控制酶催化反应,提高酶的使用效率[11]。
纳米级的铁氧化物是使用较为广泛的一类磁性载体材料,由于其粒径小、比表面积大、吸附能力强,并能实现超顺磁性,因而应用较广。Dyal等[12]以Fe(CO)为原料,制备出平均尺寸为20~30 nm的γ-Fe2O3纳米磁性粒子,对其表面进行化学修饰,共价结合脂肪酶。刘薇等[13]则采用改进的共沉淀法制备了Fe3O4磁性纳米粒子(20 nm),分别用于固定酵母乙醇脱氢酶(YADH)和脂肪酶,表现出良好磁分离性,固定化酶的催化活性也优于游离酶。这类单纯磁性载体虽然分离效果好,但是分散性不理想,容易团聚,同时对酶的亲和性不高,降低了酶的负载量。
近年来磁性高分子微球弥补了这些不足。磁性高分子微粒可通过共聚、表面改性等,赋予其表面多种反应性功能基团,如—COOH、—NH2、—OH、—COH等,与生物活性物质的亲和性较高,同时在分散性方面较大改善。孟繁宗等[14]以甲基丙烯酸-2-羟基乙酯为单体,N,N′-亚甲基双丙烯酰胺为交联剂,采用光化学方法在磁性液体中制备了Fe3O4磁性聚甲基丙烯酸-2-羟基乙酯微球,粒径为29.6 nm,大小均匀,分散性好,实现了牛血清白蛋白的固定化。吴侠等[15]制备具有表面功能基的稳定无毒的水溶性磁性复合体系,具有很好的顺磁性及生物相容性,成功地固定α-胰凝乳蛋白酶,表现出良好的热稳定性和操作稳定性。Liu等[16]采用悬浮聚合法将二乙烯基苯和甲基丙烯酸酯与油酸改性的 Fe3O4混合,表面用乙二胺活化后,再以戊二醛连接脂肪酶与载体,固定化酶的载酶量达到34.0 mg/g载体,固定化酶表现出较高的稳定性和重复使用性。
作者采用悬浮聚合法将二乙烯基苯和甲基丙烯酸酯与油酸改性的 Fe3O4混合,引发聚合得到了磁性高分子多孔微球,并对磁性微球的表面形貌及其它性质进行了表征,并将其用于脂肪酶的固定化。希望能够开发一种新型脂肪酶固定化载体和方法,以提高固定化酶在有机相中的催化活性和稳定性。
1 实验部分
1.1 实验材料
二乙烯基苯(DVB,80%)购自Sigma公司,并通过碱性氧化铝处理。甲基丙烯酸甲酯(MMA)购自上海化学试剂有限公司,减压蒸馏后使用。过氧化苯甲酰(BPO)购自上海化学试剂有限公司,并与水重结晶得到。聚乙烯醇(PVA,MW88000)购自Sigma Aldrich。六水三氯化铁(FeCl3·6H2O)、四水氯化亚铁(FeCl2·4H2O)、氨水(25%)、氯化钠、辛烷、甲苯、正己烷和油酸购自上海试剂有限公司。脂肪酶ASL(节杆菌脂肪酶)购自中科院微生物研究所。牛血清白蛋白购自Sigma公司。烯丙醇酮(HMPC,4-羟基-3-甲基-2-2-(2-烯丙基)-环戊烯酮,纯度>98.5%)购自常州康美化工有限公司。其它试剂均为化学纯,市售。
1.2 油酸包覆的Fe3O4磁性颗粒制备
油酸包覆的 Fe3O4磁性颗粒制备过程参照文献[16],通过共沉淀方法,具体为:将FeCl3·6H2O(8.7 g)和FeCl2·4H2O(3.3 g)溶于300 mL去离子水中,通氮气30 min,升温至85 ℃并剧烈搅拌后快速加入11.25 mL氨水,反应30 min后,将6.75 mL油酸加入上述反应体系,温度保持在85 ℃,反应1.5 h。通过磁铁吸附分离,并用去离子水洗涤5次。最后磁性颗粒分散在3 mL甲苯中,形成稳定的磁流体。
1.3 磁性多孔poly(MMA-co-DVB)微球制备
磁性多孔poly(MMA-co-DVB)微球采用悬浮聚合法制备。具体过程如下:将2.0 g PVA、2.5 g NaCl 搅拌溶于100 mL去离子水中后,向体系内加入2.0 g 上述铁流体与10 mL MMA、1.5 mL DVB、2 mL环己烷混合液,超声15 min以形成稳定乳化液。将乳化液转入三口烧瓶中,并在氮气保护下搅拌15 min,升温至到75 ℃,加入0.25 g BPO,反应5 h,得磁性微球,并用去离子水和甲醇洗涤数次后,真空干燥。
1.4 磁性多孔微球表征
红外(IR)分析:微球的化学键信息通过傅里叶变换红外光光度计(FTIR,Nicolet 5700)测定。
X射线衍射分析:磁性多孔微球通过 D/max-rA衍射仪在室温下进行测定,扫描范围2θ为10°~80°。
表面形貌的表征:将制备好的磁性微球分别用扫描电子显微镜(SEM,日立S4800)和透射电子显微镜(TEM)进行观察。研究该磁性微粒的表面形貌特征。
比表面积和孔径分布测定:使用 Micomeritics AUTOSORB-1-C气体吸附仪测定磁性多孔微球比表面积和孔径分布通过水银孔隙度计(Micomeritics Autopore Ⅳ 9500)测定。
热重(TGA)分析:微球样品在Perkine-Elmer TGA-7分析仪氮气保护下从35℃以15 ℃/min速度加热到600 ℃,进行热重分析。
磁性能(VSM)测定:微球样品在室温下超导量子磁强计测定。
1.5 脂肪酶固定化
将100 mg粗酶ASL溶于20 mL的pH值8.0(0.03 mol/L)磷酸缓冲液中,在4 ℃磁力搅拌20 min,经高速离心(12000 r/min)10 min,取上清液。在上清液中加入 100 mg磁性载体在 28 ℃、100 r/min的摇床中反应6 h,放在永久磁铁附近5~10 min收集沉淀,用相同缓冲液洗涤3~4次后将沉淀冷冻干燥12 h。放入4 ℃冰箱储存备用。
1.6 酶活测定
转酯酶活的测定按照文献[17]进行。即将 0.8 mmol烯丙醇酮加入到2 mL乙酸乙烯酯中,然后加入80 mg游离酶或固定化酶,200 r/min、40 ℃摇床中反应一定时间(控制转化率小于 5%),取样用气相色谱进行分析。
转化率:C=e.e.s/(e.e.s+e.e.p)×100%,此处e.e.s和e.e.p分别是底物和产物的对映体过剩值。
单位酶活(U)定义为:在反应条件下 1 min产生1 μmol烯丙醇酮乙酸酯所需要的酶量。比活力(U/g)定义为1 g蛋白所具有的酶活。
1.7 酶的稳定性
操作稳定性实验:取80 mg游离酶或固定化酶,反应初始阶段取样测定酶活,反应6 h时取样测定转化率,游离酶体系12000 r/min离心10 min,回收游离酶;而固定化酶体系通过永久磁铁吸附回收,并用乙酸乙烯酯溶剂洗涤 2~3次,加入新的反应液,重复进行30批次反应。(以第1次反应酶活为100%)。
热稳定性实验:不同温度下,分别将80 mg酶在2 mL乙酸乙烯酯中保温12 h,然后测定转酯活力。
2 结果与分析
2.1 磁性多孔微球表征
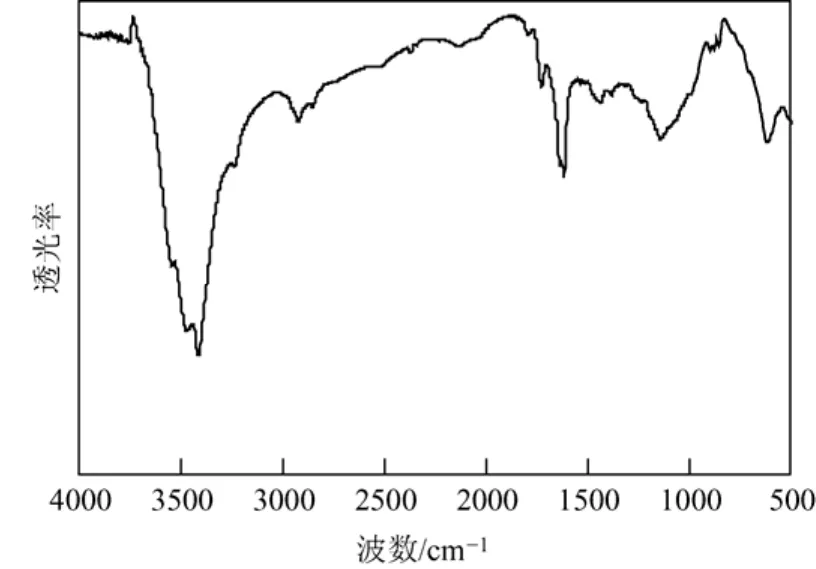
图1 磁性多孔微球的IR表征图谱

图2 磁性多孔微球的XRD表征图谱
磁性多孔微球红外光谱图1所示,在579 cm-1处显示特征吸附峰,对应是Fe3O4中Fe—O键的特征吸附峰,结合XRD数据(图2),磁性多孔微球的X射线衍射峰的位置对应于Fe3O4,表明磁性微球的磁核为Fe3O4。在1620 cm-1和1727 cm-1的特征吸收峰分别对应于二乙烯基苯单体中C=C和甲基丙烯酸甲酯单体中C=O的特征吸收峰。表明油酸修饰的颗粒Fe3O4微球被poly(MMA-co-DVB)聚合物所包覆。并且在聚合过程中的Fe3O4结晶相没有发生变化。
从磁性微球的TEM图片[见图3(c)]可以看出,所得磁性微球是具有核壳结构的球形粒子,并且其表面粗糙多孔[见图3(b)],而粗糙多孔表面的形成主要是因为聚合过程中聚合物包覆层所形成孔而造成的。由Micomeritics AUTOSORB-1-C气体吸附仪以及孔径分布由水银孔隙度计,分别对磁性微球的比表面积[根据Brunaurer-Emmmett-Teller(BET)模型计算]和平均孔径进行测定,结果如图4所示,其比表面积为12.16 m2/g;平均孔径为171.7 nm(压汞法),与扫描电镜结果一致。从压汞法数据分析,载体3~50 nm的孔占总孔容积(V)的44.5%,直径50~200 nm的孔占总孔容积的48.4%,其它孔占总孔容积的7.1%,总孔隙率为13.1%。

图3 磁性多孔微球的SEM和TEM表征图谱
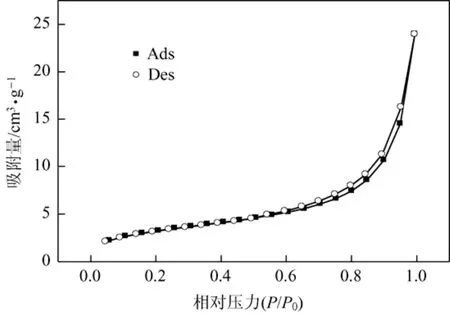
图4 磁性多孔微球的N2吸附/脱附等温线

图5 磁性多孔微球TGA曲线图
为了计算磁性微球中磁铁含量,进行了热重分析。如图5,磁性微球的TGA曲线显示当温度加热到700 ℃油酸和MMA-co-DVB聚合物几乎完全分解。失重分数曲线可以看出磁性微球中Fe3O4含量约为38%。并且如图6所示,该磁性聚合物微球的饱和磁化率约为18.12 emu/g,并在室温下表现出超顺磁性的特征,而相对较高Fe3O4含量和超顺磁性的特征,使得磁性微球在使用的过程中易于在外界磁场的作用下分离。这对于固定化酶的回收和重复利用极为重要。

图6 磁性多孔微球磁滞回线
2.2 固定化时间对固定化酶制备的影响
对于气液两相水溶液包裹体,测定冰点温度Tm(ice)和最终均一温度Tht;利用经验公式计算或利用实验相图确定流体盐度;利用温度—盐度—密度相图、经验公式或直接查表求得NaCl-H2O体系的密度;并使用“FLUIDS 1.”软件包(Bakker,2003)中的“BULK”程序校验。等容线的计算通过“ISOC”软件,使用(Bodnar and Vityk,1994)、(Knight and Bodnar,1989)方法计算获得,该方法试用于H2O-NaCl体系,温压试用范围为100~800℃和0~600MPa,只使用盐度和均一温度Tht(℃)即可计算离散压力-温度点,拟合等容线(表3)[15]。
图7为固定化时间对ASL酶固定化效果的影响。可以看出,随着时间的延长,蛋白吸附量逐渐增加,前2 h内基本呈直线上升,至6 h基本达到饱和值(约8.5 mg/g)。固定化酶的催化活力随着蛋白吸附量增加而增加,两者的变化趋势基本保持一致,在6 h时也达最大(18×103U),随着时间延长,酶活有所降低。这说明在反应开始阶段(2 h内),脂肪酶通过吸附快速结合到载体上,而随着载体上可结合位点数量的减少,吸附速度明显下降,超过一定时间后(6 h),固定化酶的转酯活力反而随时间延长有所降低。原因一方面脂肪酶在水溶液中不稳定,吸附时间过长导致部分酶失活;另一方面,过多的酶吸附于载体表面,导致载体孔道堵塞,酶蛋白分子相互屏蔽,和底物契合的酶数量减少。综合考虑固定化效率及固定化酶的转酯活力,确定固定化最佳时间为6 h。
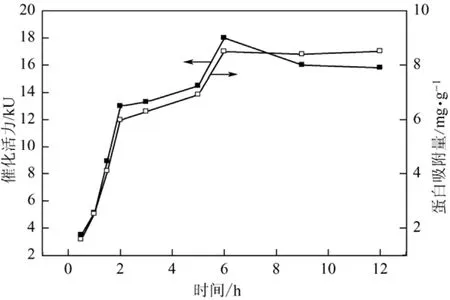
图7 固载时间对ASL固定化效果影响
2.3 酶载量对固定化酶制备影响
固定化酶的催化活性不仅与载体的颗粒大小及孔径等结构性质有关,还受酶加入量的影响[18]。表1为酶量对固定化效果的影响。可以看出,随着酶量的增加,蛋白吸附率逐渐降低,蛋白吸附量逐渐升高,比活力和活力回收先升高后降。一方面,载体对酶能够起到良好的分散作用,增加其与底物之间的接触面积,提高反应速率;另一方面,载体的存在增加了空间位阻,影响底物在酶活性中心区域的接近和定位,从而降低了酶的催化效率。当酶与载体比例过高(4 g/g)时,载体表面容易形成酶聚集体甚至多层酶,导致酶的有效利用率降低;而当酶与载体比例过低(0.125 g/g)时,载体对酶的构象效应可能突显出来。综合考虑,确定最佳酶/载体的质量比为 1.0。本文所用磁性载体吸附量大(13.2 mg/g),高于杨光等[17]用硅藻土做载体吸附、包埋和共价等方法固定 ASL时的蛋白吸附量(0.21~0.68 mg/g)。
2.4 pH值对固定化酶制备影响
由于脂肪酶和固定化载体都存在于缓冲液中,而缓冲液的pH值可以改变酶分子和固定化载体的离子化状态;另外,脂肪酶是蛋白质,当溶液的pH值超过一定范围时,围观结构会发生变化,从而引起酶的失活。因此缓冲液pH值是影响脂肪酶固定化关键因素之一。表2为固定化缓冲液pH值对ASL固定化效果的影响。可以看出,在偏酸或过碱时,酶活受到较大影响,酶活回收率显著下降。有研究表明,蛋白在冻干过程中具有“记忆效应”,并且在有机溶剂中有可能继续保持这种记忆[19]。也就是说,酶的催化行为与最后一次(比如冷冻干燥前)所处的水溶液的pH值有关。表中可以看出pH值为8.0缓冲液中制备的固定化酶活力、比活力和活力回收是最高。
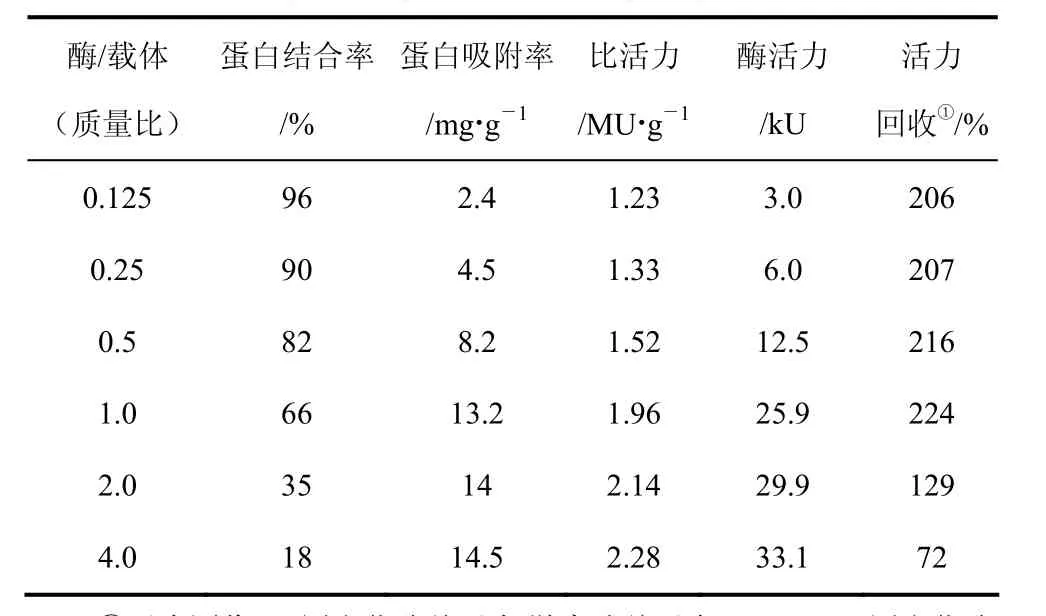
表1 酶量对固定化酶的影响

表2 pH值对ASL固定化效果的影响
根据以上结果,确定固定化最佳条件为:在酶与载体质量比为1∶1、pH值为8.0磷酸缓冲液及固定化时间 6 h。所得固定化酶转酯活力为 28.0×103U,比活力为 2.11×106U/g,活力回收是游离酶的2.4倍。
对固定化酶来说,除了催化活力,酶的稳定性尤其是操作稳定性也是影响其能否大规模应用的一个重要因素。图8显示固定化酶在有机相中反应时操作稳定性明显好于游离酶,重复使用30批次后残余活力依然有74.5%,而游离酶重复6次后残余活力就不到 50%,重复使用 7批次后残余活力仅为37.1%。在转酯反应过程中所产生的副产物醛是导致游离酶和固定化酶失活的一个重要原因[20]。但固定化酶催化性能得到极大提高。一方面,磁性高分子微粒其表面多种反应性功能基团,与生物活性物质脂肪酶的亲和性较高(其机制需进一步研究);另一方面,可能是载体多孔,并且大孔较多(平均孔径171.7 nm),脂肪酶是大分子,如果载体孔径小,将会影响固定化过程中酶与载体内部的传递过程。由文献[21-23]发现,孔径较大的MCF(15.3 nm)的酶固定化比孔径小的 MCF-41(2.6 nm)效果好。黄磊等[24]以微孔陶瓷载体固定化脂肪酶,仅对部分改性条件优化的情况下,固定化酶活就已经于高贵等[25]用无孔硅藻土固定化脂肪酶的酶活相当。谭天伟等[26]大孔载体固定化假丝酵母脂肪酶,固定化酶的稳定性比游离酶有了明显提高,在催化月桂酸辛酯合成体系中反应20批次,还有60%剩余活力。

图8 游离酶和固定化酶在有机相中的操作稳定性
2.6 固定化酶的热稳定性
在 30~70 ℃范围内,考察了固定化酶在有机相中的热稳定性。如图9所示,40 ℃以下时,游离酶和固定化酶的热稳定性没有明显的差别。当温度达到50℃时,游离酶迅速失活,残余活力仅为50%左右,而磁性多孔微球固定化酶活基本没有损失。总体而言,脂肪酶ASL及固定化酶适合在40℃以下的较低温度条件下使用,但固定化酶的耐热能力较游离酶要高。

图9 游离酶和固定化酶在转酯反应中热稳定性
3 结 论
以有机相反应体系中烯丙醇酮转酯化反应为模型反应,以磁性多孔poly(MMA-co-DVB) 微球固定化脂肪酶,优化了固定化酶制备条件,考察了其操作稳定性。研究表明通过磁性多孔poly(MMA-co-DVB) 微球固定化脂肪酶能够较好地解决传质问题,其催化性能得到有效提高。这种新型的磁性多孔材料通过悬浮聚合,制备简单,易于大规模生产,首次用于固定化脂肪酶ASL,并成功应用于有机相中的转酯化反应,其操作稳定性极好,分离简便,有较好的应用前景。
[1]Curtis A,Wilkinson C. Nantotechniques and approaches in biotechnology[J].Trends Biotechnol.,2001,19(3):97-101 .
[2]Huang S H,Liao M H,Chen D H. Fast and efficient recovery of lipase by polyacrylic acid-coated magnetic nano-adsorbent with high activity retention[J].Sep. Puri. Technol.,2006,51(2):113-117.
[3]Bai S,Guo Z,Liu W,et al. Resolution of(±)-menthol by immobilized Candida rugosa lipase on superparamagnetic nanoparticles[J].Food Chemistry,2006,96(1):1-7.
[4]Liu X Q,Guan Y P,Shen R,et al.Immobilization of lipase onto micron-size magnetic beads[J].J. Chromatogr. B,2005,822:91-97.
[5]Chang S Y,Zheng N Y,Chen C S,et al. Analysis of peptides and proteins affinity-bound to iron oxide nanoparticles by MALDI MS[J].J. Am. Soc. Mass Spectrom.,2007,18:910-918.
[6]Hsiao H H,Hsieh H Y,Chou C C,et al. Concerted experimental approach for sequential mapping of peptides and phosphopeptides using C18-functionalized magnetic nanoparticles[J].J. Proteome Res.,2007,6(4):1313-1324.
[7]Ito A,Ino K,Kobayashi T,et al.The effect of RGD peptide-conjugated magnetite cationic liposones on cell growth and cell sheet harvesting[J].Biomaterials,2005,26(31):6185-6193.
[8]Josephson L,Tung C,Melder R,et al. High efficiency magnetic cell labeling through tat-peptides[J].Bioconjugate Chemistry,1999;10:186-191.
[9]Zhao M,Beauregard D A,Loizou L,et al. Non-invasive detection of apoptosis using magnetic resonance imaging and a targeted contrast agent[J].Nat. Med.,2001,7(11):1241-1244
[10]Perez JM,Josephson L,ÒLoughlin T,et al. Magnetic relaxation switches capable of sensing molecular interactions[J]Nat. Biotechnol.,2002,20:816-820.
[11]Dong-Geun L,Kanagasabai M,Ponvel,et al. Immobilization of lipase on hydrophobic nano-sized magnetite particles[J].Journal of Molecular Catalysis B:Enzymatic,2009,57:62-66.
[12]Dyal A,Loos K,Noto M,et al. Activity of candida rugosa lipase immobilized onç-Fe2O3magnetic nanoparticles[J].J. Am. Chem. Soc.,2003,125(7):1684-1685.
[13]刘薇,白姝,孙彦. 磁性纳米粒子的制备及脂肪酶的固定化[J]. 过程过程学报,2004,4(4):362-366.
[14]孟繁宗,王东来,瞿玉春. 荧光磁性双功能Fe3O4@PHEMA-Tb微球的制备及其蛋白固定化[J]. 过程工程学报,2009,91(1):101-106.
[15]吴侠,韩玉顺,曹敏花,等. α-胰凝乳蛋白酶在相转移Fe3O4纳米粒子表面的固定化[J]. 高等学校化学学报,2010,11(1):11-15.
[16]Liu X Q,Guana Y P,Shen R,et al. Immobilization of lipase onto micron-size magnetic beads[J].J. Chromatogr. B,2005,822:91-97.
[17]Yang G,Wu J P,Xu G,et al. Enhancement of the activity and enantioselectivity of lipase in organic systems by immobilization onto low-cost support[J].J. Mol. Catal B:Enzymatic,2009,57:96-103.
[18]李南薇,吴虹,宗敏华,等. 固定化扩展青霉脂肪酶的制备及其在玉米油转酯反应中的应用[J]. 催化学报,2007,28(4):333-338.
[19]Yang Z,Zacherl D,Russell A J. The mechanistic dissection of the plunge in enzymatic activity upon transition from water to anhydrous solvents[J]J. Am. Chem. Soc.,1993,115:12251-12257.
[20]Matsumae H,Furui M ,Shibatani T. Lipase-catalyzed asymmetric hydrolysis of 3-phenylglycidic acid ester,the key intermediate in the synthesis of diltiazem hydrochloride[J].J.Ferment.Bioeng.,1993,75(2):93-98.
[21]Tomohiko A,Kazuki N,Kazuyuki H,et al. Monolithic periodic mesoporous silica with well-defined macropores [J].Chem. Mater.,2005,17:2114-2119.
[22]Gomez J M,Deere J,Goradia D,et a1. Transesterification catalyzed by trypsin supported on MCM-41 [J].Cata1. Lett.,2003,88:l83-l86.
[23]Pandya P H,Jasra R V,Newa B L,et a1. Studies on the activity and stability of immobilized a-amylase in ordered mesoporous silicas[J].Microporous Mesoporous Mater.,2005,77:67-77.
[24]黄磊,程振民. 微孔陶瓷固定化酶载体的合成[J]. 化工学报,2006,57(4):912-9l8.
[25]高贵,韩四平,王智,等.硅藻土固定化脂肪酶[J].吉林大学学报:理学版,2002,40(7):324-326.
[26]蔡宏举,付大雁,王满意,等. 大孔载体固定化脂肪酶[J]. 过程工程学报,2007,7(4):773-777.
Immobilization of lipase on magnetic porous microspheres
TAO Weihong,YANG Lirong,XU Gang,TAI Yulei,WANG Li,WU Jianping
(Department of Chemical and Biological Engineering,Zhejiang University,Hangzhou 310027,Zhejiang,China)
The immobilization ofArthrobactersp.lipase on magnetic porous microspheres was investigated. The magnetic porous microspheres was characterized with FTIR,XRD,SEM,TEM,
BET,TGA and VSM,and the effect of immobilization time,pH,and lipase amount on the catalytic performance of the immobilized lipase in an organic system was studied. The results showed that the core of microsphere was Fe3O4,the surface was porous,the surface area of microsphere was 12.16 m2/g,average pore diameter was 171.7 nm,its magnetic content was 38% and it was super-paramagnetic. The optimal immobilization conditions were determined to be pH 8.0 with the lipase/carrier ratio of 1 to 1(m/m)and immobilization time of 6 h. The activity recovery was as high as 2.4 fold of the free lipase in the resolution of 4-hydroxy-3-methyl-2-(2-propenyl)-2-cyclopenten-1-one. Furthermore,the operational stability of the immobilized enzyme was greatly enhanced compared to the free enzyme. The residual activity was kept at 74.5% after 30 batch reactions,while that of the free enzyme was just 37.1% after 7 batch reactions.
magnetic porous microspheres;Arthrobactersp.lipase;immobilization;tyransesterification
Q 814.2
A
1000–6613(2011)07–1584–07
2011-01-11;修改稿日期:2011-02-07。
国家自然科学基金重点项目(20936002)、国家高技术研究发展计划(国家 863 计划,2010AA101502),国家重点基础研究发展计划(国家 973 计划,2011CB710805)及国家科技支撑计划重点项目(2008BAI63B07)。
陶维红(1985—),男,硕士研究生。联系人:吴坚平。E-mail wjp@zju.edu.cn。

