稀土氨基酸希夫碱配合物的合成及其荧光性能
章文军,张 静,苑志忠
(河北工业大学化工学院,天津 300130)
研究开发
稀土氨基酸希夫碱配合物的合成及其荧光性能
章文军,张 静,苑志忠
(河北工业大学化工学院,天津 300130)
以L-苯丙氨酸和邻香兰素为原料,合成了L-苯丙氨酸缩邻香兰素希夫碱配体及其稀土金属(铽、铕)配合物。经元素分析、红外光谱、紫外光谱分析,确定配合物的组成分别为[Tb2(H2O)2(SL)4](NO3)2和[Eu2(H2O)2(SL)4](NO3)2(SL=C17H17O4N)。用荧光光谱研究了配体和配合物的光物理性能。结果表明,配体和配合物都具有较强的荧光性能;配合物具有良好的热稳定性(分解温度达580 ℃)。
L-苯丙氨酸;希夫碱;邻香兰素;荧光性能
氨基酸是人体细胞生长所必须的,它与活性羰基缩合而成的Schiff碱可能运载抗癌基团到癌变细胞内,从而使癌细胞迅速膨胀、破裂,达到抗癌的效果。因此对于氨基酸Schiff碱及其衍生物在抑菌,抗癌方面的研究具有十分重要的意义[1-3]。近年来,人们对于氨基酸Schiff碱的合成、表征、抗菌、抗病毒的生物活性以及超氧离子自由基性能等的研究有了较高的兴趣,并取得了不错的成效[4-6]。但对于稀土氨基酸Schiff碱的研究相对较少,而稀土具有良好的配位能力和抗癌、抗凝血、降血糖的作用[7]。同时,稀土氨基酸 Schiff碱配合物,既降低了稀土的毒性,又有氨基酸的活泼基团[8],因此研究稀土氨基酸 Schiff碱配合物具有重要的生物及医药学意义。作者制备了一种氨基酸希夫碱配体及两种希夫碱稀土配合物,考察了其荧光性能和热稳定性。
1 实验部分
1.1 仪器与试剂
仪器:德国Bruker公司的 Vector22型傅里叶红外光谱仪;荧光光谱仪(Edinburgh FS920P分光计);Hitachi的 U-3400型紫外可见分光光度计;DDS-11C数显电导率仪;美国PE公司PE2400Ⅱ型元素分析仪。
试剂:邻香兰素(2-羟基-3-甲氧基-苯甲醛),化学纯;L-苯丙氨酸、无水乙醇、氢氧化钾、Tb(NO3)3·6H2O、Eu(NO3)3·6H2O等均为分析纯试剂。
1.2 2-羟基-3-甲氧基-苯甲醛缩 L-苯丙氨酸 Schiff碱(SL)的合成
取0.165 g(1 mmol)L-苯丙氨酸和0.112 g(2 mmol)KOH溶于5 mL无水乙醇中,搅拌下逐渐将溶有同样摩尔量的邻香兰素无水乙醇溶液加入到上述溶液中,溶液即变为黄色,60 ℃下回流反应2 h,有沉淀生成,过滤,乙醇洗涤3次,用无水乙醇重结晶,真空干燥,得到1.91 g黄色粉末SL,产率为71.20%,反应式为:
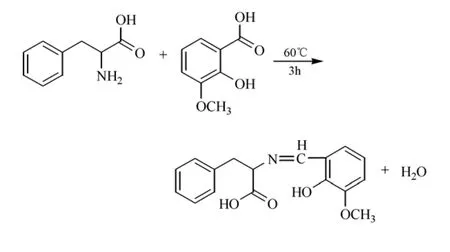
1.3 稀土(Ln=Eu,Tb)Schiff碱配合物的合成
称取2 mmol SL溶于40 mL无水乙醇中,然后缓慢加入适量0.05 mol/L的稀土硝酸盐(Eu3+,Tb3+)无水乙醇溶液,常温下磁力搅拌下反应2 h,有黄色沉淀生成,过滤,用乙醇充分洗涤,烘干,真空干燥至恒重,得到黄色固体Ln-SL。
2 结果与讨论
2.1 元素分析和摩尔电导率
稀土金属的含量采用EDTA配位滴定法测定,配合物中 Eu元素含量为 19.44%(理论值为19.47%);Tb元素的含量为 20.21%(理论值为20.19%)。配体和配合物的摩尔电导在 DMF(0.1 mmol/L)溶液中,通过 DDS-320电导率仪测定,测定结果见表1。由表1可知,SL与Ln-SL的理论计算值与元素分析结果相一致。
配体SL的摩尔电导率为17.3 S/(cm2·mol),远小于50 S/(cm2·mol) 可确定配体为非电解质体系[8]。铽和铕配合物的摩尔电导率分别为 130.4 S/(cm2·mol)和142.2 S/(cm2·mol),根据文献可确定为1∶2型电解质[9],与IR光谱表征一致。根据元素分析、摩尔电导率、红外光谱和热重分析等结果,可推测配体和配合物的组成分别为 Ln-SL= Tb2[(H2O)2(SL)4](NO3)2,Eu2[(H2O)2(SL)4](NO3)2。
2.2 红外光谱分析
以KBr压片法,对配体和配合物进行红外分析,IR数据见表2。从表2可以看出,配体在1633 cm-1处的窄而强的吸收峰,为C=N的特征吸收峰。1526 cm-1和1488 cm-1为苯环的骨架振动。而3423 cm-1处弱的宽峰,可能是由于C=N中氮原子与相邻的羟基形成了分子内氢键所致。
由表2的红外数据可以看出,配合物的C=N伸缩振动由 1633 cm-1处分别移至 1625 cm-1和1620 cm-1,红移了8cm-1和13 cm-1,说明稀土离子与配体中C=N上的氮原子发生配位。而配合物中的羟基伸缩振动峰ν(O—H)由 3423 cm-1分别移至3414 cm-1和3411 cm-1,与配体相比红移了9 cm-1和12 cm-1,这说明配体中的羟基氧原子可能参与配位。在1384 cm-1处有一强吸收峰,证明两配合物中有游离的反荷离子硝酸根[10-11],这一结果与电导率的测定结果一致。
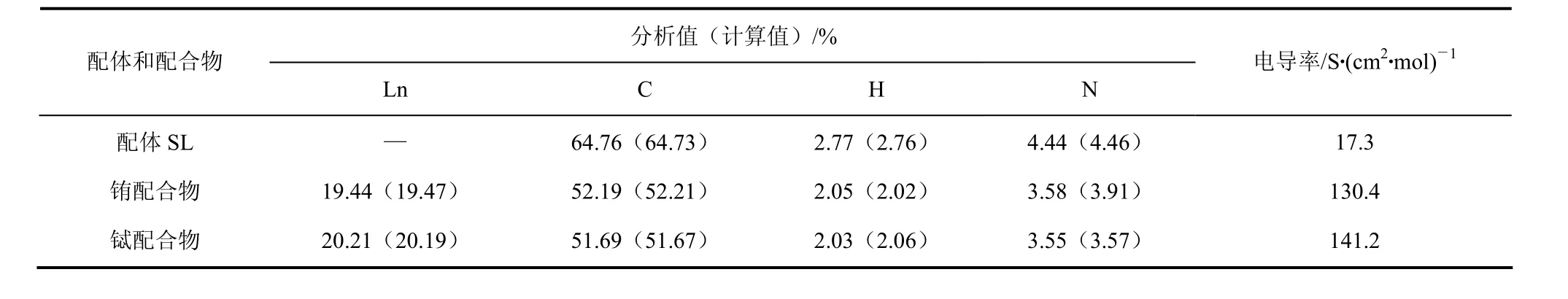
表1 配体和配合物的元素分析数据

表2 配体和配合物的IR分析数据
2.3 紫外光谱分析
将配体与配合物溶于DMF中,利用日本岛津的UV-2401PC紫外分光光度计,测定了配体与配合物的紫外-可见吸收光谱,吸收数据见表3。

表3 配体和配合物的UV分析数据
由表3可知,在264 nm处的吸收峰为芳环π-π*跃迁产生的较强的吸收谱带,在315 nm处的吸收峰为亚胺基与芳环形成的共轭体系π-π*跃迁吸收峰,在414 nm处是—C=N的n-π*跃迁的特征吸收峰。
由于亚胺基的π-π*跃迁吸收峰被n-π*跃迁吸收峰所覆盖,所以在配体中315 nm和414 nm的吸收峰,在配合物中合并为359 nm和363 nm处的一个宽而强的吸收峰,且分别蓝移了55 nm和51 nm,这说明配体中亚胺基的N参与了配位。
2.4 配体及配合物的热稳定性
分析温度为20~800 ℃范围,N2氛围,以Al2O3为参比,升温速率为10℃/min,配体及其配合物的热分析数据见图1、图2。
由图1可以看出,Tb配合物的失重可分为两个阶段进行:从100~150 ℃,配合物失重2.27%(理论值2.31%),为水分子的移去;150 ℃的吸热效应峰表明,配合物开始溶化分解,骨架坍塌,失重至580 ℃结束,失重55.02%(理论失重率54.99%)。结果表明配合物分解温度高,热稳定性较好,且配合物[Tb2(H2O)2(SL)4](NO3)2热分解的最终产物为Tb4O7,残余量42.71%。
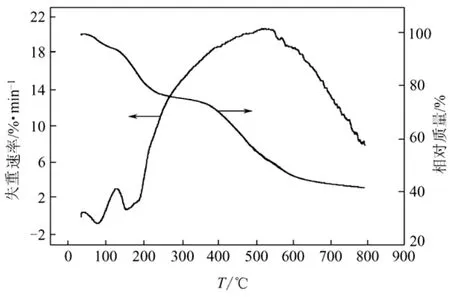
图1 Tb-SL的TG-DTA曲线
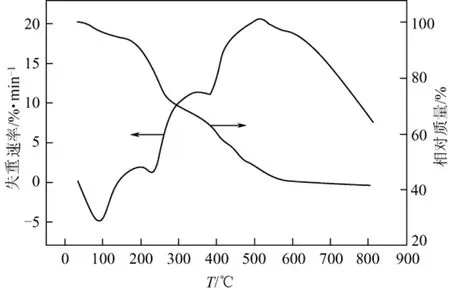
图2 Eu-SL的TG-DTA曲线
由图2可以看出,Eu配合物的失重分为3个阶段。第一个失重阶段从100 ℃开始,至160 ℃结束,失重2.29%(理论失重2.32%);该配合物从160 ℃开始分解,共分为两个阶段进行分解,160~345 ℃,失重20.36%;345~585 ℃,失重35.18%。配合物最终分解产物为Eu2O3,残余量42.17%。
2.5 配体和配合物的荧光性质
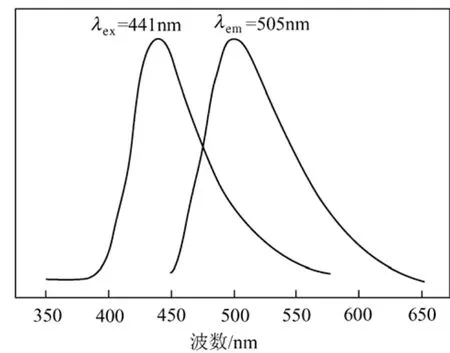
图3 SL的激发和发射光谱

图4 Ln-SL的激发和发射光谱
图3和图4分别展示了配体SL和配合物Ln-SL(Ln=Tb,Eu)的激发和发射光谱,结果表明配体和配合物均具有较强荧光。图3显示,SL的激发带位于400~510 nm,其中最佳激发带为441 nm,配体在505 nm处的发射峰最强,荧光为明亮的绿色;Tb-SL的激发带为350~440 nm,其最佳激发波长为380 nm,峰值波长为544 nm,为绿光发射。Eu配合物的最佳激发波长为 400 nm,发射峰最强的5D0→7F2(610 nm)处于红光区,因此配合物在UV254照射下,呈鲜艳的红色荧光。配合物与配体发射光谱相比,强度明显下降,其中Eu-SL强度下降更为明显,这是由配合物的能量从有机基质向稀土离子传递导致配合物有一定程意义的荧光淬灭,从而使荧光强度减弱。
3 结 论
合成了L-苯丙氨酸缩水杨醛Schiff碱(SL)和稀土配合物(Tb-SL,Eu-SL)。经过元素分析、红外光谱、紫外光谱方法表征,初步确定配合物的组成为[Tb2(H2O)2(SL)4](NO3)2和[Eu2(H2O)2(SL)4](NO3)2。荧光光谱表明,配体和配合物均具有较强的荧光性能,且配体的荧光性能好于配合物,热重分析表明配合物具有良好的热稳定性能。稀土氨基酸 Schiff碱有望在生物医药领域获得广泛的发展。
[1]Adsule S,Barve V,Chen D,et al.Novel Schiff base copper complexes of quinoline-2-carboxaldehyde as proteasome inhibitors in humanprostate cancer cells[J].J. Med. Chem.,2006,49(24):7242-7246.
[2]鲁桂,姚克敏,张肇英. 镧系与直链系-组氨酸Schiff碱配合物合成、波谱与生物活性[J]. 应用化学,2001,18(1):1-4.
[3]蔡艳华,彭汝芳,马冬梅,等. 仙人球型对羟基苯甲醛缩对氨基苯甲酸Schiff碱Cu(Ⅱ)配合物的合成[J]. 化工进展,2008,6(27):878-882.
[4]林秋月,冯旭文,胡瑞定,等. 水杨醛缩赖氨酸Schiff碱金属配合物的合成和表征[J]. 化学研究与应用,2004,l6(4):547-548.
[5]Shetye S S,Manyadeo M S,Laxmeshwar N B.Physicochemical and biological studies of Schiff bases derived from 3-phenyl salicylaldehyde [J].Research Journal of Chemistry and Environment,1999,3(1):27-30.
[6]席晓岚,黎植昌,季宇飞. 水杨醛氨基酸Schiff碱与硫酸铰配合物的研究[J]. 稀土,2002,23(2):6-8.
[7]解庆范. 2-氨基吡啶缩水杨醛及稀土金属配合物的合成及表征[J].中国稀土学报,2007,25(14):50-53.
[8]耿杰,于海佳,张海元. 稀土氨基酸配合物与核算的相互作用[J].化学进展,2009,21(5):866-871.
[9]Geary W J. Characterization of coordination compounds [J].Coord. Chem. Rev.,1971,7(1):81-122.
[10]范康年. 谱学导论[M]. 北京:高等教育出版社,2001:58-68.
[11]Li Meiying,Hu Peizhi,Zhu Wanren. Sythesis of 2,6-(substituded)pyridine derivatves using amide and imine groups[J].Chin. Chem. Letts.,2003,14(6):117-120.
Synthesis and fluorescence performance of rare earth-amino acid complexes with Schiff base
ZHANG Wenjun,ZHANG Jing,YUAN Zhizhong
(School of Chemistry,Hebei University of Technology,Tianjin 300130,China)
A Schiff base ligand,L-phenylalanine-o-vanillin,and its rare earth(Tb,Eu)complexes were synthesized. The complexes were characterized by elemental analysis,IR spectrometry,UV-vis as [Tb2(H2O)2(SL)4](NO3)2,[Eu2(H2O)2(SL)4](NO3)2(SL=C17H17O4N). The photophysical properties of the ligand and complexes were investigated by fluorescence spectroscopy. The result showed that the ligand and complexes exhibited good fluorescence,and complexes exhibited good thermal stability(decomposition temperatures reached 580 ℃).
L-phenylalanine;Schiff base;o-vanillin;fluorescence performance
O 614.33
A
1000–6613(2011)07–1598–04
2010-12-22;修改稿日期:2011-02-24。
河北省科技计划项目(基础研究)(08965110D)。
张静(1985—),女,硕士研究生。E-mail xiguaxiaomimi@ 163.com。联系人:章文军,教授。E-mail wjzhang@hebut.edu.cn。

