携带GFP发光基因人猴嵌合免疫缺陷病毒SHIV的构建及活性检测
李 悦,莎日娜,许 璇,乔文涛,邵一鸣,杨贵波
(1.南开大学艾滋病研究中心,天津 300071;2.天津市医学高等专科学校,天津 300222;3.中国疾病预防控制中心性病与艾滋病中心,北京 102211)
携带GFP发光基因人猴嵌合免疫缺陷病毒SHIV的构建及活性检测
李 悦1,莎日娜2,许 璇1,乔文涛1,邵一鸣3,杨贵波3
(1.南开大学艾滋病研究中心,天津 300071;2.天津市医学高等专科学校,天津 300222;3.中国疾病预防控制中心性病与艾滋病中心,北京 102211)
目的 获得正常感染宿主细胞并稳定表达绿色荧光的SHIV毒株,为后期建立发光SHIV/恒河猴感染模型奠定基础。方法 通过分子克隆手段,将绿色荧光蛋白基因克隆到携带HIV-1包膜蛋白的SHIV病毒全基因组中,并在细胞水平检测各毒株的感染活性及荧光蛋白表达能力。结果 得到一株可表达绿色荧光蛋白的病毒株SHIV-KB9nefGFP,并具有感染TZM-bl细胞系及猴PBMC的能力。结论 该毒株在宿主细胞恒河猴PBMC中具有一定复制能力,希望通过后续的猴体内传代实验获得毒力更强的发光病毒。
HIV-1;SHIV;模型,动物;GFP荧光蛋白;感染活性
SHIV(simian/human immunodeficiency virus),即SIV/HIV嵌合病毒,是一种通过基因重组技术置换SIV和HIV的相应基因而构建出来的人造病毒,由于携带HIV-1结构基因而表现出人类病毒的部分特征,同时能够有效的感染恒河猴[1-7]。因此,SHIV/恒河猴模型是目前评价抗艾滋药物和疫苗的常规动物模型,也为HIV-1致病机制的研究提供了平台[8,9]。
判断病毒感染机体水平的高低,需要病毒载量(viral load,VL)的检测[10,11]。数据显示机体感染早期,体内病毒的复制水平可以决定宿主的疾病进程[12]。因此初期感染时,机体中病毒侵入的组织类型及扩散程度对后期疾病进程的理解及治疗具有重要指导意义,而常规的检测手段无法达到需要的效果。最初,使用原位杂交(in situ hybridization,ISH)和免疫组化(immunohistochemistry,IHC)的方法对病毒感染后各种组织的感染情况进行分析[13,14]。然而,这些手段的灵敏度和特异性具有一定的局限且实验操作复杂,不能很好的对体内病毒感染情况实时定位和定量。我们考虑利用颜色标记物使病毒自身可以发光,进而对被感染的细胞或机体中病毒复制情况进行精确监测。
源于水母(Aequorea victoria)等海洋无脊椎动物的绿色荧光蛋白(green fluorescent protein,GFP)是一种很好的标记物。其内源荧光基团在紫外光或蓝光激发时可高效发射清淅可见的绿光,且荧光性质稳定,与其它标记物相比具有很强的优势[15]。本研究将绿色荧光蛋白基因插入携带HIV-1包膜蛋白的SHIV-KB9病毒全基因组中,构建得到可表达荧光信号的病毒株SHIV-KB9nefGFP。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒:质粒 3’SHIV-KB9、5’SHIVKB9,克隆受体菌E.coli JM109菌株均由中国 CDC性病艾滋病预防控制中心病毒免疫室保藏;质粒pEGFP-C3由南开大学分子病毒学实验室保藏。
1.1.2 细胞系:293T细胞为含有SV 40T抗原基因的人胚肾传代细胞系;TZM-bl细胞为含有 HIV-1 LTR和luc荧光素酶报告基因,并表达CD4受体和CXCR4,CCR5辅助受体的人子宫癌细胞系;恒河猴PBMC分离自新鲜的猴体抗凝全血。
1.1.3 主要试剂:PyrobestTMDNA polymerase高保真DNA聚合酶及DNA分子量标准购自Takara公司;各种限制性内切酶、碱性磷酸酶(CIP)、T4 DNA连接酶购自New England Biolabs公司;哺乳动物细胞脂质体转染试剂盒购自Invitrogen公司;SIV p27抗原检测试剂盒购自 Coulter公司;Luciferase assay system试剂盒购自Promega公司。
1.2 方法
1.2.1 外源片段GFP基因的扩增:以pEGFP-C3质粒DNA为模板,通过PCR方法扩增出包含CMV启动子和EGFP基因1.4 kb的目的片段。引物中带有用于克隆的EcoRⅤ和XbaⅠ酶切位点,上游引物为GCG GAT ATC TTA CGG GGT CAT TAG,下游引物为CGC TCT AGA TTA TAG ATC CGG TGG ATCCC。
1.2.2 3’SHIV-KB9nefGFP半长质粒的构建:为便于外源片段的插入,利用分子克隆手段在3’SHIVKB9中引入EcoRⅤ酶切位点,突变点位于nef基因起始30 bp的位置。随后将纯化的1.4 kb PCR产物用EcoRⅤ和XbaⅠ双酶切后回收,携带EcoRⅤ酶切位点的质粒载体 3’SHIV-KB9也用 EcoRⅤ和XbaⅠ双酶切回收,将目的片段和载体DNA连接后,构建出携带GFP荧光基因的半长克隆,目的克隆的大小约为8.5 kb。用PvuⅡ对目的克隆进行鉴定,筛选PvuⅡ酶切鉴定大小正确的半长SHIV克隆。
1.2.3 全长SHIV-KB9nefGFP cDNA克隆的构建:将3’SHIV-KB9nefGFP半长质粒用NotⅠ和SphⅠ双酶切,回收5.5 kb的大片段。携带SHIV另外半长基因的5’SHIV-KB9也用相同的NotI和SphⅠ双酶切,回收9.1 kb的大片段。将两个半长片段连接起来,构建成全长约14.5 kb的含有完整SHIV全基因组的 cDNA克隆(如图1所示)。用 BglⅡ对全长SHIV质粒进行鉴定,筛选酶切鉴定大小正确的全长克隆。
1.2.4 检测SHIV-KB9nefGFP荧光蛋白的表达:将鉴定正确的全长SHIV cDNA克隆转染293T细胞系40 h后,在荧光显微镜下观察绿色荧光表达情况。同时通过SIV p27试剂盒检测细胞培养上清液中核衣壳蛋白表达情况,并收集病毒上清液用于后续实验。
1.2.5 检测SHIV-KB9nefGFP克隆株的感染活性:在生物安全三级(P3)实验室中,将全长SHIV克隆转染293T细胞,48 h后收集细胞上清病毒液,过0.45 μm的滤膜,将病毒液感染生长状态良好的TZM-bl细胞系,感染 48 h后裂解细胞,加入luciferase底物上机读数,通过计算荧光强度判断克隆株感染活性。
1.2.6 SHIV-KB9nefGFP在恒河猴 PBMC中的复制:将初步筛选具有感染能力的 SHIV-KB9nefGFP cDNA克隆转染293T细胞,收集经SIV p27检测为阳性的病毒上清液,用病毒上清感染PHA刺激3 d的恒河猴PBMC细胞。PBMC被感染1 d后,用1×PBS洗细胞,以排除转染上清给实验带来的背景误差。在 PBMC 被感染的第 3、6、9、12、15、18 天,通过SIV p27核心蛋白抗原检测,测定出病毒复制的动力曲线。如果构建的重组SHIV病毒具有复制能力,即可在PBMC培养物上清液中检测到新的病毒颗粒的生成。
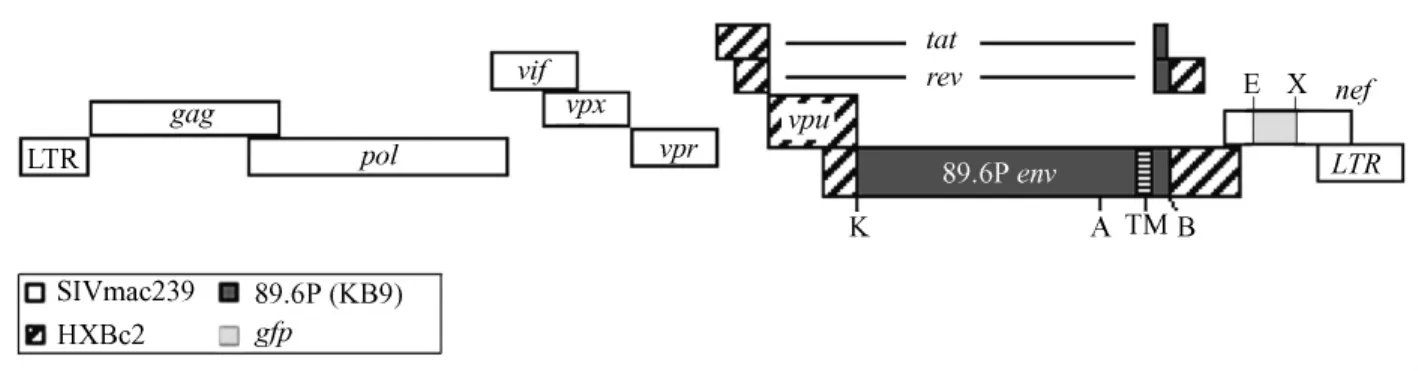
图1 SHIV-KB9nefGFP基因组结构示意图Fig.1 Illustration diagram for construction of SHIV-KB9nefGFP.The resultant construct encodes green fluorescent protein with a CMV promoter in nef gene,due to the GFP-NEF junction at the EcoRⅤ and XbaⅠ sites.
2 结果
2.1 携带发光基团SHIV-KB9nefGFP全长克隆的构建
以质粒pEGFP-C3为模板通过PCR扩增得到包含GFP基因的外源片段,并利用 EcoRⅤ和 XbaⅠ处理载体和外源基因后回收,将两种片段连接起来,构建出含有绿色荧光蛋白基因的 3’SHIVKB9nefGFP半长质粒,并通过酶切鉴定亚克隆的正确性。随后质粒用NotⅠ和SphⅠ双酶切后回收,此半长SHIV与另外5’半长 SHIV连接起来,构建出含有完整SHIV基因组的全长约14.5 kb的SHIV cDNA克隆。将所有转化子酶切鉴定,筛选大小正确的克隆株SHIV-KB9nefGFP(图2)。虽然构建了携带荧光蛋白基因的全长SHIV克隆株,但发光蛋白表达情况和病毒感染复制能力是否受影响需要进一步的活性检测。
2.2 SHIV-KB9nefGFP在293T细胞中荧光蛋白的表达
通过293T细胞转染已构建的全长质粒SHIVKB9nefGFP,48 h后收集培养上清,其中应包含大量包装出膜的病毒颗粒。同时我们利用荧光显微镜可以检测病毒在转染细胞中绿色荧光蛋白GFP的表达情况,如图3所示(见封二),图 A为转染48 h后普通日光下293T细胞状态,图B为同一视野荧光显微镜下的细胞状态。可见病毒基因组中携带的GFP蛋白可以很好的表达,使得大量转染细胞也呈现荧光。
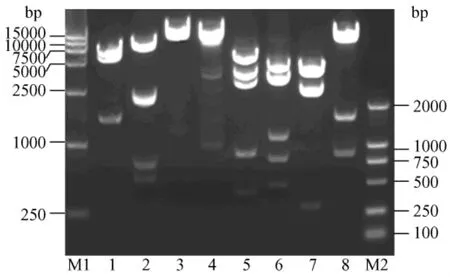
图2 SHIV-KB9nefGFP全长克隆多种酶切图谱Fig.2 Restriction analysis of full-length genome SHIV-KB9nefGFP
2.3 SHIV-KB9nefGFP在TZM-bl细胞系的感染活性和荧光蛋白表达
利用收集的293T转染上清感染TZM-bl细胞,通过病毒感染后TAT蛋白的表达,激活细胞基因组中整合的荧光素酶报告基因,进而检测病毒的感染能力。结果如图4,病毒感染后luc的激活相比本底值超过3倍,说明病毒可以感染TZM细胞,但与骨架质粒SHIV-KB9相比激活倍数明显降低,说明外源基因GFP的插入影响了SHIV病毒株部分感染活性。
同时,在荧光显微镜下观察细胞中绿色荧光蛋白的表达情况(图5,见封二))。结果显示,24 h和48 h观察TZM细胞中呈现绿色的细胞个数比例变化较小,且发光细胞整体数量较低。根据上述结果推测 SHIV-KB9nefGFP在 TZM-bl细胞系的感染活性较弱,能进入细胞的病毒颗粒不多,进而也会影响病毒中GFP在细胞中的表达量。
2.4 SHIV-KB9nefGFP在恒河猴PBMC原代细胞中的感染和复制能力
使用收集的转染病毒上清感染恒河猴PBMC后,定期收集培养上清液,通过对不同时间点病毒上清液中的p27蛋白含量的检测,判断病毒在天然受体细胞中的复制能力(图6)。与出发病毒株SHIV-KB9相比,改造后的SHIV-KB9nefGFP感染上清中p27表达明显偏低,并在感染后2周不能检测到病毒颗粒,推测插入外源基因后的SHIV病毒在细胞中的复制能力明显降低。
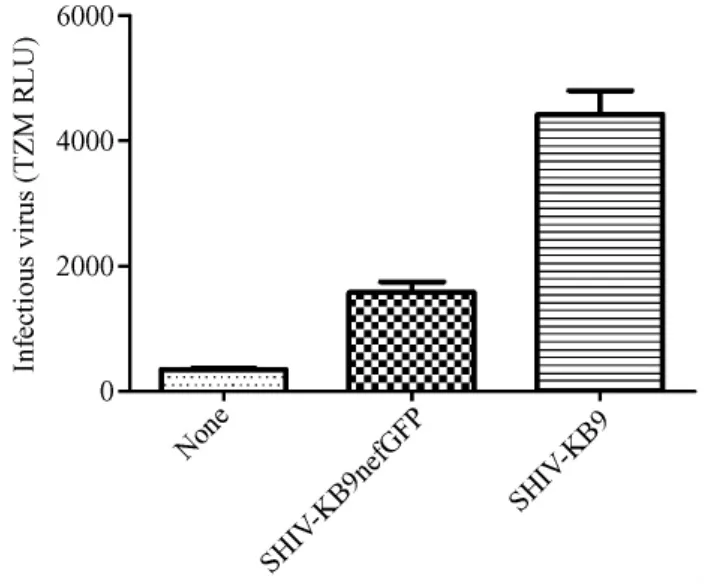
图4 SHIV-KB9nefGFP病毒感染TZM-bl细胞后荧光素酶表达量Fig.4 Luciferase content in the TZM-bl cells after infection with SHIV-KB9nefGFP
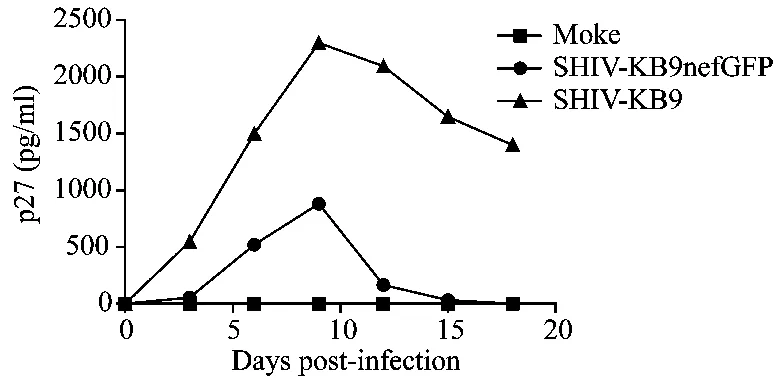
图6 SHIV-KB9nefGFP病毒在恒河猴PBMC细胞中的复制Fig.6 Replication of SHIV-KB9nefGFP in rhesus PBMCs
2.5 SHIV-KB9nefGFP在恒河猴PBMC中荧光蛋白的表达
SHIV-KB9nefGFP病毒感染恒河猴PBMC细胞后,定期在荧光显微镜下观察细胞中绿色荧光蛋白的表达情况。由于PBMC为原代细胞,病毒感染后会导致大量细胞死亡,因此培养一段时间后需要补充新鲜细胞,本实验每隔7 d补充细胞1次以确保病毒能够正常生长。我们分别在感染后第3、6、9天分别观察细胞中表达绿色荧光情况,结果显示随着病毒复制表达荧光蛋白的细胞数量有明显增加(图7,见彩插1)。结合病毒上清中 p27的定量检测结果,证明 SHIV-KB9nefGFP可以有效的感染其天然宿主细胞恒河猴PBMC,并在有限复制的过程中正常表达GFP荧光蛋白。
3 讨论
SHIV-KB9病毒可以有效感染恒河猴等灵长类动物,并且在对病毒易感的印度源恒河猴中可以诱导AIDS样疾病。因此,常常作为SHIV/恒河猴模型中的攻击毒株对候选AIDS疫苗进行评价,而且还被用于AIDS药物的评价以及HIV致病机理和免疫反应机制的研究。
绿色荧光蛋白(GFP)在激光下可发出特殊荧光,被广泛应用于生物体的定位检测中。目前国际上已经构建成功的利用荧光蛋白标记的动物免疫缺陷病毒载体只有SIVmac239,该病毒虽然能够在恒河猴体内稳定遗传,并能够清晰的检测到动物体内的病毒感染情况[16]。但由于其基因全部来源于猴免疫缺陷病毒,与HIV-1存在较大差异,因而不能很好的反应HIV-1在体内的感染特性。
本研究通过基因操作手段,将强化的绿色荧光蛋白基因(EGFP)克隆至SHIV-KB9病毒全长基因组中。通过感染实验和荧光镜下观察,确认改造后的病毒可以感染细胞并在一定时间内稳定表达GFP荧光。然而由于外源片段的插入,使病毒非结构蛋白基因nef失活,从实验结果分析,对病毒的复制功能产生了一定影响。研究显示,SIV nef基因与恒河猴宿主限制性因子BST-2作用相关,其结构的改变更易在体外表现出对病毒的抑制作用[17]。因此,SHIV-KB9nefGFP在体内的感染活性仍需进一步检测,并期望通过动物体内适应获得感染复制能力更高的发光毒株,为后期建立 SHIV-EGFP/恒河猴动物模型提供一定的物质基础。
[1] Bogers WM,Dubbes S,ten Haaft RP,et al.Comparison of in vitro and in vivo infectivity of different clade B HIV-1 envelope chimeric simian/human immunodeficiency viruses in Macaca mulatta[J].Virology,1997,236(1):110-117.
[2 ] Harouse JM,Gettie A,Eshetu T,et al.Mucosal transmission and induction ofsimian AIDS byCCR5-specificsimian/human immunodeficiency virus SHIV(SF162P3)[J].J Virol,2001,75(4):1990-1995.
[3 ] Harouse JM,Gettie A,Tan RC,et al.,Pathogenic determinants of the mucosally transmissible CXCR4-specific SHIV(SF33A2)map to env region[J].J Acquir Immune Defic Syndr,2001,27(3):222-228.
[4] Hsu M,Ho SH,Balfe P,et al.A CCR5-tropic simian-HIV molecular clone capable of inducing AIDS in rhesus macaques[J].J Acquir Immune Defic Syndr,2005,40(4):383-387.
[5] Li JT,Halloran M,Lord CI,etal. Persistentinfection of macaques with simian-human immunodeficiency viruses[J].J Virol,1995,69(11):7061-7067.
[6] Luciw PA,Pratt-Lowe E,Shaw KE,et al.Persistent infection of rhesus macaques with T-cell-line-tropic and macrophage-tropic clones of simian/human immunodeficiency viruses(SHIV)[J].Proc Natl Acad Sci U S A,1995,92(16):7490-7494.
[7] Narayan SV,Mukherjee S,Jia F,et al.Characterization of a neutralization-escape variant of SHIVKU-1,a virus that causes acquired immune deficiency syndrome in pig-tailed macaques[J].Virology,1999,256(1):54-63.
[8] Kumar A,Lifson JD,Li Z,et al.Sequential immunization of macaques with two differentially attenuated vaccines induced long-term virus-specific immune responses and conferred protection against AIDS caused by heterologous simian human immunodeficiency virus(SHIV(89.6)P) [J].Virology,2001,279(1):241-256.
[9 ] Ui M,Kuwata T,Igarashi T,et al.Protection of macaques against a SHIV with a homologous HIV-1 Env and a pathogenic SHIV-89.6P with a heterologous Env by vaccination with multiple genedeleted SHIVs[J].Virology,1999,265(2):252-263.
[10] Taylor N,Schmid I,Egle A,et al.Initial evaluation of the Roche COBAS TaqMan HIV-1 v2.0 assay for determining viral load in HIV-infected individuals[J].Antivir Ther.2009,14(8):1189-1193.
[11] Müller J,Eis-Hübinger AM,Däumer M,et al.A novel internally controlled real-time reverse transcription-PCR assay for HIV-1 RNA targeting the pol integrase genomic region[J].J Virol Methods,2007,142(1-2):127-135.
[12] Lifson JD,Nowak MA,Goldstein S,et al.The extent of early viral replication is a critical determinant of natural history of simian immunodeficiency virus infection[J].J Virol,1997,71:9508-9514.
[13] Sasseville VG,Du Z,Chalifoux LV,et al. Induction of lymphocyte proliferation and severe gastrointestinal disease in macaques by a nef gene variant of SIVmac239[J].Am J Pathol,1996,149:163-176.
[14] Lackner A,Vogel P,Ramos R,et al.Early events in tissues during infection with pathogenic (SIVmac239) and nonpathogenic(SIVmac1A11)molecular clones of SIV[J].Am J Pathol,1994,145:428-439.
[15] Zhang J,Campbell RE,Ting AY,et al.Creating new fluorescent probes for cell biology[J].Nat Rev Mol Cell Biol,2002,3(12):906-918.
[16] Alexander,Veazey RS,Czajak S,et al.Recombinant simian immunodeficiency virus expressing green fluorescentprotein identifies infected cells in rhesus monkeys[J].AIDS Res Hum Retroviruses,1999,15(1):11-21.
[17] Jia B,Serra-Moreno R,Neidermyer W,et al.Species-specific activity of SIV Nef and HIV-1 Vpu in overcoming restriction by Tetherin/BST2[J].Plos Pathogens,2009,5(5):e1000429.
Construction and Characterization of a New SHIV Clone Carrying GFP Gene
LI Yue1,SHA Ri-na2,XU Xuan1,QIAO Wen-tao1,SHAO Yi-ming3,YANG Gui-bo3
(1.Center for AIDS Research,Nankai University,Tianjin 300071,China;2.Tianjin Medical College,Tianjin 300222;3.National Center for AIDS/STD Control and Prevention,China CDC,Beijing 102211)
Objective To engineer recombinant strains of simian-human immunodeficiency virus(SHIV)stably expressing green fluorescent protein(EGFP).A replication-competent SHIV construct containing the green fluorescent gene with the ability to infect rhesus monkeys would serve as an important tool in AIDS research.Methods A SHIV strain was constructed by inserting the EGFP genes into the nef gene of SHIV KB9.The infection activity and bright fluorescence expression of the SHIV clone was determined in vitro in TZM-bl cells and macaque PBMCs.Results Replicationcompetent virus and bright fluorescence of infected cells were obtained with one construct,in which EGFP was inserted into the SHIV nef locus.This strain was infectious to rhesus PBMC and TZM-bl cells.Green fluorescing cells were detected by direct microscopic visualization.Conclusions A recombinant and replication-competent SHIV strain expressing EGFP is engineered.It is suggested that the SHIV-KB9nefGFP could be used as a tool to directly detect infected cells and aid in the immunophenotypic characterization of these cells.
HIV-1;SHIV;Animal model;Green fluorescent protein;Infectious activity
R332
A
1671-7856(2011)02-0007-05
2010-09-29
10.3969/j.issn.1671.7856.2011.02.02
南开大学基本科研资助项目(65010681)。
李悦(1982-),女,讲师,从事分子病毒学和动物模型研究工作。莎日娜(1963-),女,副教授,从事分子病毒学研究工作。
杨贵波(1964-),男,研究员,从事动物实验和粘膜免疫学研究工作,E-mail:guibyang@public.bta.net.cn。

