RT-SHIV中国恒河猴适应株细胞水平生物学特性分析
姚 南,王 卫,丛 喆,金 光,陶 真,魏 强
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
RT-SHIV中国恒河猴适应株细胞水平生物学特性分析
姚 南,王 卫,丛 喆,金 光,陶 真,魏 强
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
目的 体外增值、制备动物感染来源的RT-SHIV病毒中国恒河猴适应株,比较PBMCs和CEMx174两种细胞制备出病毒的差异,同时用TZM-bl、CEMx174、PBMC三种细胞滴定测定病毒 TCID50。方法 用 RT-SHIV病毒静脉感染中国恒河猴,定期采血测定血浆病毒载量,当病毒载量达高峰时采血分离外周血单核淋巴细胞(PBMCs),与正常恒河猴PBMCs或CEMx174细胞共培养,定期测定培养液中的P24抗原水平,当病毒复制达高峰期时收集培养上清,分装并冻存;测定病毒RNA载量、P24抗原浓度,滴定病毒的TCID50。结果 本研究共制备了78 mL PBMCs来源的RT-SHIV病毒和85 mL CEMx174细胞来源的RT-SHIV病毒。RT基因序列和原始序列的相似度为99%,仅在第254和265位的氨基酸发现突变。RT-SHIV(PBMC)和 RT-SHIV(CEMx174)病毒载量分别为1.641×108copies/mL和 8.375×108copies/mL,P24抗原水平分别为 20.745 ng/mL和 4.28 ng/mL,TZM-bl、CEMx174、PBMC细胞测定病毒的 TCID50分别为3.16×105TCID50/mL和1×104TCID50/mL,5×102TCID50/mL和5×105TCID50/mL,5×102TCID50/mL和5×103TCID50/mL。结论 PBMCs细胞来源制备的病毒较CEMx174制备的病毒具有更高的感染性。
RT-SHIV;TCID50;细胞培养
为了筛选抗艾滋病药物及研究耐药性突变,德国科学家Klaus Uberla等于1995年首次构建了RTSHIV病毒,其主要的构建策略是以SIVmac239为主要框架,将 HIVHBc2中的 RT基因替换进去,构建出包含有 HIV-1 RT基因的 SHIV[1]。美国科学家Kelly Soderberg在 RT-SHIV的基础上将 5’LTR的tRNA-Lys3 PBS区中碱基T定点突变为C,构建出构建出感染能力更强 RT-SHIV/TC[2]。本研究旨在制备RT-SHIV/TC中国恒河猴适应株,并在细胞水平上对其生物学特性进行分析和研究,以期为今后开展抗艾滋病药物的体内外筛选及耐药性研究奠定基础。
1 材料和方法
1.1 RT-SHIV
RT-SHIV由NIH AIDS Research and Reference Reagent Program(Dr.Thomas North and Dr.Joseph Sodroski)提供。该RT-SHIV是经T-C定点突变修饰后的 RT-SHIV/TC,组织半数感染量为 3000 TCID50/mL[1-3]。
1.2 实验动物
雄性恒河猴,购自北京协尔鑫生物资源研究所(合格证编号:SCXK(京)2005-2005),实验编号G1102V,实验前体重2.35 kg,经IFA法检查排除猴免疫缺陷病毒(SIV)、猴逆转录D型病毒(SRV-1)和猴T淋巴细胞性 I型病毒(STLV-1)的感染。静脉感染RT-SHIV 200 TCID50,定期采血,检测血浆病毒载量。
1.3 RT-SHIV中国恒河猴PBMCs细胞适应株和CEMx174细胞适应株的大量制备
当病毒载量达到高峰期时,分离外周血单核淋巴细胞PBMCs,进行CD8+T细胞敲除,剩余的细胞用含丙酮酸钠、非必需氨基酸的RMPI-1640生长液培养,并用 SEB(0.5 μg/mL)、IL-2(50 U/mL)进行刺激,5%CO237℃孵育。3 d后,分别与同样处理的正常猴 CD8-PBMC细胞或 CEMx174细胞按1:1比例混合共培养。每天观察细胞病变,2~3 d测定上清液中P24抗原浓度;当上清液中P24抗原浓度大于1 ng/mL时,收集病毒,分装,液氮保存。
1.4 TZM-bl细胞滴定法
RT-SHIV用含0.5%庆大霉素的DMEM完全培养基10倍稀释,混匀后加入96孔培养板中,每孔加入 100 μL,设 4 个复孔。用含 DEAE(15 μg/mL)(Sigma,code No.D9885) 和 Indinavir(1 μmol/L)(由 NIH AIDS ResearchandReferenceReagent Program提供)的DMEM完全培养基调整TZM-bl细胞浓度为 1.5 ×105个/mL,每孔加 100 μL,37℃,5%CO2孵育。48 h后弃去 100 μL上清液,加入100 μL Luciferase反 应 液 (Promega,CodeNo.E2620),5 min后取150 μL裂解上清加入黑色 96孔板,读取吸光值,以细胞对照平均值的2.5倍设为感染 cutoff值,经 Reed-Muench公式计算 TCID50。
1.5 PBMC细胞滴定法
正常中国恒河猴PBMCs用高浓度的SEB(0.5 μg/mL)1640生长液预培养3 d。RT-SHIV用含低浓度SEB(0.1 μg/mL)1640生长液10倍系列稀释,混匀后96孔板中每孔加入 180 μL,再添加 20 μL刺激好的 PBMC(细胞浓度为 2×107个/mL),37℃、5%CO2中培养。每个病毒稀释度重复4~6孔。24 h后换液150 μL,以后每隔2~3 d换液1次并测定培养上清中的P24抗原水平。根据细胞生长状态,适时添加新的预刺激好的PBMCs。2周后,根据P24抗原测定结果计算TCID50。
1.6 CEMx174细胞滴定法
RT-SHIV用1640完全培养基10倍系列稀释,混匀后于96孔板中每孔加入180 μL病毒稀释液,再添加20 μL细胞(细胞浓度为2.5×106个/mL),于37℃、5%CO2中培养。每个病毒稀释度重复4~6孔。24 h后换液150 μL,以后每隔2~3 d换液1次,观察并记录细胞病变情况。根据阳性率计算TCID50。
1.7 RT-SHIV感染恒河猴外周血病毒载量的检测
TRIzol法提取血浆中病毒 RNA,Quantitect SYBR Green RT-PCR Kit(Qiagen,204243)Roche LightCycler荧光定量仪测定血浆病毒RNA载量[4]。
1.8 RT-SHIV P24抗原水平检测
扩增病毒期间,每隔2~3 d取100 μL病毒上清利用Vironostika HIV-1 Antigen试剂盒(梅里埃)测定P24抗原含量,以大于阴性对照值0.07判定为阳性。
1.9 RT-SHIV病毒RT基因扩增
TRIzol法提取 RT-SHIV 的病毒 RNA[4],使用reverse transcriptase XL(Takara,D2620)将病毒 RNA逆转录成 cDNA,巢式 PCR扩增其 RT基因(1670 bp)。引物分别为 RT out: CAGAGGA TTTGCTGCACCTCAATTC, Anti-RT out: CAAT CCATTTGCCAAGTCCCTAGAT;RT:ATTAGCC CTAT TGAGACTGTACCA, Anti-RT: AGCACTGACTAA TTTATCTACTTG。外套扩增程序为 94℃ 5 min;94℃ 1 min,50℃ 30 s,68℃ 2 min;68℃ 10 min,30个循环;内套扩增程序为94℃ 5 min;94℃ 1 min,45℃ 30 s,68℃ 2 min;68℃ 10 min,25 个循环。
2 结果
2.1 RT-SHIV静脉感染猴G1102V血浆病毒载量的结果
感染猴G1102V在感染后10 d血浆病毒载量呈阳性,17 d达到2.102×106copies/mL,21 d为1.793×106copies/mL。采集21 d的 EDTA抗凝血进行RT-SHIV病毒的制备(图1)。
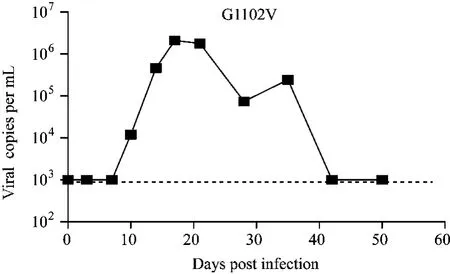
图1 RT-SHIV感染猴G1102V全血中病毒载量结果Fig.1 The viral loads in peripheral blood of G1102V infected with RT-SHIV

图3 RT基因氨基酸序列比对图Fig.3 RT amino acid sequence alignment
2.2 RT-SHIV中国恒河猴PBMCs细胞适应株和CEMx174细胞适应株的大量制备
感染猴CD8-PBMC细胞分别和正常猴CD8-PBMC细胞或CEMx174细胞合并培养。在整个培养的过程中,PBMCs和 CEMx174细胞生长状态良好,扩增病毒的过程中,两种细胞均可见明显的细胞融合现象(图2),CEMx174细胞中的融合泡要更多,更大一些。融合出现的时间在CEMx174细胞中出现的时间较早,于第4天便观察到,PBMC细胞上在第9天出现细胞融合。最终测定两种来源的RTSHIV病毒(PBMCs来源和 CEMx174来源)的 P24抗原浓度分别为20.745 ng/mL和 4.28 ng/mL,病毒载量为1.641×108copies/mL和8.375×108copies/mL。共制备了 78 mL PBMCs来源的 RTSHIV病毒和85 mL CEMx174细胞来源的 RT-SHIV病毒(图2见文后彩插3)。
2.3 RT-SHIV细胞适应株RT基因序列测定
巢氏PCR扩增病毒的RT基因并送公司测序。测序结果显示PBMCs来源和CEMx174来源的RTSHIV细胞适应株中的RT基因与HIV-1HXB2(NCBI Accession No:K03455.1)的 RT基因的碱基相似度均为99%。碱基翻译成氨基酸的序列比对中发现,两种来源的RT-SHIV其编码第178位和189位(在整个RT基因编码的氨基酸中为第254位和265位的氨基酸)的氨基酸有发生改变,分别产生的氨基酸变化为E(谷氨酸)-K(赖氨酸),T(苏氨酸)-I(异亮氨酸)。在 http://sable.cchmc.org/网站上对该突变病毒的二级结构进行预测,发现这两个氨基酸对突变对RT酶的结构和表达不产生影响(图3)。
2.4 RT-SHIV病毒滴定结果
TZM-bl滴定过程中1:102及以上滴度能观察到TZM-bl细胞的明显细胞病变现象。CEMx174细胞进行病毒TCID50滴定,可观察到细胞的融合现象,PBMC来源的病毒于第2天便出现了病变,最高病变出于1∶105。CEMx174来源的病毒于第5天出现病变,最高病变出到1∶102。PBMC滴定的过程中未发现病变。具体滴定结果见表1。
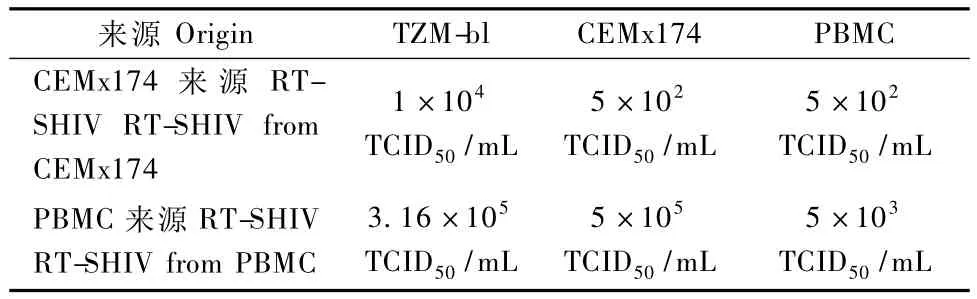
表1 RT-SHIV病毒滴定结果Tab.1 Results of virus titration of RT-SHIV
3 讨论
目前使用的RT-SHIV/TC病毒是由Klaus Uberla.构建出来,Kelly Soderberg.在此基础上改造而成的替换进HIV-1 RT基因的嵌合病毒。本研究使用的病毒是由美国NIH申请而来。RT-SHIV病毒在药物体内体外筛选,耐药性突变研究以及杀微生物剂等方面的应用较为广泛。
CEMx174是由 T淋巴细胞干细胞系 CEMR.3和B淋巴细胞干细胞系721.174杂交而成的细胞系[5],由于细胞系的稳定性使之适用于 AIDS相关病毒的研究,CEMx174细胞表面主要含有 CXCR4受体和其他辅助受体[6],用他进行研究存在一定的局限性。RT-SHIV感染CEMx174细胞的机制和SIVmac239感染此细胞的机制相似,这是由于 RTSHIV 辅助受体决定基因 env[7]来源于SIVmac239[1],他 们 可 能 是 通 过 CCR2、BOB(GPR15)、Bonzo(STRL33)或者 GPR1等受体与细胞表面结合而感染细胞[8]。国外文献报道大量扩增 RT-SHIV病毒使用的细胞均为 CEMx174[9]。PBMCs为外周血单核淋巴细胞,是含有单个圆核的所有血细胞的综合,其主要包括淋巴细胞,单核细胞和巨噬细胞,这些细胞是免疫系统的重要组成部分,PBMCs细胞扩增病毒是另外一种常规扩增病毒的方法,从中国恒河猴中分离出的猴PBMCs细胞中含有SHIV感染的宿主细胞CD4+T淋巴细胞,而且细胞上CCR5,CXCR4和其余的一些辅助受体都存在,这点注定他能扩增所有的 SIV/SHIV病毒。用来进行扩增的PBMCs细胞需要经过磁珠分选敲除CD8+细胞的预处理,用以消除T淋巴细胞对病毒的免疫作用,使病毒能够更快的感染细胞复制出病毒。两种细胞制备出的RT-SHIV主要区别在于病毒的包膜蛋白来源不同,我们期望研究该膜蛋白的不同来源对病毒的感染能力的影响。结果显示,P24抗原水平检测中发现PBMCs来源的病毒的抗原数是CEMx174来源的4.8倍,分别为20.745 ng/mL和4.28 ng/mL,对两种病毒的病毒载量进行测定发现CEMx174来源的病毒单位体积内的病毒核酸量较高,对两种病毒的TCID50进行滴定的过程中发现PBMCs来源的病毒中的活病毒无论数量还是毒力均处于较高的水平,其在TZM-bl细胞和PBMC滴定中高于 CEMx174来源病毒的10倍,在CEMx174细胞滴定过程中也较后者先出现明显病变,滴定也高103。因而我们可以得出结论在相同的条件下使用PBMCs细胞制备的病毒毒力较CEMx174细胞制备出的强。包膜来源于PBMC的感染细胞能力较来源于CEMx174的要强,这其中的机理有待我们进一步的研究。两种方法比较我们可以知道,使用 CEMx174制备病毒的过程比较简单,主要原因是CEMx174为稳定的细胞株比较好培养,而PBMC的培养比较繁琐。对病毒毒力要求不是很高的情况下,比如进行细胞学方面实验我们可以考虑用CEMx174细胞来进行病毒的制备。
该次对RT-SHIV病毒的TCID50滴定使用了三种不同的细胞,TZM-bl来源于Hela细胞,其表面表达CD4受体,CXCR4和CCR5辅助受体并携带HIV LTR控制的Luc。当SHIV感染TZM细胞时,表达Tat蛋白,HIV-1 tat蛋白激活荧光素酶基因上游的 LTR,增强 luciferase表达[10]。通过检测 TZM细胞中luc的表达情况,可以确定病毒感染和复制的效率。CEMx174细胞也一种稳定的细胞系,CXCR4嗜性的病毒感染该种细胞后能表现出明显的细胞病变的融合现象,我们可以通过观察细胞病变情况来确定其感染情况,必要时也可以通过测定P24辅助判断。PBMC细胞从中国恒河猴全血细胞中分离而来,进行病毒滴定的PBMC细胞要求不要敲出其CD8+细胞,因为要模拟中国恒河猴感染病毒的情况。观察这三种滴定方法我们可以看到使用TZM-bl细胞进行滴定的值最为精确,由其滴定出的结果具有国际通用性,使用CEMx174细胞进行滴定存在一定的主观性和局限性,而使用PBMC进行滴定最能够模拟中国恒河猴的感染情况,滴定出的结果在感染动物时最具有参考价值,为进行疫苗等相关的实验具有很大的借鉴作用。就RT-SHIV的两种病毒滴定三种细胞滴定出的结果存在一致性,都表现出PBMC来源的病毒较CEMx174来源的病毒具有更高的感染性。但每种细胞表现出的滴度高低具有一定的出入,证明不同来源的相同病毒对这三种细胞的感染能力不同。以后开展相关实验需用实验用细胞进行滴定,可使结果更加可行准确。
[1] Uberla K,Stahl-Hennig C,Bottiger D,et al.Animal model for the therapy of acquired immunodeficiency syndrome with reverse transcriptase inhibitors[J].Proc Natl Acad Sci U S A,1995,92(18):8210-8214.
[2] Soderberg K,Denekamp L,Nikiforow S,et al.A nucleotide substitution in the tRNA(Lys)primer binding site dramatically increases replication of recombinant simian immunodeficiency virus containing a human immunodeficiency virus type 1 reverse transcriptase[J].J Virol,2002,76(11):5803-5806.
[3] North TW,Van Rompay KK,Higgins J,et al.Suppression of virus load by highly active antiretroviraltherapy in rhesus macaques infected with a recombinant simian immunodeficiency virus containing reverse transcriptase from human immunodeficiency virus type 1[J].J Virol,2005,79(12):7349-7354.
[4] 丛喆,李兆忠,魏强,等.SYBR Green I实时荧光定量 RTPCR测定猴免疫缺陷病毒 RNA拷贝数方法的建立[J].中国实验动物学报,2006,14(004):271-275.
[5] Salter RD,Howell DN,Cresswell P.Genes regulating HLA class I antigen expression in T-B lymphoblast hybrids[J].Immunogenetics,1985,21(3):235-246.
[6] KirchhoffF, Pohlmann S, HamacherM, etal. Simian immunodeficiency virusvariantswith differentialT-celland macrophage tropism use CCR5 and an unidentified cofactor expressed in CEMx174 cells for efficient entry[J].J Virol,1997,71(9):6509-6516.
[7] Cormier EG,Dragic T.The crown and stem of the V3 loop play distinct roles in human immunodeficiency virus type 1 envelope glycoprotein interactions with the CCR5 coreceptor[J].J Virol,2002,76(17):8953-8957.
[8] Chen Z,Kwon D,Jin Z,et al.Natural infection of a homozygous delta24 CCR5 red-capped mangabey with an R2b-tropic simian immunodeficiency virus[J].J Exp Med,1998,188(11):2057-2065.
[9] Jiang Y,Tian B,Saifuddin M,et al.RT-SHIV,an infectious CCR5-tropic chimeric virus suitable for evaluating HIV reverse transcriptase inhibitors in macaque models[J].AIDS Res Ther,2009,6:23.
[10] Takeuchi Y, McClure MO, Pizzato M. Identification of gammaretroviruses constitutively released from cell lines used for human immunodeficiency virus research[J].J Virol,2008,82(24):12585-12588.
In Vitro Characterization of RT-SHIV Adapted in Chinese Rhesus Monkeys
YAO Nan,WANG Wei,CONG Zhe,JIN Guang,TAO Zhen,WEI Qiang
(Key Laboratory of Human Diseases Comparative Medicine,Ministry of Health;Institute of Medical Laboratory Animal Science,Chinese Academy of Medical Sciences;Key Laboratory of Human Diseases Animal Models,State Administration of Traditional Chinese Medicine,Beijing 100021,China)
Objective To propagate and titrate the adapted RT-SHIV from Chinese rhesus monkey using TZM-bl,CEMx174 and PBMCs cells,and to compare the possible difference of these viruses which propagated in PBMC and CEMx174,respectively.Methods Rhesus macaques free-living in China were infected with RT-SHIV intravenously.Blood samples were collected regularly and viral loads were monitored.Peripheral blood mononuclear cells(PBMCs)were examined when the viral load reached the peak,and were co-cultured with PBMCs from uninfected rhesus or CEMx174 cells.The P24 antigen level from supernatant was monitored regularly.The co-cultured virus was collected,packed andfrozen when the viral replication reaches the peak.The collected viruses as a stock were charactarized with the RNA viral loads,P24 antigen level and titration of TCID50.Results In this study,in tatol of 78 mL of RT-SHIV in monkeys’PBMCs and 85 mL of RT-SHIV was propagated in CEMx174 cells,respectively.The similarity between RT gene sequence and original sequence was 99%,only two mutation of amino acid at 254 and 265.RT-SHIV(PBMC)and RT-SHIV(CEMx174)viral loads were titrated with TZM-bl,CEMx174 and PBMCs,and their results were 1.641 × 108copies/mL and 8.375 ×108copies/mL.respectively,P24 antigenlevel were 20.745 ng/mL and 4.28 ng/mL,respectively,titrations of TCID50in TZM-bl,CEMx174,PBMC were 3.16×105TCID50/mL and 1×104TCID50/mL;5×102TCID50/mL and 5×105TCID50/mL;5×102TCID50/mL and 5×103TCID50/mL,respectively.Conclusions RT-SHIV propagated from PBMCs has higher infective ablity than that from the other cells in vitro.
RT-SHIV;TCID50;cell culture
R373.33;R33
A
1671-7856(2011)02-0031-05
2010-09-29
10.3969/j.issn.1671.7856.2011.02.08
“十一五”国家科技重大专项课题 (2009ZX10004-307),协和青年基金(RT-SHIV动物模型的建立)。
姚南,男,硕士研究生,从事实验动物病毒学研究工作。
魏强,教授,博士生导师,研究方向:实验动物病毒学。E-mail:weiqiang0430@sohu.com。

