发芽和提取条件对玉米胚芽中超氧化物歧化酶的诱导作用
李新华,杨翠娜,李 丹
(沈阳农业大学食品学院,辽宁 沈阳 110866)
发芽和提取条件对玉米胚芽中超氧化物歧化酶的诱导作用
李新华,杨翠娜,李 丹
(沈阳农业大学食品学院,辽宁 沈阳 110866)
为提高玉米超氧化物歧化酶(SOD)的活力和提取率,在不同条件下对玉米进行发芽处理,从发芽玉米中剥离胚芽,并在磷酸缓冲液中浸泡,再提取SOD,并测定SOD总活力。结果表明:玉米在30℃、有光照条件下发芽4d,剥离的40g胚芽在0.05mol/L 200mL磷酸缓冲液中浸泡36h,通过胶体磨研磨浸提1h,60℃热沉淀15min,用1.5倍-20℃的丙酮沉淀SOD,经Cellulose-DE-52层析,再经SephadexG-75层析,得到的玉米SOD比活力最高,为4487.28U/mg pro,比未发芽的玉米胚芽提取的SOD的比活力(924.18U/mg pro)提高了3.86倍。
玉米胚芽;发芽条件;超氧化物歧化酶(SOD);诱导作用
超氧化物歧化酶(superoxide dismutase,SOD)是1969年McCord和Fridovich发现的一种金属酶,广泛存在于动植物及微生物体内,根据其所含金属辅基的不同,主要分为3种类型:Cu-SOD、Zn-SOD、Mn-SOD和Fe-SOD;在链霉菌天蓝菌(Streptomyces coelicolor Muller)中还存在着两种新的SOD:Ni-SOD和Fe-SOD、Zn-SOD[1]。由于SOD能专一地清除超氧阴离子自由基,所以在防御氧中毒、抗辐射损伤以及防御衰老等方面起着十分重要的作用,从而使得对SOD的研究越来越引起人们的关注和重视[1-3]。我国传统工业大多从动物血液和内脏器官中提取SOD,生产工艺复杂,且在存储、运输等方面存在诸多不便,生产成本高,而且动物来源的SOD容易对人体造成过敏反应,因此人们正逐步转向通过微生物发酵和从植物中提取SOD。玉米原料来源广泛且价格低廉,从玉米中提取SOD的研究已有不少报道,但多数是以整粒玉米为原料,而且是在未萌发的休眠状态。SOD属于诱导酶,在胚芽萌发过程中酶活应处于提高阶段,因此,本实验拟通过优化玉米发芽条件,然后从分离出的胚芽中提取SOD,通过实验研究,确定玉米萌发最佳的诱导条件和提取纯化条件,为提高玉米中SOD的含量及批量提取提供参考。
1 材料与方法
1.1 材料与试剂
玉米 沈阳农业大学农学院。
SephadexG-75 美国Amersham Pharmacia公司;DE-52纤维 美国Whatman公司;超氧化物歧化酶(SOD)测试盒 南京建成生物工程研究所;考马斯亮蓝G-250国药集团化学试剂有限公司;聚乙二醇6000 中国医药集团上海化学试剂公司;丙酮 沈阳化学试剂厂。
1.2 仪器与设备
HL-2S型恒流泵、TH-300梯度混合器、SBS-100自动部分收集器、HD-21-2核酸蛋白检测仪 上海青浦沪西仪器厂;XWT-S台式记录仪 上海自动化仪表三厂;UV-1600紫外分光光度计 北京瑞利分析仪器公司;胶体磨 沈阳市黄河调压器厂; 微量进样器 上海高鸽工贸有限公司;透析袋 北京瑞尔欣德科技有限公司;Sartrius分析天平 北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 玉米发芽处理
将在室温浸泡24h后的玉米置于培养托盘中,覆盖4层湿润的纱布,在温度约30℃的温室大棚内培养,分别采用避光和日照处理,在发芽处理的不同时间分别取发芽玉米,剥取胚芽进行SOD提取实验[4]。
1.3.2 玉米SOD的提取
称取玉米胚芽40g,加入200mL pH7.8、0.05mol/L的磷酸(PBS)缓冲液,经胶体磨研磨,浸提1h并不断搅拌,用8层纱布过滤,滤液即为粗酶液。测其蛋白质含量和SOD的活性。并与未经发芽处理、直接剥离的胚芽中提取SOD进行酶活比较。
1.3.3 玉米SOD的纯化
1.3.3.1 热处理
将粗酶液60℃水浴15min,并用玻璃棒轻轻搅拌,水浴结束后将酶液立即冷却至室温,然后4℃、12000r/min离心20min,弃沉淀,取其上清液。测其蛋白质含量和SOD的活性[5]。
1.3.3.2 丙酮沉淀
测量热变性后的酶液体积,将酶液置入4℃冰浴中,加入1.5倍-20℃的丙酮沉淀SOD。丙酮要缓慢加入,并用玻璃棒轻轻搅拌,以防止丙酮局部过量以及溶液产生大量的热量,使得蛋白质变性。4℃静置2h,然后4℃、12000r/min离心20min,将沉淀用少量pH7.8的PBS缓冲液溶解,离心去沉淀。测其蛋白质含量和SOD的活性[6]。
1.3.3.3 Cellulose-DE-52层析
装柱后用3倍柱体积的pH7.8、2.5mmol/L的PBS缓冲液平衡。然后加入样液5mL,以pH7.8、2.5~200mmol/L PBS缓冲液进行梯度洗脱,流速0.5mL/min,每管收集3.5mL,并在280nm波长处自动绘制洗脱曲线,收集SOD活性峰的部分洗脱液。测其蛋白质含量和SOD的活性。用聚乙二醇6000浓缩洗脱液[7-9]。
1.3.3.4 SephadexG-75层析
装柱后,用pH7.8、2.5mmol/L的PBS缓冲液平衡柱,加入1.3.3.3节制备的浓缩液2mL,以pH7.8、2.5mmol/L PBS缓冲液进行梯度洗脱,流速0.3mL/min,每管收集3mL,并在280nm波长处自动绘制洗脱曲线,收集SOD活性峰的部分洗脱液。测其蛋白质含量和SOD的活性。用聚乙二醇6000浓缩洗脱并冷冻干燥得纯化的SOD酶蛋白[7-9]。
1.3.4 蛋白含量的测定
采用考马斯亮蓝法[10]。
1.3.5 SOD活力的测定
采用黄嘌呤氧化酶法[11]。
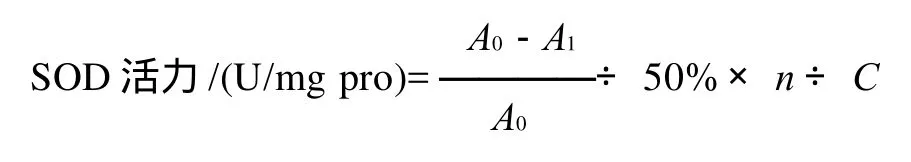
式中:A0为对照管吸光度;A1为测定管吸光度;n为反应体系的稀释倍数;C为组织中蛋白含量。
2 结果与分析
2.1 未发芽的玉米胚芽中SOD活力
从未经处理、直接剥离的胚芽中提取SOD,各步的纯化结果见表1。
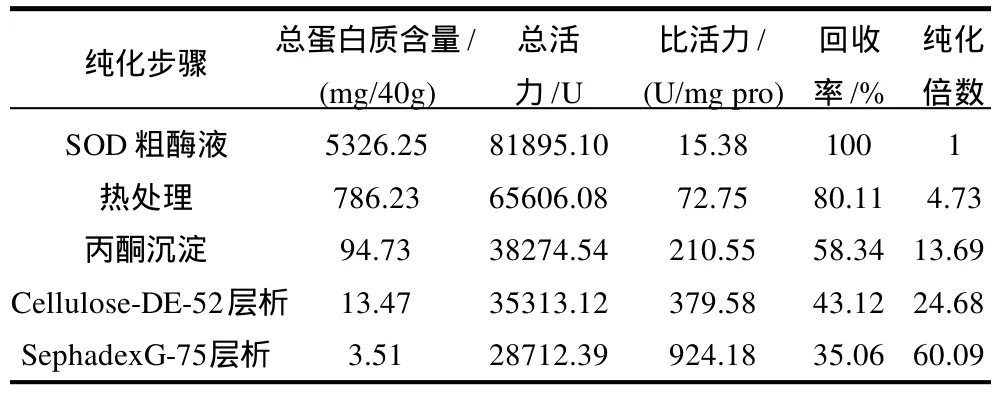
表1 玉米胚芽中SOD提取纯化结果Table 1 Summary of extraction and purification of SOD from corn germ
由表1可以看出,未发芽的玉米胚芽中SOD有一定的活力,经过提取、分离、纯化后,总酶活力有一定的损失,但回收率仍能达到35.06%,比活力能达到924.18U/mg pro,因此,目前用未发芽的玉米胚芽提取SOD的生产工艺路线具有一定的意义。
2.2 避光条件下,发芽时间对玉米胚芽中SOD活力的影响
分别测定避光条件下不同发芽时间后玉米胚芽总蛋白含量和SOD总活力,结果见图1、2。
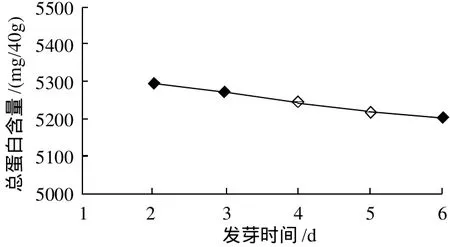
图1 避光条件下发芽时间对玉米胚芽中总蛋白含量的影响Fig.1 Effect of germination time on total protein content of corn germ
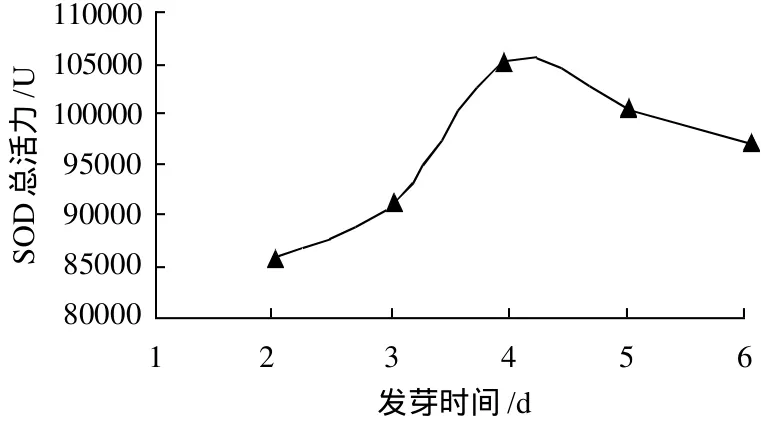
图2 避光条件下发芽时间对玉米胚芽中SOD总活力的影响Fig.2 Effect of germination time on total activity of SOD in corn germ
由图1可知,随着发芽时间的延长,总蛋白含量呈下降趋势,但下降幅度不大。由图2可知,SOD总活力逐渐增加,当发芽4d时SOD的总活力最高,超过4d后,总活力开始下降。因此,用于提取SOD时,玉米最佳发芽时间为4d。
2.3 日照条件下发芽时间对玉米胚芽中SOD活力的影响
分别测定在日照条件下不同发芽时间玉米胚芽总蛋白含量和SOD总活力,结果见图3、4。
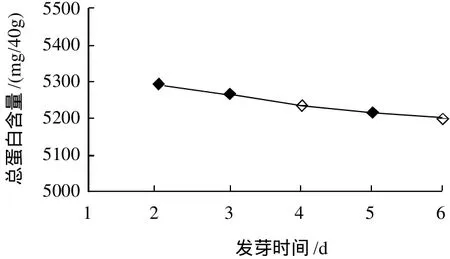
图3 光照条件下发芽时间对玉米胚芽中总蛋白含量的影响Fig.3 Effect of light illumination and germination time on total protein content in corn germ
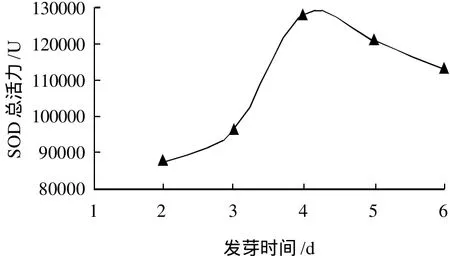
图4 光照条件下发芽时间对玉米胚芽中SOD总活力的影响Fig.4 Effect of light illumination and germination time on total activity of SOD in corn germ
由图3可知,随着光照时间的延长,总蛋白含量呈下降趋势,下降幅度不大。由图4可知,SOD总酶活力逐渐增加,当发芽时间为4d时SOD的总活力最高,超过4d后,酶活力开始下降。其原因同2.2节。由图2和图4对比可知,发芽时间相同时,接受光照的胚芽SOD总活力高于避光条件下培养的胚芽。说明光照有利于SOD的诱导,可提高胚芽中SOD的酶活力和比活力。
2.4 培养温度对玉米胚芽中SOD活力的影响
将浸泡24h后的玉米置于培养托盘中,覆盖4层湿润的纱布,分别在温室大棚内设定温度为20、25、28、30、32℃的条件下培养,均接受正常日照。分别测定不同培养温度条件下玉米胚芽总蛋白含量和SOD总活力,结果见图5、6。
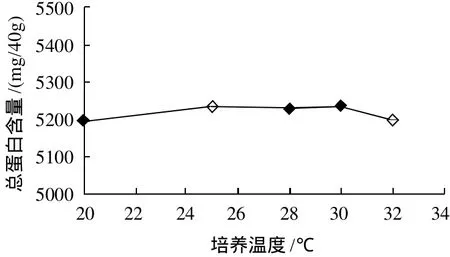
图5 培养温度对玉米胚芽中总蛋白含量的影响Fig.5 Effect of incubation temperature on total protein content in corn germ
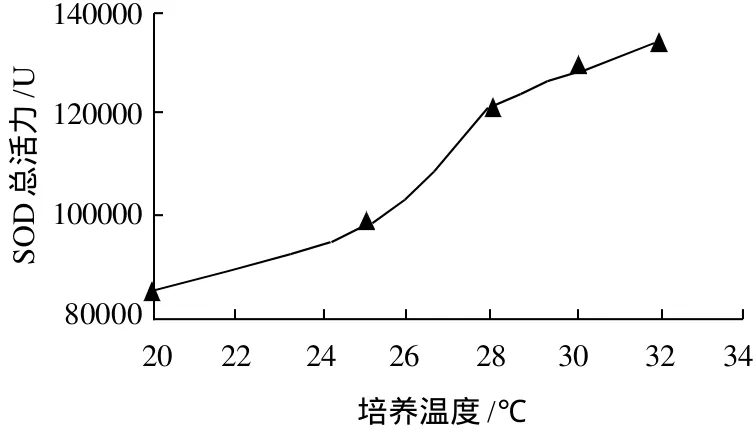
图6 培养温度对玉米胚芽中SOD总活力的影响Fig.6 Effect of incubation temperature on total activity of SOD in corn germ
由图5可知,玉米胚芽中的总蛋白含量随培养温度的变化不明显。从图6可知,随着培养温度的升高,SOD总活力呈上升趋势,尤其当温度高于25℃时,SOD总活力迅速增加。可见高温有助于玉米胚芽SOD的诱导,为了提高SOD的总活力,应该提高玉米发芽的温度。综合考虑,培养温度应该选择30℃左右。
2.5 浸泡时间对玉米胚芽中SOD活力的影响
分别取等量未发芽的玉米、避光条件下发芽的玉米和日照条件下发芽的玉米,浸泡12、24、36、48、60h后测定玉米胚芽总蛋白含量和SOD总活力,结果见图7。
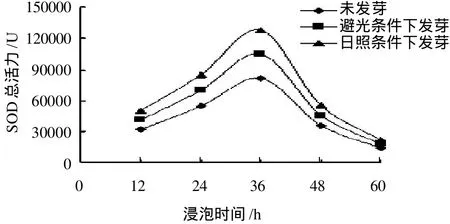
图7 浸泡时间对玉米胚芽中SOD总活力的影响Fig.7 Effect of soaking time on total activity of SOD in corn germ
由图7可知,3种玉米胚芽的SOD总活力均随着浸泡时间的延长而增加,当浸泡时间为36h时,SOD总活力达到最高,之后随着浸泡时间的延长总酶活力迅速降低。磷酸缓冲液的浸泡有助于SOD的诱导,但随着浸泡时间的延长,溶液中酸的含量逐渐升高,溶液的pH值逐渐降低,不利于SOD的浸提,因此浸泡时间应控制在36h左右。综上,磷酸缓冲液的浸泡有助于诱导SOD,但时间不宜超过36h。
2.6 最佳条件下玉米胚芽SOD提取结果
根据上述单因素试验结果,选择最佳SOD诱导条件,在光照条件下30℃发芽4d的玉米中剥离胚芽,用0.05mol/L的磷酸缓冲液将胚芽浸泡36h,然后经过胶体磨研磨、热处理、丙酮沉淀、Cellulose-DE-52层析,SephadexG-75层析,最终SOD的比活力能达到4487.28U/mg pro,比未发芽的玉米胚芽提取的SOD的比活力924.18U/mg pro提高了3.86倍。
3 结 论
3.1 未发芽的玉米胚芽中SOD有一定的活力,经过提取、分离、纯化后,总酶活有一定的损失,但回收率仍能达到35.06%,比活力能达到924.18U/mg pro。
3.2 经浸泡的玉米籽粒在光照条件下30℃发芽4d,剥离出的胚芽加入0.05mol/L的磷酸缓冲液浸泡36h。浸泡好的胚芽经胶体磨破碎研磨后,4℃下浸提1h,冷冻离心,60℃水浴15min热沉淀,用1.5倍-20℃的丙酮沉淀,Cellulose-DE-52层析,SephadexG-75层析,是玉米胚芽SOD诱导、提取、分离和纯化的最佳条件。实验结果表明,通过上述过程,40g经发芽处理的胚芽最终提取的SOD比活力为4487.28U/mg pro,比未经处理的玉米胚芽提取的SOD比活力提高了3.86倍。
[1] 袁勤生, 王凤山, 李素霞. 超氧化物歧化酶[M]. 上海: 华东理工大学出版社, 2009.
[2] 姜云, 茅力, 蔡云清. 果蔬中超氧化物歧化酶的提纯与测活技术研究进展[J]. 食品科学, 2008, 29(12): 780-785.
[3] 李东旭, 吴蕾, 任云霞. 超氧化物歧化酶的提取和纯化技术研究进展[J]. 食品研究与开发, 2008, 29(3): 183-185.
[4] 任大明, 迟乃玉, 刘少霞. 玉米超氧化物歧化酶(SOD)同工酶研究[J].玉米科学, 2001, 9(1): 78-79.
[5] 杨林莎. 蔬菜中超氧化物歧化酶的提取及活性测定[J]. 河南化工,1995(7): 8-9.
[6] 邱广亮, 李咏兰. 绿豆胚超氧化物歧化酶的纯化及性质研究[J]. 精细化学, 2000(1): 58-59.
[7] 赵华, 陶静. 玉米超氧化物歧化酶的纯化及性质研究[J]. 中国粮油学报, 2006, 21(4): 40-43.
[8] 张艳红, 文才艺, 袁勤生. 烟草业片铜锌超氧化物歧化酶的纯化和性质[J]. 湖北农业科学, 2001(6): 65-67.
[9] 俞春方. 兔血SOD提取及活性研究[J]. 西南农业大学学报, 1999, 12(1): 98-100.
[10] 施媚, 郑建新, 吕东. 纽荷尔橙内皮中SOD的纯化及部分性质研究[J]. 安徽师范大学学报, 2009, 32(4): 354-356; 372.
[11] 黎瑞珍, 杨庆建, 陈贻锐. 超氧化物歧化酶(SOD)活性的测定及其应用研究[J]. 琼州大学学报, 2004, 11(5): 34-36.
Effects of Germination and Extraction Conditions on SOD Activity in Corn Germ
LI Xin-hua,YANG Cui-na,LI Dan
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Corn germ was harvested during germination in a light or dark environment at different levels of temperature, and immersed in 0.05 mol/L phosphate buffer at pH 7.8 for different periods of time before SOD extraction and subsequent SOD activity measurement in order to explore the effects of germination and extraction conditions on SOD activity in corn germ. A maximum SOD specific activity of 4487.28 U/mg was obtained after the following operations: corn germination for 4 d under light illumination at 30 ℃, immersing of resulting corn germ in 200 mL of 0.05 mol/L phosphate buffer at pH 7.8 for 36 h, milling on a colloid miller, extraction for 1 h, thermal precipitation at 60 ℃ for 15 min, SOD precipitation from the supernatant by adding a 1.5-fold volume of -20 ℃ acetone, and sequential separation on cellulose-DE-52 and SephadexG-75 chromatographic columns, which exhibited a 3.86-fold increase in comparison with ungerminated corn germ (924.18 U/mg).
corn germ;germination condition;superoxidase dismutase(SOD);induction
S513
A
1002-6630(2011)05-0096-04
2010-05-13
李新华(1955—),男,教授,硕士,主要从事粮油加工与转化研究。E-mail:lixh.syau@163.com

