蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用
张红城,孙庆申,王光新,3,由英杰,董 捷,*
(1.中国农业科学院蜜蜂研究所,北京 100093;2.黑龙江大学生命科学学院,黑龙江 哈尔滨 150080;3.南京农业大学食品科技学院,江苏 南京 210095)
蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用
张红城1,孙庆申2,王光新1,3,由英杰2,董 捷1,*
(1.中国农业科学院蜜蜂研究所,北京 100093;2.黑龙江大学生命科学学院,黑龙江 哈尔滨 150080;3.南京农业大学食品科技学院,江苏 南京 210095)
为了研究蜂胶对餐后血糖控制机理,本实验采用体外α-葡萄糖苷酶抑制模型研究蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用,并采用Lineweaver-Burk双倒数法研究其动力学性质。结果表明,蜂胶乙醇提取物对α-葡萄糖苷酶的半数抑制浓度(IC50)为(0.8260±0.1754)mg/mL,抑制常数(KI)为(0.0265±0.0060)mg/mL。动力学研究表明,蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用为典型的非竞争性抑制。
蜂胶;α-葡萄糖苷酶;非竞争抑制
蜂胶是蜜蜂从植物新生芽孢和树干处采集的树胶,并混合自身上腭分泌物和蜂蜡而加工成的一种具有芳香气味的胶状黏性物。它不仅是蜜蜂的建筑材料还是它们抵御病源微生物入侵的化学武器[1-3]。蜂胶的化学成分是复杂多变的,不同产地甚至是同一产地的蜂胶,其化学成分存在较大差异,这主要与胶源性植物的生物多样性有关。目前,已经从蜂胶中鉴定出了300多种的化学成分,包括黄酮类、酚酸类以及其酯类、醇类、酮类、氨基酸类以及各种无机化合物[4-5]。由于蜂胶含有多种活性物质,因而具有多种生物活性,如抗氧化[6]、抑菌[7]、消炎[8]、抗病毒[9]、抗癌[10]、保肝[11]及治疗糖尿病[12]等作用。
近年来,随着生活水平的提高,糖尿病逐渐成为危害人体健康的主要疾病之一,因而,寻找有效的糖尿病治疗药物和保健食品成为该领域的研究热点。α-葡萄糖苷酶是一种能够催化α-1,4糖苷键断裂,血糖增加不可或缺的酶类,并且第三次亚太地区糖尿病治疗药物指南也将α-葡萄糖苷酶抑制剂作为降低餐后血糖的一线药物[13]。蜂胶具有降血糖的作用,但作用机理并没有深入研究[14]。特别是对α-葡萄糖苷酶的抑制作用类型未见报道过。本研究通过建立体外α-葡萄糖苷酶抑制模型,研究蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用及其抑制动力学。揭示蜂胶乙醇提取物对α-葡萄糖苷酶抑制机理,以期为蜂胶类保健食品的开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
蜂胶乙醇提取物为中国农业科学院蜜蜂研究所提供。
α-葡萄糖苷酶(α-glucosidase EC3. 2. 1. 20)、4-硝基苯-α-D-吡喃葡萄糖苷(PNPG, N1377-1G)、二甲亚砜(DMSO) 美国Sigma公司;磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O) 北京化学试剂公司;所用的所有化学试剂均为分析纯。
1.2 仪器与设备
AL204电子分析天平 中国梅特勒-托利多(上海)有限公司;UV-2550紫外-可见分光光度计(配有UV-probe处理软件) 日本岛津公司;恒温加热器 台湾Wealtec公司。
1.3 方法
1.3.1 α-葡萄糖苷酶活力的测定
采用的反应体系是参照张丽等[13]的实验方法,优化后为:磷酸缓冲液(pH 7.0 PBS)2.05mL,加入0.5mol/mL的PNPG 1mL,混合均匀后放置在37℃的恒温加热器中30min。然后取出,再加入0.1mg/mL的酶液0.7mL,迅速倒入比色皿中,在波长415nm处测定20min,每隔30s记录一次吸光度,并依据吸光度确定酶的最适添加量。
1.3.2 抑制率的测定
将蜂胶乙醇提取物用DMSO溶解并配成不同浓度,然后将实验分成4组,每组进行3次平行实验。 A:样品组:分别取不同浓度的蜂胶乙醇提取物0.1mL放入试管中,加入1.95mL PBS和1mL PNPG,37℃恒温30min。然后取出加入0.7mL酶液,立即倒入比色皿中,在波长415nm处测定其吸光度,所测时间长度及时间间隔和1.3.1节相同。B:样品对照组:用0.7mL PBS代替酶液,其他的试剂加入量和测定条件与A组相同,在波长415nm处测定其吸光度。C:对照组:用0.1mL PBS代替蜂胶乙醇提取物溶液,其他与A组相同,测定波长415nm处的吸光度。D:空白组:以0.7mL PBS代替酶液,以0.1mL PBS代替蜂胶乙醇提取物溶液,其他与A相同,测定波长415nm的吸光度。根据公式(1)计算蜂胶对α-葡萄糖苷酶的抑制率,并利用Excel计算IC50。

式中:A1、A2、A3、A4分别是上述样品组、样品对照组、对照组、空白组的吸光度。
1.3.3 酶抑制动力学
将2.0mmol/L PNPG稀释成0.5、0.6、0.8、1.2、1.6、1.8、2.0mmol/L。分别取不同浓度的PNPG 1mL放入试管中,随后加入2.05mL PBS,37℃恒温30min,之后加入0.7mL 酶溶液,立即用UV-2550紫外-可见分光光度计在波长415nm处测其时间扫描图像,并用UV-probe软件进行数据处理即可得到相应的最大速度(Vmax)和米氏常数(Km)。然后用依次用0.1mL 0.5、1.0、1.5、2.0mg/mL蜂胶乙醇提取物代替相应的PBS,进行上述的Vmax和Km测定。这样可以得到5组不同的Vmax和Km,再根据Lineweaver-Burk双倒数作图法研究抑制机理。实验每组做3次平行样。
1.3.4 抑制常数的确定
蜂胶乙醇提取物对α-葡萄糖苷酶的抑制常数通过公式(2)进行计算[15]。

式中:[I]代表的是抑制剂的浓度,而α通过公式(3)进行确定。

式中,Vmax是没有加入蜂胶乙醇提取物的最大反应速度,Vmax※是加入蜂胶乙醇提取物的最大反应速度,都可以通过上述酶抑制动力学的实验获得。
2 结果与分析
2.1 蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用

图1 蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用Fig.1 Inhibitory effect of EEP onα-glucosidase
由图1可知,在蜂胶乙醇提取物质量浓度小于1.5mg/mL的时候,随着质量浓度的增加对α-葡萄糖苷酶的抑制率增加较快,当质量浓度超过1.5mg/mL时候,抑制增加的缓慢。这可能由于随着蜂胶乙醇提取物的量增加对α-葡萄糖苷酶的抑制逐渐达到了饱和。IC50为(0.8260±0.1754)mg/mL,如果简单的从IC50上来说,其比泰国一种叫魔鬼树的树叶对α-葡萄糖苷酶的半数抑制浓度要小[16],这也说明蜂胶乙醇提取物对α-葡萄糖苷酶抑制效果要好于一些天然的α-葡萄糖苷酶抑制剂。
2.2 蜂胶乙醇提取物对α-葡萄糖苷酶的抑制常数

表1 蜂胶乙醇提取物不同质量浓度条件下的α-葡萄糖苷酶的Km和VmaxTable 1 Km and Vmax values ofα-glucosidase in the presence of different concentrations of EEP
由表1可知,α-葡萄糖苷酶的Km为(0.4588±0.0367)mmol/L,以及加入和没有加入蜂胶乙醇提取物两种情况下的Vmax值,利用上述公式可得α为(1.8953±0.0791),进而得出蜂胶乙醇提取物对α-葡萄糖苷酶的抑制常数(KI)为(0.0265±0.0060)mg/mL。
2.3 酶抑制动力学
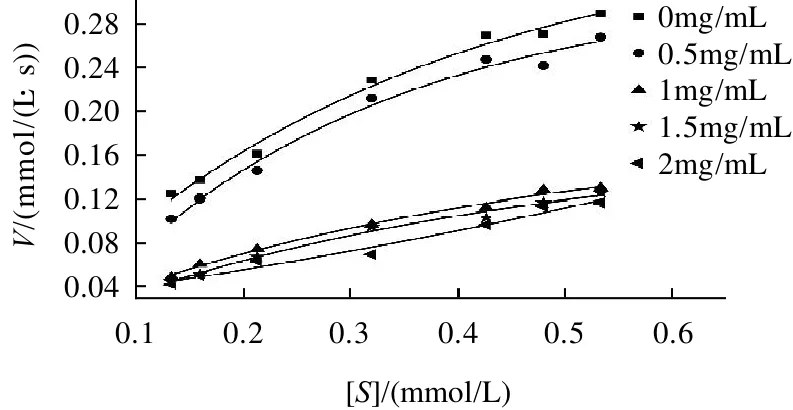
图2 蜂胶乙醇提取物对α-葡萄糖苷酶的米氏曲线Fig.2 Michaelis-Menten curve ofα-glucosidase inhibited by EEP

图3 蜂胶乙醇提取物的双倒数抑制曲线(不同底物PNPG浓度)Fig.3 Lineweaver-Burk plot of EEP towards the substrate PNPG at different concentrations
由图2可知,随着蜂胶乙醇提取物的质量浓度增大,Vmax不断的减小。但随着底物质量浓度的增加速度的变化趋势并没有改变,这可能是由于蜂胶乙醇提取物和酶结合的位点不是酶的催化中心,而是其他位点,说明蜂胶乙醇提取物对α-葡萄糖苷酶的抑制不是竞争抑制。从图3可以看到,不论蜂胶乙醇提取物的质量浓度如何变化,双倒数曲线在X轴的焦点几乎都是一点,且表1中结果也显示Km值之间不存在显著差异,因此推断蜂胶乙醇提取物对α-葡萄糖苷酶是典型的非竞争抑制。
现有α-葡萄糖苷酶抑制剂的降血糖作用机理表明,抑制剂往往是通过在小肠中和α-葡萄糖苷酶底物竞争性的结合到催化活性位点,来达到减少底物的分解降低血糖的目的,其作用的机理是明显的竞争性抑制[17]。但是这种抑制易受到底物浓度的影响,如果存在高浓度的底物的时候这种抑制将变的非常小,甚至达不到抑制的效果。因此当使用这些竞争性抑制剂控制餐后血糖时,也同时要求必须控制饮食。而蜂胶乙醇提取物对α-葡萄糖苷酶的抑制是典型的非竞争抑制,可以不受到底物浓度的影响,这比竞争性抑制剂将更加有利于控制糖尿病人的餐后血糖。
3 结 论
蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用明显,抑制率随着蜂胶乙醇提取物质量浓度的增加而不断变大,IC50为(0.8260±0.1754)mg/mL,KI为(0.0265±0.0060)mg/mL。表明蜂胶乙醇提取物对α-葡萄糖苷酶具有很好的亲和作用,可以有效抑制α-葡萄糖苷酶的活性。此外,其对α-葡萄糖苷酶的抑制机理是非竞争性抑制,可以不受底物浓度的影响,这使得蜂胶乙醇提取物有望成为新一代α-葡萄糖苷酶抑制剂,为开发利用蜂胶资源提供理论依据。
[1] BURDARK G A. Review of biological properties and toxicity of bee propolis[J]. Food Chem Toxical, 1998, 36: 347-363.
[2] BANSKOTA A H, TEZUKA Y T, KADOTA S. Recent progress in pharmacological research of propolis[J]. Phytother Res, 2001, 15: 561-571.
[3] BHADAURIA M, NIRALA S K, SHUKLA S. Duration-dependent hepatoprotective effects of propolis extract against carbon tetrachloride–induced acute liver damage in rats[J]. Advances in Natural Therapy,2007, 24: 1136-1145.
[4] SHENG Jianchun, ZHOU Jing, WANG Lin, et al. Antioxidant activity of ethanol and petroleum ether extracts from Brazilian propolis[J]. Eur Food Res Technol, 2007, 225: 249-253.
[5] BANKOVA V, CASTRO S L, MARCUCCI M C. Propolis: recent advances in chemistry and plant origin[J]. Apidologie, 2000, 31: 3-15.
[6] RUSSO A, LONGO R, VANELLA A. Antioxidant activity of propolis:role of caffeic acid and phenethyl ester and galangin[J]. Fitoterapia, 2002,73(Suppl 1): S21-S29.
[7] AL-WAILI N S. Clinical and mycological benefits of topical application of honey, olive oil and beeswax in diaper dermatitis[J]. Clin Microbiol Infect, 2005, 11: 160-163.
[8] BORRELLI F, MAFFIA P, PINTO L, et al. Phytochemical compounds involved in the anti-inflammatory effect of propolis extract[J]. Fitoterapia,2002, 73(Suppl 1): S53-S63.
[9] SCHNITZLER P, NEUNER A, NOLKEMPER S, et al. Antiviral activity and mode of action of propolis extracts and selected compounds[J].Phytother Res, 2010, 24(Suppl 1): S20-S28.
[10] EL-KHAWAGA O A, SALEM T A, ELSHAL M F. Protective role of Egyptian propolis against tumor in mice[J]. Clin Chim Acta, 2003, 338(1/2): 11-16.
[11] GONZALEZ R, CORCHO I, REMIREZ D, et al. Hepatoprotective effects of propolis extract on carbon tetrachloride-induced liver injury in rats[J]. Phytother Res, 1995, 9(2): 114-117.
[12] 郭芳彬. 蜂胶对糖尿病的疗效与作用机理探析[J]. 养蜂科技, 2004(5): 32-34.
[13] 张丽, 李彩芳, 李晓梅, 等. 加拿大蓬α-葡萄糖苷酶抑制作用[J]. 河南大学学报: 医学版, 2008, 27(4): 39-41.
[14] 董捷, 闫继红, 孙丽萍. 蜂胶复合软胶囊降糖作用的实验研究[J]. 养蜂科技, 2003(5): 2-4.
[15] 马兰戈尼. 酶催化动力学: 方法与应用[M]. 赵裕蓉, 张鹏, 译. 北京:化学工业出版社, 2007: 56-60.
[16] NIUBON J A, MEGH R B, KAWABATA J. α-Glucosidase inhibitors from Devil tree (Alstonia scholaris)[J]. Food Chemistry, 2007, 103:1319-1323.
[17] XIAO S Z. α -Glucosidase inhibitor[J]. Journal of Japanese Medicine,1999, 20(1): 22-24.
Inhibitory Effect of Ethanol Extract from Propolis onα-Glucosidase
ZHANG Hong-cheng1,SUN Qing-shen2,WANG Guang-xin1,3,YOU Ying-jie2,DONG Jie1,*
(1. Bee Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100093, China;2. College of Life Science,Heilongjiang University, Harbin 150080, China;3. College of Food Science and Technology, Nanjing Agricultural University,Nanjing 210095, China)
In order to explore the mechanism by which propolis controls postprandial blood glucose, the inhibitory effect of ethanol extract from propolis (EEP) on α-glucosidase was evaluated by using α-glucosidase inhibition model in this paper.Inhibitory kinetic parameters were determined by Lineweaver-Burk plot. The results indicated that the median inhibitory concentration (IC50) of EEP was (0.8260 ± 0.1754) mg/mL and the inhibition constant (KI) was (0.0265 ± 0.0060) mg/mL. Kinetic analysis showed that the inhibitory mechanism of EEP on α-glucosidase was a typical noncompetitive inhibition. Therefore,propolis seems to be a healthy food choice for the adjustment of blood glucose.
propolis;α-glucosidase;noncompetitive inhibition
TS218
A
1002-6630(2011)05-0108-03
2010-06-29
国家现代农业(蜂)产业技术体系资助项目(NYCYTX-43);国家公益性行业(农业)科研专项经费项目(nyhyzx07-041)
张红城(1967—),男,副研究员,博士,主要从事功能食品与生物技术研究。E-mail:zzhc@sohu.com
*通信作者:董捷(1966—),女,研究员,硕士,主要从事功能食品与生物活性物质研究。E-mail:jiedon@126.com

