发酵法生产灵芝-蕨渣菌质可溶性膳食纤维的工艺优化
余有贵,李忠海,黄国华,李 金,周军燕
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.邵阳学院生物与化学工程系,湖南 邵阳 422004)
发酵法生产灵芝-蕨渣菌质可溶性膳食纤维的工艺优化
余有贵1,2,李忠海1,黄国华2,李 金2,周军燕2
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.邵阳学院生物与化学工程系,湖南 邵阳 422004)
为了获得发酵法制备灵芝-蕨渣菌质可溶性膳食纤维的最适工艺参数,以基质蕨渣比例、基质含水量和培养温度为因子,以可溶性膳食纤维得率为响应值,采用响应面试验设计进行试验。结果表明:可溶性膳食纤维最适制备条件为基质蕨渣质量分数84%、基质含水量为63%、培养温度27℃。在此条件下,可溶性膳食纤维得率的预测值为13.034%,验证实验所得可溶性膳食纤维得率为12.885%。回归方程的预测值和实验值差异不显著,所得回归模型拟合情况良好,达到设计要求。在本实验优化的条件下,以发酵法制备灵芝-蕨渣菌质的可溶性膳食纤维得率(12.885%)显著高于蕨渣原料的可溶性膳食纤维得率(1.733%)。
蕨渣;灵芝;发酵工艺;固体菌质;可溶性膳食纤维
膳食纤维按其水溶性可分为不溶性膳食纤维(insoluble dietary fiber,IDF)和可溶性膳食纤维(solubledietary fiber,SDF)两类,可溶性膳食纤维在许多方面具有比不溶性膳食纤维更强的生理功能[1-2]。因此,制备可溶性膳食纤维具有特别重要的意义。食用菌膳食纤维的主要成分即真菌细胞壁的主要成分,包括β-葡聚糖、几丁质、半纤维素、甘露糖等[3]。灵芝多糖在灵芝子实体和菌丝体中都存在[4],具有免疫调节[5-6]、抑制肿瘤[7-8]、延缓衰老[9]、降血脂与抗病毒[10-11]等功效。
蕨(Pteridium aquilinum var. latiusculum Underw.)为蕨科Pteridaceae蕨属Pteridium植物,在我国分布广泛[12]。利用蕨根可加工成蕨粉,大量的蕨渣被弃之不用[13]。然而,鲜见有利用灵芝菌固态发酵蕨渣制备菌质复合膳食纤维的报道。本实验以含膳食纤维丰富而可溶性膳食纤维极低的蕨渣[14]为主要原料,利用灵芝固态发酵对蕨渣膳食纤维进行改性[15],从灵芝-蕨渣菌质中提取可溶性膳食纤维。在单因素试验的基础上,采用响应面试验设计对菌质可溶性膳食纤维的发酵生产条件进行优化,为制备高产率可溶性膳食纤维提供参考。
1 材料与方法
1.1 菌种、材料与试剂
灵芝[Ganoderma lucidum(Leyss:Fr.)Karst] GL10购自广东省微生物研究所微生物菌种保藏中心。
鲜蕨(Pteridium aquilinum var. latiusculum Underw.)根采自邵阳市近郊;麸皮 邵阳市农贸市场。
耐高温α-淀粉酶、蛋白酶、淀粉葡萄糖苷酶 丹麦Novo公司;三羧甲基氨基甲烷 美国 Amresco公司;其他试剂均为分析纯。
1.2 仪器与设备
GDE-CSF型膳食纤维测定仪 意大利Velp公司;KND-HYP8型消化炉、LNK-871型凯氏定氮仪 上海纤检仪器有限公司;KSW-5-12A型马弗炉 天津市中环实验电炉有限公司;TDL-5Z型离心机 湖南星科科学仪器有限公司。
1.3 可溶性膳食纤维的制备
将鲜蕨根洗净表面泥沙,破碎、搓洗去淀粉,收集的蕨渣经沥水、60℃烘干、粉碎后,获得过80目筛的蕨渣样品。
以蕨渣为主要原料,辅以少量的麸皮和1%的石膏粉配制固体培养基,装入大试管(18.5cm×2.5cm)于121℃灭菌30min,接种灵芝菌种后在一定条件下进行培养,将灵芝培养至开始现蕾时,取出固体菌质,60℃鼓风烘干、粉碎、过80目筛,得到灵芝-蕨渣菌质粉。
取一定量的菌质粉样品,分别加入高温α-淀粉酶、蛋白酶、淀粉葡萄糖苷酶进行水解。将酶的水解醪冷却、4000r/min离心20min得到上清液,用4倍体积的95%乙醇沉淀,倾去上清液,取沉淀物在0.05MPa真空干燥2h,即可得到可溶性膳食纤维产品。
1.4 试验设计
根据基质中蕨渣比例、水分含量和培养温度等对灵芝-蕨渣菌质中可溶性膳食纤维影响的单因素试验结果,采用Box-Behnken试验设计方案,对灵芝发酵蕨渣制备菌质中可溶性膳食纤维的工艺条件进一步优化。选取基质蕨渣质量分数、基质含水量和培养温度3个主要因素,每个因素取3个水平,以灵芝-蕨渣菌质中可溶性膳食纤维得率(Y)为响应值进行响应面设计,因素水平与编码见表1。

表1 响应面试验因素水平与编码Table 1 Factors and levels in response surface design
1.5 测定指标
水分含量测定:GB/T 5009.3—2003《食品中水分的测定》;灰分测定:GB/T 5009.4—2003《食品中灰分的测定》;蛋白质测定:GB/T 5009.5—2003《食品中蛋白质的测定》;膳食纤维含量测定[16]:AOAC991.43《膳食纤维的测定》。

式中:m为SDF产品质量/g;ω为SDF产品中的SDF含量/%;m0为菌质粉样品质量/g。
1.6 模型的验证
通过响应面分析优化发酵法制备灵芝-蕨渣菌质中可溶性膳食纤维的生产条件。在优化条件下制备可溶性膳食纤维,通过比较预测值和实验值验证模型的有效性。
2 结果与分析
2.1 响应面试验结果

表2 响应面试验设计安排及结果Table 2 Response surface design scheme and experimental results
按照中心复合设计方案,安排20组处理组合,每个处理组合设3个平行样,分别测定各灵芝-蕨渣菌质中可溶性膳食纤维得率(以绝干质量为基准),结果见表2。实验数据采用SAS9.0软件进行处理[17]。
2.2 回归模型的建立
通过分析自变量和因变量得到一个在给定的范围内预测响应值的回归方程。可溶性膳食纤维得率的初步回归方程如式(1)。

对回归方程进行检验,决定系数R2=96.24%,P<0.01。

表3 回归模型方差分析Table 3 Variance analysis of the established regression equation
从表3可以看出,一次项、二次项具有极显著性(P<0.01),交互项具有显著性(P<0.05)。失拟项检验不显著(P>0.05),说明回归方程与实验结果拟合很好。
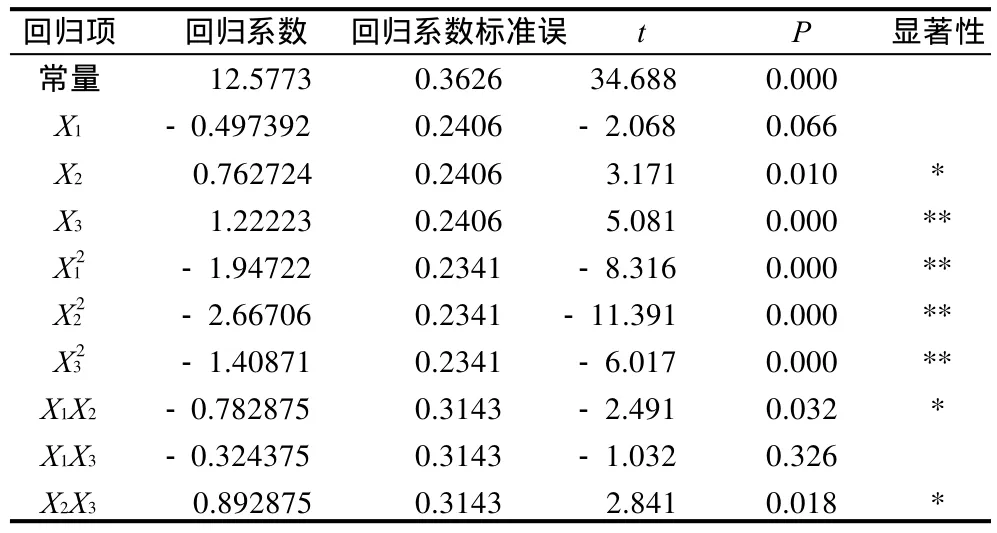
表4 回归方程各项回归系数显著性检验Table 4 Significance test for each regression coefficient of the established regression equation
对回归系数进行检验(表4)表明,X3以及X12、X22、X32的二次项对可溶性膳食纤维得率均有极显著影响(P<0.01),其中X3为正效应,而X12、X22、X32的二次项均为负效应;X1X2对灵芝-蕨渣菌质中可溶性膳食纤维得率有显著影响(P<0.05),为负效应;X2X3对灵芝-蕨渣菌质中可溶性膳食纤维得率有显著影响(P<0.01),为正效应;X1X3对灵芝-蕨渣菌质中可溶性膳食纤维得率的影响不显著(P>0.05)。经优化后的回归方程为:


经显著性检验,决定系数为R2=95.83%,P<0.01。表明自变量和因变量之间有极显著的回归关系,说明模型可用于灵芝-蕨渣菌质提取可溶性膳食纤维得率的预测,具有实际应用意义。
2.3 各因素交互作用对可溶性膳食纤维得率的影响
在回归方程式(2)中,固定一个因素在零水平上,研究另外两个因素间的交互效应,用SAS9.0编程制作出响应面和等高线图,结果见图1~3。

图1 基质蕨渣质量分数与基质含水量对可溶性膳食纤维得率影响的等高线和响应曲面Fig.1 Contour plot and response surface plot for the effects of the amounts of destarch bracken roots and water in fermentation medium on SDF yield
由图1可以看出,当把培养温度固定于零水平时,随着基质蕨渣质量分数的升高,灵芝-蕨渣菌质中可溶性膳食纤维得率呈现先上升后下降的趋势;随着基质含水量的升高,灵芝-蕨渣菌质中可溶性膳食纤维得率先快速上升然后陡然下降;曲面的最高点出现在X1∈[-0.5,0.5],X2∈[- 0.5,0.5]的区域内。


图2 基质含水量与培养温度对可溶性膳食纤维得率影响的等高线和响应曲面Fig.2 Contour plot and response surface plot for the effects of water amount in fermentation medium and culture temperature on SDF yield
由图2可见,当把基质蕨渣质量分数固定于零水平时,随着培养温度的升高,灵芝-蕨渣菌质中可溶性膳食纤维得率先迅速上升然后缓慢下降;随着基质含水量的升高,灵芝-蕨渣菌质中可溶性膳食纤维得率先迅速上升然后迅速下降;曲面的最高点出现在X2∈[-0.2,0.7],X3∈[- 0.2,1.1]的区域内。

图3 基质蕨渣质量分数与培养温度对可溶性膳食纤维得率影响的等高线和响应曲面Fig.3 Contour plot and response surface plot for the effects of the amount of destarch bracken roots in fermentation medium and culture temperature on SDF yield
由图3可见,当把基质含水量固定于零水平时,随着基质蕨渣质量分数的升高,灵芝-蕨渣菌质中可溶性膳食纤维得率先缓慢上升然后迅速下降;随着培养温度的升高,灵芝-蕨渣菌质中可溶性膳食纤维得率先迅速上升然后缓慢下降;曲面的最高点出现在X1∈[-0.7,0.5],X3∈[- 0.5,1.5]的区域内。
2.4 可溶性膳食纤维生产工艺的验证
利用SAS9.0确定各因素水平的最佳取值为X1=-0.179,X2=0.254,X3=0.513,转化为编码前的水平为:基质蕨渣质量分数84.11%,基质含水量为63.13%,培养温度27.03℃。其对应的灵芝-蕨渣菌质中可溶性膳食纤维得率响应值为13.034%。考虑到实际操作的便利,将灵芝-蕨渣菌质中可溶性膳食纤维生产工艺条件修正为:基质蕨渣质量分数84%,基质含水量为63%,培养温度27℃。从理论求得的最佳组合未包含在所设计的20个试验处理组合中,为了进一步对该生产条件进行验证,以聚丙烯塑料袋(18cm×35cm)装料(0.5kg/袋,以干料计)接种灵芝菌种,培养至现蕾时检测灵芝-蕨渣菌质中可溶性膳食纤维得率,做3次重复实验,测得灵芝-蕨渣菌质中可溶性膳食纤维得率为12.885%,误差为1.235%,与模拟值非常接近,进一步验证了模型的可靠性。
在本实验优化的条件下,采用灵芝菌对蕨渣固态发酵所制备的灵芝-蕨渣菌质可溶性膳食纤维得率(12.885%)显著高于蕨渣原料中的可溶性膳食纤维的得率(1.733%)[14]。因此,采用灵芝菌对蕨渣进行膳食纤维改性的方法是可行的,而且效果良好。
3 结 论
通过响应面试验建立的灵芝发酵蕨渣条件中基质蕨渣比例、基质含水量、培养温度与灵芝-蕨渣菌质可溶性膳食纤维得率之间的回归模型高度显著,可用于生产预测。
培养温度对灵芝-蕨渣菌质中可溶性膳食纤维得率有极显著影响(P<0.01),基质含水量对灵芝-蕨渣菌质可溶性膳食纤维得率有显著影响(P<0.05),而基质蕨渣质量分数对灵芝-蕨渣菌质中可溶性膳食纤维得率影响不显著(P>0.05);基质蕨渣质量分数与基质含水量之间的交互作用、基质含水量与培养温度之间的交互作用对灵芝-蕨渣菌质中可溶性膳食纤维得率有显著影响(P<0.05),而基质蕨渣质量分数与培养温度之间的交互作用对灵芝-蕨渣菌质中可溶性膳食纤维得率影响不显著(P >0.05)。
发酵法制备灵芝-蕨渣菌质可溶性膳食纤维时,优化的最适生产工艺条件为:基质蕨渣质量分数84%,基质含水量为63%,培养温度27℃。在此条件下,灵芝-蕨渣菌质中可溶性膳食纤维得率为12.885%,高于蕨渣原料。表明灵芝固态发酵蕨渣生产灵芝-蕨渣菌质可溶性膳食纤维的产率较高,具有良好的发展前景。
[1] THAVA V, JIANG Gaosong, JUDY Y, et al. Dietary fiber profile of barley flour as affected by extrusion cooking[J]. Food Chemistry, 2002,77(1): 35-40.
[2] 娄海伟, 迟玉杰. 挤压豆渣中可溶性膳食纤维制备工艺的优化[J]. 农业工程学报, 2009, 25(6): 285-289.
[3] MANZI P, GAMBELIL L, MARCONI S, et al. Nutirents in edible mushrooms: an inter-species comparative study[J]. Food Chemistry,1999, 65(4): 477-482.
[4] 张卫国, 刘欣, 陈永泉. 固态发酵灵芝多糖提取液中灵芝多糖的测定[J]. 现代食品科技, 2006, 22(4): 232-234.
[5] 林志彬. 灵芝的现代研究[M]. 3版. 北京: 北京大学医学出版社, 2007:32-98.
[6] LIN Y L, LIANG Y C, LEE S S, et al. Polysaccharide purified from Ganoderma lucidum induced activation and maturation of human monocyte-derived dendritic cells by the NF-Band p38 mitogen-activated protein kinase pathways[J]. Journal of Leukocyte Biology, 2005, 78(2):533-543.
[7] NONAK Y, SHIBATA H, NAKAI M, et a1. Anti-tumor activities of angle of Ganoderma lucidum in allogenic and synyeneic tumor-bearing mice[J]. Biosci Biotechnol Biochem, 2006, 70(9): 2028-2034.
[8] 江艳, 王浩, 吕龙, 等. 灵芝孢子粉多糖 Lzps-1 的化学研究及总多糖的抗肿瘤活性[J]. 药学学报, 2005, 40(4): 347-350.
[9] 王黎, 陈洁, 裴瑞, 等. 灵芝多糖对鼠失血性休克再灌注血液流变学和脂质过氧化的影响[J]. 中国中西医结台急救杂志, 2004, 11(4): 215-217.
[10] DEMIRKAYA S, TOPCUOGLU M A, AYDIN T, et a1. Malondialdehyde glutathioneperoxidase and superoxide dismutase in peripheral blood erythrocytes patients with acute cerebral ischemia[J]. Eur J Neural, 2001,8(1): 4351-4353.
[11] 韦玉芳, 王立升, 覃斐章. 灵芝型优良膳食纤维方便食品的研制[J].食品科学, 2009, 30(2): 275-278.
[12] 戴锡玲, 李新国, 吴世福. 中国食用蕨类植物名录[J]. 中国林副特产,2003, 18(4): 5-6.
[13] 曹清明, 钟海雁, 李忠海, 等. 我国蕨淀粉资源的综合开发利用[J].食品研究与开发, 2007, 28(12): 168-169.
[14] 余有贵, 李忠海, 张亚, 等. 酶法提取蕨根膳食纤维的工艺优化[J].食品与机械, 2010, 26(1): 129-132.
[15] 余有贵, 李忠海, 黄国华, 等. 响应面设计法优化蕨渣基质的灵芝培养条件[J]. 中国生物工程杂志, 2009, 29(12): 37-42.
[16] LEE S C, PROSKY L, de VRIES J W. Determination of total soluble and insoluble dietary fiber in foods-enzymatic-gravimetric methods, MESTRIS buffer collaborative study[J]. Journal of AOAC International, 1992,75(3): 395-416.
[17] 吴有炜. SAS操作入门[M]. 无锡: 江南大学理学院, 2003: 32-65.
Optimization of Solid-state Fermentation Conditions of Destarched Bracken Roots by Ganoderma lucidum for Production of Soluble Dietary Fiber
YU You-gui1,2,LI Zhong-hai1,HUANG Guo-hua2,LI Jin2,ZHOU Jun-yan2
(1. College of Food Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China;2. Department of Biological and Chemical Engineering,Shaoyang University, Shaoyang 422004, China)
Destarched bracken roots were solid-state fermented with Ganoderma lucidum and the fermentation residue was harvested and submitted to enzymatic hydrolysis and subsequent absolute ethanol precipitation to obtain soluble dietary fiber(SDF). The amounts of destarch bracken roots and water in fermentation medium and culture temperature were identified as main factors that influence SDF yield, and optimized by response surface methodology combined with central composite design.The results showed that the optimum amounts of destarch bracken roots and water in fermentation medium and culture temperature were 84%, 63% and 27 ℃, respectively. Under these conditions, the predicted and experimental values of SDF yield were 13.034% and 12.885%, respectively. The fact that they were not significantly different demonstrated that the developed regression model could experimental data well and was qualified. Moreover, the experimental value of SDF yield(12.885%) was significantly higher than the value of 1.733% obtained without Ganoderma lucidum fermentation before enzymatic hydrolysis.
destarched bracken roots;Ganoderma lucidum;fermentation process;solid-sate;soluble dietary fiber
TQ920.4
A
1002-6630(2011)05-0187-05
2010-05-18
余有贵(1964—),男,教授,博士研究生,研究方向为食品发酵技术。E-mail:yufly225@yahoo.com.cn

