光感应化合物在光控治疗中的应用
武清粉, 徐 青, 张丽萍, 刘新铭, 王玉炉,李建平, 王瑾晔,
1.河南师范大学化学与环境科学学院,新乡 453007;
2.上海交通大学生命科学与技术学院,上海 200240;
3.中国科学院上海有机化学研究所,上海 200032
光感应化合物在光控治疗中的应用
武清粉1,2, 徐 青2, 张丽萍1, 刘新铭3, 王玉炉1,李建平1, 王瑾晔2,3
1.河南师范大学化学与环境科学学院,新乡 453007;
2.上海交通大学生命科学与技术学院,上海 200240;
3.中国科学院上海有机化学研究所,上海 200032
综述了光感应化合物在以光为手段治疗疾病方面的研究和应用。介绍了光动力治疗及卟啉类和酞菁类化合物在光动力治疗中的应用现状,讨论了光动力作用中活性氧的产生机理,着重介绍了含偶氮苯基团的光感应化合物和含其它光感应材料的脂质体在光控治疗中的应用和发展,阐述了光化学内化的研究进展,并展望了光感应脂质体在光控治疗中潜在的应用价值。
光动力治疗;光感应化合物;活性氧;脂质体;光化学内化
引 言
光感应化合物 (photosensitive compound)是一类特殊化合物,在其分子中含有能够对外界光刺激 (如紫外、近红外、双光子等)做出快速响应的光敏感基元,这些基元在适当的光波作用下会发生相应的物理化学性质变化。光动力治疗 (photodynamic therapy,PDT)亦称光辐射疗法 (photoradiation therapy,PRT)或光化学疗法 (photochemo therapy,PCT)[1],是通过光辐射破坏吸收了光敏剂后的恶性组织、治疗癌症的一种光化学疗法。在光敏剂辅助的光动力治疗方法中,能吸收光子并将能量传递给其他不吸收光子的分子,引发光化学反应、破坏病变细胞的化合物称为光敏剂 (photosensitizer)。光敏剂对肿瘤组织的亲和性一般要高于正常组织,且必须受到特定波长和强度的光照射才能起效。
目前,PDT已被世界多国政府批准应用于消化道、呼吸道和体表等肿瘤的治疗,具有疗效确切、治疗选择性高和损伤少等优点[2]。在进行PDT时,病人摄取无毒或低毒光敏剂,光敏剂会选择性地富集于病灶区,然后用一定波长的光照射病灶区,光敏剂吸收光能后转变成高反应活性的活性物质,在氧的参与下与病变组织中的生物分子发生化学反应而将癌细胞杀死[3]。光疗效果与氧密切相关,许多研究表明,大多数光敏剂的光疗效果取决于单重态氧[4]。然而,其他活性物质,如超氧阴离子自由基、羟基自由基等也参与了光动力损伤的某些过程[5]。
卟啉类及酞菁类化合物
目前临床使用较多的光敏剂为血卟啉衍生物 (hematoporphyrin derivatives,HPD)或其它卟啉类药,它们具有四吡咯基结构,是PDT的核心物质。卟啉之所以能诊断和治疗癌症是由于其具有某些引人注目的性质:1)对迅速增殖的细胞起优先积聚作用,即对癌细胞有定位作用;2)当适当波长的光照射时能产生可见荧光,并能释放出单重态氧而对癌细胞起光氧化作用。
血卟啉单甲醚 (hematoporyrin monomethyl ether,HMME)是我国自主研制开发的新型光敏剂,化学名称为3-(或8-)(1-甲氧基乙基)-8-(或-3-)(1-羟乙基)-次卟啉IX,或血卟啉3-或8-单甲醚,是两种互为位置异构体的单体卟啉的异构体混合物,其化学组成稳定,具有避光时间短、单重态氧产量高、吸收波长较长、引起正常组织光毒反应的卟啉相对含量低等优点。HMME已经应用于临床一些疾病的治疗。陈光霞等[6]研究了HMME-PDT对骨髓基质细胞及K562白血病细胞的杀伤效应,结果表明,HMME-PDT可以选择性杀伤白血病细胞,有望成为安全有效的白血病骨髓净化药物。
HMME亲水性不强,在水中易团聚,影响了其生物利用率和对光的吸收;而且在表皮的残留会引起强光作用下皮肤过敏的副作用,所以通常治疗之后需避光一段时间。张慧芳等[7]尝试通过采用高分子聚合物为载体材料制备含HMME的微纳米粒子系统,来解决上述问题,以提高其肿瘤光动力治疗的靶向性。用侧基含羧基的聚-L-丙交酯-co-3-羧甲基-吗啉-2,5-二酮的两亲性共聚物为载体,采用改进的溶剂挥发法制备含HMME的微纳米粒子。以HMME与聚合物的混合物为对照,对比微纳米粒子的荧光激发光谱图可以看出,微纳米粒子的荧光激发波位置基本不变,分别在602及621 nm附近出现一大一小两个峰,所不同的只是荧光强度。通过激光闪光光解测得HMME和微纳米粒子的三线态吸收及寿命光谱图,将二者对比可以看出,相同浓度下,HMME的三线态吸收强一些,而且在450 nm波长照射下,包有HMME的微纳米粒子的三线态寿命随着HMME浓度的增加而增加,这表明该体系能够形成三线态激发,并进一步产生单线态氧,从而为达到光敏剂的光治疗效果提供可能。
虽然目前卟啉类光敏剂在临床上应用很广,但也存在着缺点,主要是其最大吸收波长不在对人体组织透过率较佳的红光区,故药效不够理想,且皮肤光毒性大[8],使其临床应用受到限制。因此开发新型的高效抗癌光敏剂一直是国内外PDT研究的热点。理想的光敏剂应具有以下特性:1)肿瘤选择性摄取率高,而且易于代谢;2)最大吸收波长应位于穿透组织能力强的红光区;3)在红光激发下三重态量子产率高,寿命长;4)对自然光吸收弱,对皮肤的光毒性小;5)化学性质稳定,低毒[9]。酞菁基本上符合上述要求,因此是较为理想的光敏剂。
酞菁类光敏剂的可溶性和聚集性质对其生物活性、在体内的分布状况及单重态氧的产率有很大影响[10]。由于亲脂性酞菁难于代谢,可能导致皮肤的光中毒[11],大多数研究者倾向于合成水溶性酞菁,例如磺基、羧基、膦基类取代酞菁等[12~16]。2000年,Maria等[10]合成了含8个阳离子的水溶性酞菁并证实了这8个正电荷可以阻止酞菁的聚集,这标志着用于光动力治疗的阳离子水溶性酞菁的研究向前迈进了一大步。同时,由于正电性的光敏剂可直接作用于线粒体[17],这对癌症的治疗很有帮助。除了正电性酞菁外,还有的研究小组致力于合成两亲性酞菁,即既含亲水基团又含亲脂基团的酞菁,这类酞菁可提高癌变组织的选择性[18]。黄金陵等[19]合成了二磺基二邻苯二甲酰亚胺甲基酞菁锌,并对其在体抗肿瘤活性进行了研究,发现其抗癌活性较高,他们认为在这个分子的平面大环周边上,亲水基团和亲脂基团的比例为2∶2,而且该分子特殊的两亲性结构使其穿过癌细胞膜进入细胞的能力增强。
最近,人们发现萘酞菁有较好的光物理性质,使萘酞菁类光敏剂在光动力治疗界引起了注意[20,21]。萘酞菁在750~780 nm处有非常强的吸收,比其在630 nm处的吸收多了近一倍。Wohrle等[22,23]早在1993和1994年已对萘酞菁进行了研究,发现取代基为NHCOCH3、OCH3、H和NH2的萘酞菁的光敏活性依次降低。因此他们合成了一系列新的萘酞菁胺化物[24,25],这些胺化物具有不同的分子间作用力、不同的亲脂性能和不同的分子大小。他们还研究了其作用于患有Lewis肺癌的小鼠后的药代动力学和光动力学性质。实验结果表明,胺化后的萘酞菁有较好的肿瘤定位性,能较快地从皮肤清除 (注入后72 h),在较低浓度时就有较高的光毒性以及胞内定位性。
光动力作用所产生的活性氧
有很多文献报道了光动力治疗在组织、细胞水平活性氧 (reactive oxygen species,ROS)产生中的作用。Chekulayeva等[26~28]用艾氏腹水癌 (Ehrlich ascites carcinoma,EAC)细胞研究了负载血卟啉衍生物 (hematoporphyrin derivative,HPD)降解过程中活性氧的作用。EAC细胞通过HPD的光敏作用产生大量的H2O2、过氧化物 (O2-)和羟基自由基,这些ROS参与PDT过程中HPD的光漂白作用,其中羟基自由基是HPD在恶性肿瘤中光漂白的主要氧化剂。HPD还以蛋白质过氧化物 (protein peroxides,PPO)的形式氧化细胞蛋白。PPO被认为是ROS的一种新形式。研究表明,PPO也参与了HPD的光漂白。研究表明ROS参与了PDT中HPD的抗癌过程[27]。实验结果还显示,H2O2、超氧化物和羟基自由基参与了HPD在肿瘤细胞中的光毒作用[28]。将艾氏腹水癌细胞在无血清的介质中负载HPD并用630 nm红光在不同温度下照射,其细胞毒性用台盼蓝释放试验来测定。研究表明,加热刺激产生了H2O2、超氧化物和羟基自由基等活性氧,同时增强了HPD-PDT的抗肿瘤效应。
李晓松等[29]初步研究了HMME所介导的光动力反应过程中,人脐带静脉内皮细胞内活性氧的产生情况。HMME-PDT组的荧光在光照后,由于产生大量的活性氧物质,荧光淬灭迅速,并且HMME-PDT组的荧光集中于细胞质核周区域。他们分析可能是细胞质核周区域的微环境影响了HMME光化学反应速率所导致的,该区域有可能是HMME介导的光动力反应早期损伤的靶点。
由于酞菁类化合物脂溶性很强,因而通常与金属离子相连,以免因脂溶性过大而产生溶解问题[30],与其配位的原子有铝、锌 、硅等,这就保证了单重态氧的顺利产生,且中心原子对三重态光敏剂量子产率起着关键性作用。前人曾经对酞菁类配合物的光氧化性质进行了研究,但对萘酞菁配合物的光氧化性质文献报道甚少。硅离子具有反磁性、闭壳层电子结构,其萘酞菁配合物具有较高的三重态量子产率[31],因此激发三重态寿命就是表征萘酞菁硅配合物光敏性质的重要因素。2005年,牛晓宇等[32]以轴向配位的萘酞菁硅配合物NcSiR2作为敏化剂,研究了其激发态性质和产生单重态氧的能力。他们分别研究了NcSiCl2、NcSi(OH)2、NcSi(OCH3)2、NcSi(OC2H5)2、NcSi(OC3H7)2、NcSi(OC4H9)2萘酞菁硅配合物。随着轴向配位基从Cl、OH、OCH3到OC4H9,推电子能力逐渐增强,激发的三重态光敏剂的寿命逐渐缩短,产生单重态氧的能力也有所下降。
Kolarova等人[33]报道了一种很有潜力的光敏剂ClAlPcS2(chloroaluminum phthalocyanine disulfonate)在G361黑色瘤细胞中ROS的产生情况,并用超声法来辅助光动力的疗效。用荧光显微镜测定活性氧的产量,发现ClAlPcS2在G361黑色瘤细胞中产生的ROS与光敏剂的浓度、光照强度和超声强度有关。当用15 J/cm2的光照射,并用强度为2 W/cm2、频率为1 MHz的超声处理100 μmol/L ClAlPcS2时,产生的ROS量最高。
早在1991年,Argobast等[34]报道了C60可高产量地产生单重态氧,对生命体系具有很强的光学损伤,之后人们开始关注纳米粒子在PDT中的应用[35]。Shi等[36]报到了一种水溶性的CdTe-TSPP〔meso-tetra(4-sulfonatophenyl)porphinedihy drochloride〕纳米复合物,能定量地产生单重态氧,用于PDT。在2010年的NSTI-Nanotech会议上,Huarac等[37]报道了一种多功能的Fe3O4/ZnO核-壳结构的纳米粒子,并阐述了其在PDT治疗中的应用潜力:由ZnO产生的ROS有助于杀死癌细胞,用DPBF(1,3-diphenylisobenzofuran)作为单重态氧的淬灭剂,可证实紫外线照射可产生单重态氧,其产量可达28%。
Anti-microbial photodynamic therapy(APDT)[38]是基于光动力疗法的概念,利用光敏剂对细菌的优先聚集特性,在适当波长的低剂量可见光激发下,光敏剂吸收能量,产生单重态氧、自由基等活性氧物质,活性氧通过氧化作用杀伤靶细胞,而不伤害周围组织和细胞。APDT法已经被证明能在体外有效杀灭细菌、酵母菌、病毒等[39],是一项值得推广的、安全有效的新疗法,特别是随着细菌耐药性的出现,这种方法将在细菌、病毒、微小寄生虫等微生物的灭活作用领域越来越受到关注。2008年,金花等[40]报道了HMME在微生物方面的光动力研究。通过AFM的超微图像观察HMME与细菌的作用。实验发现,HMME选择性地滞留于细菌细胞壁和细胞膜上,激光照射时产生单重态氧和其它活性氧直接损伤细菌细胞壁及膜系统,导致细菌死亡。当HMME浓度为50 μg/mL、可见光 (200 mW/cm2)照射30 min时,90%以上的金黄色葡萄球菌 (staphylococcus aureus)能被杀死。同等条件下,无论光照还是无光照,HMME对大肠杆菌无明显的杀伤作用。HMME对革兰氏阳性菌G+有明显的光失活效应,而对革兰氏阴性菌G-效果不明显,可能是由于革兰氏阴性菌复杂的细胞壁结构屏蔽了HMME与细胞膜的结合,从而降低了其杀伤作用,这就再次证明HMME对细胞的攻击位点主要是细胞膜,他们的研究为光敏剂对细菌的光动力损伤作用机制的可视化提供了依据。
其它光感应化合物
含偶氮苯基团的光感应化合物
1861年,曼恩首次利用重氮偶合反应合成出第一个芳香族偶氮化合物。随后的100多年来,芳香族偶氮化合物得到人们高度重视和深入研究,在纺织、食品添加剂、彩色液晶显示、彩色摄影胶片和高分子染料等方面已得到广泛应用。含有偶氮基团 (-N=N-)的化合物在特定波长的光引发下能发生E构型向Z构型的转变,而在热或另一波长的光引发下构型又会发生可逆变化[41]。近年来,偶氮苯顺-反异构化作为功能性光感应材料的重要反应之一,在材料科学及生物医学诸多领域中都受到了广泛关注[42~44]。例如,将偶氮基团引入枝状化合物,利用其可逆的光致异构及可控性好的特点,来实现分子水平上的“开”和“关”过程[45~48]。
刘胜等[49]将含有偶氮苯的肽核酸 (peptide nucleic acid,PNA)单体插入到肽核酸寡聚体中,然后通过光照来改变PNAs的构象,以此来调节和控制PNAs/DNA杂交体的结构,通过杂交体构象的改变来研究电子在电极表面传输过程中杂交体结构变化对电子传输的影响。他们将自己实验室合成的含有偶氮苯单体的肽核酸寡聚体 (NH2-TNT4,N-PNAs)组装到金电极表面,然后利用电化学循环伏安法、电化学阻抗谱和示差脉冲伏安法,对N-PNAs(参见图1)自组装膜和N-PNAs/DNA杂交体在紫外光照射下的电化学行为进行了研究,并且对实验现象和结果进行了深入的分析和讨论。由于PNAs中含有可以发生顺反异构的偶氮苯,利用紫外光对杂交体系进行照射后,发现偶氮苯由稳定的反式构象转变为顺式构象,从而破坏PNAs/DNA杂交双链体的部分结构,致使杂交双链体传输电子能力降低,引起电极表面的位阻加大,使电子在溶液和电极表面的传输能力进一步降低。该实验证实了在肽核酸寡聚体中插入偶氮苯单体,确实可以通过紫外光照射来控制与DNA的杂交行为。
王广等[50]报道了含偶氮苯的两嵌段聚合物及其在溶剂中形成的胶囊,通过紫外-可见光的照射能够可逆地控制胶囊的形成和裂解。这是由于偶氮苯基团在紫外-可见光的照射下能够发生可逆的顺式和反式异构化,从而引起胶囊的裂解和重新形成。之后他们又连续报道了将偶氮苯基团引入到2-(2-乙基己基)琥珀酸酯磺酸盐 (bis(2-ethylhexyl)sodium sulfosuccinate,AOT)分子中,修饰后的AOT分子在溶剂中的胶囊形成和裂解也能够通过紫外-可见光的照射进行可逆的控制,从而使其比AOT具有更广泛的应用。当用强度为8 mW/cm2的紫外光照射后,化合物azo-AOT(参见图2)中的偶氮苯基团的反式结构在360 nm(π-π*跃迁)的吸收迅速减弱,同时它的顺式结构在450 nm(n-π*跃迁)的吸收明显增强。这说明在紫外光的作用下,偶氮苯的结构易于从反式转变为顺式。用紫外光照射50 s后,偶氮苯基本上全部从反式转变为顺式。紫外照射后,再用相同强度的可见光照射30 s后,偶氮苯在360 nm的吸收峰几乎恢复到紫外光照射前的相同强度。这表明偶氮苯又从顺式结构恢复到反式结构。从该实验结果可以看出,王广等所合成的azo-AOT中的偶氮苯基团的顺反式结构易于用紫外-可见光来控制。因此他们推断,可以采用紫外-可见光来控制化合物azo-AOT在溶剂中胶囊的形成和裂解。
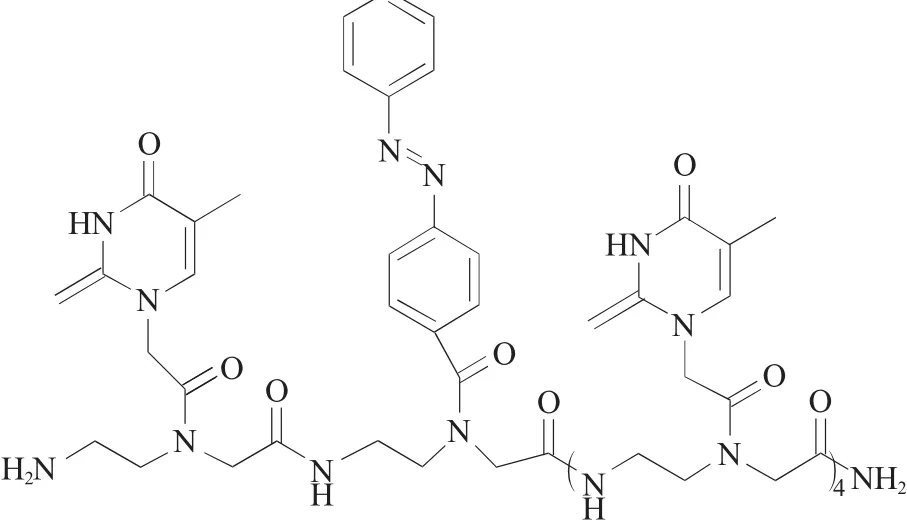
图1 含有偶氮苯的肽核酸(N-PNAs)的分子结构Fig.1 The molecular structure of N-PNAs

图2 含有偶氮苯的2-(2-乙基己基)琥珀酸酯磺酸盐(azo-AOT)的分子结构Fig.2 The molecular structure of azo-AOT
Lu等[51]用光活化的介孔结构硅胶 (light-activated mesostructured silica,LAMS)纳米颗粒,通过光控运送释放抗癌药物到活细胞。该纳米颗粒被偶氮苯分子功能化,只能通过特定的波长激活推进器,才能在细胞内部释放发光染料和抗癌药物。人类细胞株PANC-1的共聚焦照片显示,只有当推进器的偶氮苯基团受光活化后,才会将碘化吡啶PI从LAMS中释放出来,并着色到细胞核上。当细胞受能量为0.2 W/cm2、波长为413 nm的光照射大约5 min后,细胞核呈现红色;但是细胞在黑暗中不着色。当细胞用约0.1 W/cm2的光照射后,细胞核的红色会变弱一些;再用0.01 W/cm2的光照射,细胞也不会着色,因为这个强度的光照不足以活化推进器释放PI。当细胞受到676 nm、强度为0.2 W/cm2的光照时,细胞并不着色,因为推进器并不吸收该波长。这个结果证明,推进器的操作可以受光强度、光照时间和特定波长的调节,这些可控因素直接影响从孔中释放的内容物。释放的药物数量可以通过光强度和光照时间来控制。
李进都等[52]用原子力显微镜研究了包含偶氮苯的肽核酸 (PNA)与金纳米颗粒标记的DNA的杂交情况。PNA寡聚体通过t-Boc在Merrfield树脂上合成,然后将其组装在硅片表面,最后与用15 nm的金纳米颗粒标记的靶DNA杂交,并通过原子力显微镜进行检测。他们的实验表明,包含偶氮苯单元的PNA寡聚体和PNA一样,都能与互补的靶DNA杂交,并且偶氮苯单元在PNA中的位置并不能显著地影响杂交,但是偶氮苯的顺反异构却会影响杂交。
含偶氮苯基团的光感应脂质体
脂质体用做药物载体,具有诸多优点:可体内降解、无毒性、无免疫原性;既能包封脂溶性药物,又能包封水溶性药物;能有效保护被包封药物,提高生物利用度;使药物具有靶向作用;降低药物的毒副作用;具有缓控释作用,适合多途径给药等。现已被广泛用作药物载体,应用于许多疾病的治疗中。经过刺激感应型材料修饰的新型脂质体可进一步提高脂质体制剂的靶向性、可控性及其它特殊功能。目前研究的主要有长循环脂质体、免疫脂质体、温度敏感脂质体、pH敏感脂质体、磁性脂质体、光感应 (亦称光敏感)脂质体等。其中,光感应脂质体相比其它刺激感应型脂质体有更为吸引人的地方,如有更多可调参数 (波长、持续时间、强度等)用于针对药物特性设计相应的药物释放体系。光感应脂质体是由光感应材料与磷脂混合后制备形成的一种脂质体,可内包药物,用外来光源诱导脂质体组分中的光感应材料发生结构上的变化,从而控制其内包药物的释放。将脂质体和光动力治疗结合起来,可能会形成一种协同治疗,即用脂质体将治疗制剂运输到病灶区,然后光控释放药物,从而提高治疗效率和可控性。
我们实验室设计合成了一系列新型偶氮苯-胆固醇衍生物作为光控开关,用于智能化光控药物释放系统,以期能够定点、定时、定量地释放药物,达到防止药物失活、减少副作用、提高药效的目的。
我们首先检测了合成的目标化合物在溶液中的光致异构效应,在紫外灯照射下,目标化合物能够很好地由热力学稳定的反式结构转化为热力学不稳定的顺式结构,而且异构率在90%以上。然后用探头式间歇超声法将目标化合物和蛋黄卵磷脂多层脂质体的悬浊液制备成光感应脂质体,证明目标化合物在组入脂质体后还能有效地实现顺反异构 (异构率65%)。我们用间歇性 (每4 h照射5 min)的UV照射AB lipid(参见图3)以保持顺式异构式构型,然后研究光控钙黄绿素释放动力学。实验结果表明,钙黄绿素的释放呈两相,刚开始是突释阶段,接着是一个恒速释放 (零级释放)阶段。当50%的AB lipid被组入蛋黄卵磷脂时,35%的钙黄绿素释放出来,光控释放速率随着钙黄绿素在AB lipid脂质体中的摩尔比的增加而增加。并且,当AB lipid越能持久地保持顺式异构体,就有越多的钙黄绿素从脂质体中释放。该药物控制释放体系中,药物渗漏率很小,而且在光照射下释放速率和释放量能得到很好的控制。实验证明我们设计、合成的光感应化合物,能与磷脂组成脂质体,从而实现体外智能化光控释放[53,54]。

图3 含有偶氮苯的脂质 (AB lipid)的分子结构Fig.3 The molecular structure of AB lipid
含其它光感应材料的脂质体
Lindsey等[55]报道了一种由80%DOPC(1,2-dioleoyl-sn-glycero-3-phosphocholine)和20%DOTAP(1,2-dioleoyl-3-trimethy-lammonium-propane)组成的内包荧光蛋白分子和金粒子的纳米脂质体,是一种可进行光控释放的新体系。纳米脂质体在激光脉冲照射下,周围会产生电浆纳米气泡,该气泡会破坏脂质体的膜,从而释放内含物-荧光蛋白,释药效果可通过改变气泡的寿命和大小来调整。这种电浆纳米气泡诱导的释放是一种机械非热能过程,能在毫秒内完成释放且不破坏内含物。
Lauri等[56]研究了由DSPC(distearoylphosphatidylcholine)和DPPC(dipalmitoylphosphatidylcholine)组成的内嵌金的光感应脂质体在细胞里的光致释放功能和机制。将脂质体内化到ARPE-19细胞后,观察到亲水性荧光探针钙黄绿素在脂质体里发生光致释放。内嵌金的光感应脂质体在紫外光的照射下,金纳米粒子吸收光能转化为热,使脂质体发生相变,导致脂质体内包物的释放。
Zhang等[57]合成了能发生光裂解的dioleoylphosphatidylethanolamine(DOPE)的衍生物(称为NVOC-DOPE)。用500 W汞灯照射包含有钙黄绿素的大单室脂质体 〔该脂质体由EPE(egg phosphatidylethanolamine)和NVOC-DOPE组成,其摩尔比为1∶1〕,能诱导所有钙黄绿素的快速完全释放。
Nathan等人[58,59]报道了一种脂质体级联引发的技术,即利用一种脂质体的光致氧化来释放内包物并激活酶,然后破坏另一种脂质体的环境,从而实现其光致释放内包物。他们研究发现,利用DPPlsCho(1,2-dihexadec-1'-enyl-sn-glycero-3-phosphocholine)脂质体的光致氧化来释放内包物Ca2+激活囊泡的磷脂酶A2,可促进DPPC脂质体的催化水解并诱导其内包物钙黄绿素的释放。
Namiki等[60]研制了一种亲脂性光感应脂质体PSSL(photosensitive stealth liposome),即在磷脂双分子层膜含有亲脂性的光敏剂 Ce6-Na,将其用于胃癌细胞的光动力治疗中。他们研究发现,PSSL可完全破坏动物模型的所有肿瘤,且肿瘤复发率达到最低(1.5±0.9)%;有望用于胃癌的光动力学治疗中。
光化学内化
光化学内化 (photochemical internalization,PCI)的基本原理和PDT相同,所不同的只是PCI中的光敏剂被固定在靶向细胞的内吞囊泡里,光激活后,首先是光化学诱导内吞囊泡的破裂,然后释放内吞治疗剂。另外,用于PCT中的光敏剂是两亲性分子,被细胞内吞后主要位于内吞囊泡的细胞膜。PCI不仅可以很好地反映PDT的细胞毒性、血管和免疫刺激的效应,而且可以诱导药物的定点释放,被称为“强化的PDT”,可作为癌症手术的辅助治疗手段。
至今已有多篇关于光化学内化方面的研究报道和文献综述[61~67]。图4详细介绍了溶酶体的光化学内化释放疗法过程[64]:首先,两亲光敏剂在药物之前被输送或/和药物一起被输送;接着,光敏剂结合到质膜上,并和药物或基因通过内吞方式被摄入。为了增加摄入,这些药物通常结合到靶向基团 (如抗体或生长因子)上。光敏剂和药物共同位于溶酶体内腔里。由于光敏剂是部分亲水和部分疏水的,因此会位于溶酶体的膜上,而药物通常是亲水性的,会留在溶酶体的腔体里;在没有光照射时,这些药物或基因最终会被酸性颗粒的酶水解掉;以PCI的方式,光敏剂被光激活后会产生活性氧 (主要是单重态氧),使细胞膜氧化而破裂,导致药物释放并与细胞质或细胞核的靶向位点相互作用。
Norum等人[63~65]研究了博来霉素 (bleomycin,BLM)的PCI和PDT对外科手术后肿瘤的再生时间间隔的影响。结果表明:BLM的PCI能抑制术后剩余的纤维肉瘤细胞的生长,而PDT则不能;肿瘤周围BLM的有效释放说明PCI比PDT更能有效诱导内吞治疗剂的释放;PCI可进行包括细胞毒性靶向结合治疗、化疗、siRNA、纳米药物和基因的疗法;除此之外,PCI还能通过运送不同的RNA/DNA到靶向细胞的细胞核,从而达到基因治疗和增强纳米粒子输送的目的。PCI表现出强的协同效应,预示着其显著的临床应用潜力。

图4 溶酶体的光化学内化释放疗法过程[4]①两亲光敏剂在药物之前被输送或/和药物一起被输送;②光敏剂结合到质膜上,并和药物或基因通过内吞方式被摄入;③在没有光照射时,这些药物或基因最终会被酸性颗粒的酶水解掉;④以PCI的方式,被光激活的光敏剂会产生活性氧(主要是单重态氧),使细胞膜氧化而破裂,导致药物释放并与细胞质或细胞核的靶向位点相互作用Fig.4 Endolysosomalescapeoftherapeuticsbyphotochemicalinternalization[4] ①Anamphiphilic photosensitizeris either given(i.v.)together or before administration of the drug or gene(i.v.or intratumorally)to be delivered;②The photosensitizer binds to the plasma membrane and taken up together with the drug or gene by endocytosis;③Without light exposure,the sequestered drugs or genes will eventually be hydrolyzed by the enzymes of the acidic vesicles;④With PCI,a light-activation of the photosensitizer induces production of ROS(mainly singlet oxygen),which finally oxidizes the membranes leading to rupture and a subsequent release of the therapeutics so that they may interact with their biological targets in the cytosol or nucleus
结语与展望
综上所述,光感应化合物在以光为手段治疗疾病方面的研究是令人鼓舞的,近些年来,在光控治疗中的研究及应用也得到了一定发展。其中,光动力疗法 (PDT)以其独特的优点,目前已成为世界肿瘤防治科学中最活跃的研究领域之一,倍受人们关注的卟啉类和酞菁类化合物,有望成为治疗癌症的药物。然而,在PDT领域中还有很多地方有待进一步研究,比如:1)作为影响 PDT治疗效果重要因素的光敏剂在细胞内的定位问题,因为这不仅决定了光敏剂能否聚集在癌变细胞内,而且对于人们理解细胞内发生的光动力过程,以便更好地利用光动力治疗也很有帮助;2)光敏剂的化学结构与PDT效能关系的研究,早期工作中人们多集中在研究光敏剂的动力学性质,如荧光的淬灭等,而光敏剂的化学结构和电子性质却是影响其光生物活性和光动力性质的重要因素;3)各类光敏剂的某些副作用,如光毒性,以及如何降低这些副作用等。另外,如何将功能更强大的光化学内化 (PCI)和PDT联合应用到癌症治疗中,也需要做进一步的研究。
将光感应脂质体和光动力治疗结合起来,可能会形成一种协同治疗,利用可体内降解、无毒性、无免疫原性的脂质体将治疗制剂运输到病灶区,然后光控释放药物,既可提高治疗效率又具可控性。我们实验室设计合成的新型偶氮苯-胆固醇衍生物用于智能化光控药物释放系统,有望能够定点、定时、定量地释放药物,达到防止药物失活、减少副作用、提高药效的目的,在光控治疗中具有很好的应用前景。
1. 李立,富永明,董齐.光动力疗法治疗现状.中国误诊学杂志,2005,5(3):439~440 Li L,Fu YM,Dong Q.Treatment status of photodynamic therapy.Chin J Misdiag,2005,5(3):439~440
2.Castano AP,Mroz P,Hamblin MR.Photodynamic therapy and anti-tumour immunity.Nat Rev Cancer,2006,6:535~545
3.Oleinick NL,Morris RL,Belichenko I.The role of apoptosis in response to photodynamic therapy:what,where,why,and how.Photochem Photobiol Sci,2002,1:1~21
4. Moan J. Properties foroptimalPDT sensitizers. J Photochem Photobiol B:Biol,1990,5:521~524
5.Athar M,Craig A,Elmets,David R,Bickers,Mukhtar H.A novel mechanism for the generation of superoxide anions in hematoporphyrin derivative-mediated cutaneous photosensitization.J Clin Invest,1989,83:1137~1143
6. 陈虹霞,顾瑛,刘凡光,曾晶.血卟啉单甲醚-PDT对骨髓基质细胞及K562白血病细胞杀伤效应的初步研究.中国激光医学杂志,2005,14(4):268 Chen HX,Gu Y,Liu FG,Zeng J.A preliminary study on the killing effect of hematoporphyrin monomethyl ether-PDT on bone marrow stromal cells and K562 leukemia cell.Chin J Laser Med Surg,2005,14(14):268
7. 张慧芳,于长江,郭颖志,顾忠伟.用于肿瘤光动力治疗的血卟啉单甲醚微纳米载药系统的研制.中国计划生育学杂志,2007,12:731~735 Zhang HF,Yu CJ,Guo YZ,Gu ZW.Micro-nano particle system loaded with HMME fortumorphotodynamic therapy.Chin J Family Plan,2007,12:731~735
8. Henderson BW,Dougherty TJ.Photodynamic therapy:Basic principles and clinical applications.New York:Marcel Dekker INC,1992.63
9. 刘尔生,黄剑东,戴志飞,杨素苓,吴谊群,陈耐生,黄金陵.磺酸基邻苯二甲酰亚胺甲基酞菁锌的合成及光动力抗肿瘤活性研究.无机化学学报,1997,13(1):411~415 Liu ES,Huang JD,Dai ZF,Yang SL,Wu YQ,Chen NS,HuangJL. Studyonthesynthesisandphotodynamic antitumour activity of sulfonated phthalimidomethyl phthalocyanine zinc.J Inorg Chem,1997,13(1):411~415
10.Maria PDF,Donata D,Lia F,Gabrio R.Synthesis of a new water-soluble octa-cationic phthalocyanine derivative for PDT.Tetrahedron Lett,2000,41:9143~9147
11.Jori G.Tumor photosensitizers:approaches to enhance the selectivity and efficiency ofphotodynamic therapy. J Photochem Photobiol,B:Biol,1996,36:87~93
12.Yang YC,Ward JR,Seiders RP.Dimerization of Cobalt(Ⅱ)tetrasulfonated phthalocyanine in water and aqueous alcoholic solutions.Inorg Chem,1985,24(12):1765~1769
13.Ogawa K,Kinoshita S,Yonehara H,Nakahara H,Fukuda K.Highly ordered monolayer assemblies of phthalocyanine derivatives.JChem SocChem Commun, 1989, 8:477~479
14.Kliesch H,Weitemeyer A,Muller S,Wohrle D.Synthesis of phthalocyanines with one sulfonic acid,carboxylic acid,or amino group.Liebigs Ann,1995,7:1269~1273
15.Boyle RW,van Lier JE.Phosphorylating agents:Versatile tools for the synthesis of amphiphilic water-soluble photo-sensitizers.Int Congr Ser-Excerpta Med,1992,1011:845~849
16.Sharman WM,Kudrevich SV,van Lier JE.Novel watersoluble phthalocyanines substituted with phosphonate moieties onthebenzo rings. TetrahedronLett, 1996,37(33):5831~5834
17.Murphy MP.Selective targeting of bioactive compounds to mitochondria.Trends Biotechnol,1997,15(8):326~330
18.Daniel AF,Lelia ED,Josefina A.Synthesis and properties of two new N-alkyl substituted phthalocyanines. J Heterocyclic Chem,1995,32:519~522
19.黄金陵,陈耐生,黄剑东,刘尔生,薛金萍,杨素苓.用于光动力治疗的金属酞菁配合物-两亲性酞菁配合物ZnPcS2P2的制备、表征及抗癌活性.中国科学 (B辑),2000,30(6):481~488 Huang JL,Chen NS,Huang JD,Liu ES,Xue JP,Yang SL.Metallic phthalocyanine complexes used in photodynamic therapy-the preparation, characterization and antitumour activity of an amphiphilic Zn phthalocyanine ZnPcS2P2.Sci China(Ser B),2000,30:481~488
20.Cuomo V,Jori G,Rither B,Kenney ME,Rodgers MAJ.Liposome-delivered Si(Ⅳ)-naphthalocyanine as a photodynamic sensitizerforexperimentaltumors: Pharmacokineticand phototherapeutic studies.Br J Cancer,1990,62:966~970
21.Ho X, Pandey R,Sumlin A,Missert J, Bellnier D,Dougherty T. Potential new photosensitizers for photodynamic therapy.Proc Soc Photo-Opt Instrum Eng,1990,1203:293~300
22.Wilson BC,Jeeves WP.Photodynamic therapy of cancer,in photomedicine.Vol.2.Ben-Hur E,Rosenthal I(Ed).Boca Raton,FL:CRC Press,1987.127
23.Wohrle D,Shopova M,Müller S,Milev A,Mantareva V,Krastev K.Lipsome-delivered Zn(Ⅱ)-2,3-naphthalocyanines as potential sensitizers for PDT:Synthesis,photochemical,pharmacokinetic and phototherapeutic study.J Photochem Photobiol B:Biol,1993,2:155~165
24.Shopova M,Wohrle D,Stoichkova N,Milev A,Mantareva V, MüllerS, GeorgievK. HydrophobicZn (Ⅱ )-2,3-naphthalocyanines as photodynamic therapy agents for Lewis lung carcinoma.J Photochem Photobiol B:Biol,1994,23:35~42
25.Müller S,Mantareva V,Stoichkova N,Kliesch H,Sobbi A,Wohrle D, Shopova M. Tetraamido-substituted 2,3-naphthalocyanine zinc(Ⅱ)complexes as photo therapeutic agents: Synthesis, comparative photochemical and photobiological studies.J Photochem Photobiol B:Biol,1996,35:167~174
26.Chekulayeva LV,Chekulayev VA,Shevchuk IN.Active oxygen intermediates in the degradation of hematoporphyrin derivative in tumor cells subjected to photodynamic therapy.J Photochem Photobiol B:Biol,2008,93(2):94~107
27.Chekulayeva LV,Shevchuk IN,Chekulayev VA,Ilmarinen K.Hydrogen peroxide,superoxide,and hydroxyl radicals are involved in the phototoxic action of hematoporphyrin derivative against tumor cells. J Environ Pathol Toxicol Oncol,2006,25(1-2):51~77
28.Chekulayeva LV,Shevchuk IN,Chekulayev VA.Influence oftemperature on the efficiencyofphotodestruction of Ehrlich ascites carcinoma cells sensitized by hematoporphyrin derivative. Exp Oncol, 2004, 26(2):125~139
29.李晓松,刘凡光,顾瑛,王雷,戴维德,丁新民,曾晶.血卟啉单甲醚所介导的光动力反应过程中ECV 304细胞内活性氧产生情况的初步研究.中国激光医学杂志,2005,14(4):267~268 Li XS,Liu FG,Gu Y,Wang L,Dai WD,Ding XM,Ceng J.A preliminary study on the generation of ROS in the ECV 304 cells in the process of photodynamic response inducedby hematoporphyrinmonomethylether. ChinJ Laser Med Surg,2005,14(14):267~268
30.Avirah R,Jyothish K,Ramaiah D.Infrared abosorbing croconaine dyes: Synthesis and metalion binding properties.J Org Chem,2008,73(1):274~279
31.Ford WE,Rodgem MAJ,Schechtman LA.Synthesis and photochemical properties of aluminum,gallium,silicon,and tin naphthalocyanines. Inorg Chem, 1992, 31(16):3371~3377
32.牛晓宇,朱宇君,薛金萍,于海燕,吴谊群,陈耐生,黄金陵.几种萘酞菁硅配合物的光动力效应的研究.感光科学与光化学,2005,23(6):407~413 Niu XY,Zhu YJ,Xue JP,Yu HY,Wu YQ,Chen NS,Huang JL. Study on photodynamic effectofsilicon naphthalocyanine coordinated compounds.Photograph Sci Photochem,2005,23(6):407~413
33.Kolarova H,Tomankova K,Bajgar R,Kolar P,Kubinek R.Photodynamic and sonodynamic treatment by phthalocyanine on cancer cell lines.Ultras Med Biol,2009,35(8):1397~1404
34.Argobast JW,Darmanyan AP,Foote CS,Diederich FN,Rubin Y,Diederich F,Alvarez M,Anz SJ,Whetten RL.Photophysical properties of C60.J Phys Chem,1991,95(1):11~12
35.Bakalova R,Ohba H,Zhelev Z,Nagase T,Jose R,Ishikawa M,Ba Y.Quantum dot anti-CD conjugates:Are they potential photosensitizers or potentiators of classical photosensitizing agents in photodynamic therapy of cancer?Nano Lett,2004,4:1567~1573
36.Shi L,Hernandez B,Selke M.Singlet oxygen generation from water-soluble quantum dot-organic dye.J Am Chem Soc,2006,128:6278~6279
37.Huarac JCB,Tomar MS,Singh SP,Perales-Perez O,Rivera L,Pena S.Multifunctional Fe3O4/ZnO core-shell nanoparticles for photodynamic therapy. NSTI-Nanotech,2010,3:405~408
38.Maisch T.Anti-microbial photodynamic therapy:Useful in the future.Lasers Med Sci,2007,22:83~91
39.Wainwright M.Photoantimicrobials——A PACT against resistance and infection.Drugs Future,2004,29:85~93
40.金花,赵宏霞,任雅清,吴扬哲,蔡继业.原子力显微镜观测血卟啉单甲醚对细菌光动力杀伤作用.微生物学报,2008,48(10):1378~1372 Jin H,Zhao HX,Ren YQ,Wu YZ,Cai JY.Observation of bacteria photodynamic inactivation induced by hematoporphvrinmonomethyl ether by atomic force microscope.Acta Microbiol Sin,2008,48(10):1378~1382
41.Kumar GS,Neckers DC.Photochemistry of azobenzenecontaining polymers.Chem Rev,1989,89:1915~1925
42. Irie M. Propertiesand applicationsofphotoresponsive polymers.Pure Appl Chem,1990,62:1495~1502
43. TomaliaDA, NaylorAM, GaddardIIIWA. Starburst dendrimers:Molecular-Level control of size,shape,surface chemistry, topology, and flexibility from atoms to macroscopic matter.Angew Chem Int Ed Engl,1990,29:138~175
44.Westmark PR,Kelly JP,Smith BD.Photoregulation of enzyme actitity, photochromic, transition-state-ana-logue inhititors of cysteine and serine proteases.J Am Chem Soc,1993,115:3416~3419
45.Junge DM,McGrath DV.Photoreponsive dendrimers.J Chem Soc Chem Commun,1997:857~858
46. MurakamiH,KawabuchiA, KotooK, KunitakeM,Nakashima N.A light-driven molecular shuttle based on a rotaxane.J Am Chem Soc,1997,119:7605~7606
47. MekelburgerHB, Rissanen K, Vogtle F. Repetitive synthesis of bulky dendrimers——A reversibly photoactive dendrimer with six azobenzene side chains.Chem Ber,1993,126:1161~1169
48.Reddy DR,Maiya BG.A molecular photoswitch based on anaxial-bondingtype phosphorus(V)porphyrin.J Chem Soc Chem Commun,2001:117~118
49.刘胜,陈淼,李进都,张浩波,王金清,杨生荣.含有偶氮苯单体的肽核酸寡聚体自组装膜电化学传感器在DNA序列检测方面的应用.中国科学 (B辑),2008,38(9):793~797 Liu S,Chen M,Li JD,Zhang HB,Wang JQ,Yang SR.The application ofself-assembly membrane ofpeptide nucleic acids oligomers containing azobenzene monomer as electrochemical sensor for detection of DNA sequence.Sci China(Ser B),2008,38(9):793~797
50.王广,赫奕,李香辉,赵宁.具有光活性含偶氮苯基团的新型表面活性剂的合成和性质.东北师大学报 (自然科学版),2007,39(1):63~66 Wang G,HE Y,Li XH,Zhao N.Synthesis and properties ofazo-containinglight-active surfactant. JNortheatNorm Univ(Nat Sci Ed),2007,39(1):63~66
51.Lu J,Choi E,Tamanoi F,Zink J.Light-activated nano impeller-controlled drug release in cancercells. Small,2008,4(4):421~426
52.李进都,陈淼,张浩波,刘胜,刘建喜.原子力显微镜研究包含偶氮苯的肽核酸与纳米颗粒标记DNA的杂交.科学通报,2008,53(10):1235~1237 Li JD,Chen M,Zhang HB,Liu S,Liu JX.Study on the hybrid of peptide nucleic acids containing azobenzene with nanoparticalmarkedDNA byatomicforcemicroscopy.Chin Sci Bull,2008,53(10):1235~1237
53.Liu XM,Yang B,Wang YL,Wang JY.New nanoscale pulsatile drug delivery system.Chem Mater,2005,17:2792~2795
54.Liu XM,Yang B,Wang YL,Wang JY.Photoisomerisable cholesterol derivatives as photo-trigger of liposomes:Effect oflipid polarity, temperature, incorporation ratio, and cholesterol.Biochim Biophys Acta,2005,1720:28~34
55.Anderson LJE,Hansen E,Lukianova-Hleb EY,Hafner JH,Lapotko DO. Optically guided controlled release from liposomes with tunable plasmonic nanobubbles.J Control Rel,2010,144:151~158
56.Lauri P,Tuomas S,Astrid S,Pasi L,Sarah J,Butcher MR, Anan Y, Arto U, Marjo Y. Gold-embedded photosensitive liposomes for drug delivery: Triggering mechanism and intracellular release.J Control Rel,2010,147:136~143
57.Zhang ZY,Bradley DS.Synthesis and characterization of NVOC-DOPE, a caged photoactivatable derivative of dioleoylphosphatidylethanolamine.Bioconjugate Chem,1999,10:1150~1152
58.Nathan JW,Oleg VG,Thompson DH.Cascade liposomal triggering: Light-induced Ca2+release from diplasmenylcholine liposomes triggers PLA2-catalyzed hydrolysis and contents leakage from DPPC liposomes.Bioconjugate Chem,1998,3(9):305~308
59. Ilya BZ, Leu BZ, Maria JB. The mechanism of Zn-phthalocyanine photosensitized lysis of human erythrocytes.J Photochem Photobiol B:Biol,2002,67(1):1~10
60.Namiki Y,Namiki T,Date M,Yanagihara K,Yashiro M,Takahashi H.Enhanced photodynamic antitumor effect on gastriccancer by a novel photosensitive stealth liposome.Pharmacol Res, 2004,50:65~76
61. HogsetA, Prasmickaite L, Selbo PK, Hellum M,EngesaeterBO, Bonsted A, Berg K. Photochemical internalisationin drug and gene delivery.Adv Drug Deliv Rev,2004,56:95~115
62.Selbo PK,Sivam G,Fodstad O,Sandvig K,Berg K.In vivodocumentation of photochemical internalization,a novel approach to site specif i c cancer therapy.Int J Cancer,2001,92:761~766
63.Berg K,Selbo PK,Prasmickaite L,Tjelle TE,Sandvig K,Moan J,Gaudernack G,Fodstad O,Kjolsrud S,Anholt H,RodalGH, RodalSK, HogsetA. Photochemical internalization: A noveltechnology for delivery of macromoleculesinto cytosol. CancerRes, 1999, 59:1180~1183
64.Selbo PK,Weyergang A,Høgset A,Norum OJ,Berstad MB, VikdalM, Berg K. Photochemicalinternalization provides time-and space-controlled endolysosomal escape of therapeutic molecules.J Control Rel,2010,148:2~12
65. Norum OJ, GierckskyKE, Berg K. Photochemical internalization as an adjunctto marginalsurgery in a human sarcoma model.Photochem Photobiol Sci,2009,8:758~762
66.Norum OJ,Selbo K,Weyergang A,Giercksky KE,Berg K.Photochemical internalization(PCI)in cancer therapy:From bench towards bedside medicine.J Photochem Photobiol B:Biol,2009,96:83~92
67.Norum OJ,Gaustad JV,Angell-Pettersen E,Rofstad EK,Peng Q, Giercksky KE, Berg K. Photochemical internalization ofbleomycinis superior to photodynamic therapy due to the therapeutic effect in the tumor periphery.Photochem Photobiol,2009,85:740~749
Key Words:Photodynamic therapy;Photosensitive compound;Reactive oxygen species;Liposome;Photochemical internalization
Applications of Photosensitive Compounds in Photo-Controlled Therapy
WU Qingfen1,2,XU Qing2,ZHANG Liping1,LIU Xinming3,WANG Yulu1,LI Jianping1,WANG Jinye2,3
1.College of Chemical and Environmental Science,Henan Normal University,Xinxiang 453002,China;
2.Biomedical Engineering,Shanghai Jiao Tong University,Shanghai 200240,China;
3.Shanghai Institute of Organic Chemistry,Chinese Academy of Sciences,Shanghai 200032,China
Sep 24,2010 Accepted:Dec 23,2010
WANG Jinye,Tel:+86(21)34205824,E-mail:jinyewang@sjtu.edu.cn
The research and applications of photosensitive compounds used for treating diseases by means of light are reviewed.Briefly introduces the photodynamic therapy and the application of porphyrin and phthalocyanine photosensitive compounds in photodynamic therapy,describes the generation mechanism of reactive oxygen species(ROS)in photodynamic process,highlights the application and development of other photosensitive compounds,such as azobenzene compounds or other photosensitive materials,focus on the potential use of a new type of intelligent liposome encapsulating a cholesterol derivative of azobenzene compounds in photo-controlled therapy.The recent prospect of photochemical internalization(PCI)is also described.
2010-09-24;接受日期:2010-12-23
“973”计划项目(2005CB724306),国家自然科学基金项目(30870635,31070868)
王瑾晔,电话:(021)34205824,E-mail:jinyewang@sjtu.edu.cn
O644.16
This work was supported by grants from The"973"Program(2005CB724306),The National Natural Science Foundation of China(30870635,31070868)

