液体发酵中木聚糖酶的研究
张 宇,王志成,周红霞
(黑龙江省能源环境研究院,黑龙江哈尔滨,150027)
木聚糖是植物半纤维素的重要组分,在植物细胞壁中的含量仅次于纤维素,约占细胞干重的35%[1],是一种高度异构的杂聚糖,很难被分解,自然界中有很大一部分木聚糖未被有效利用,造成了极大的资源浪费。
木聚糖酶是一类能够特异降解木聚糖的酶类,主要是由β-1,4-D-内切木聚糖酶和β-1,4-D-外切木糖苷酶组成,此外还有一些脱支链酶。木聚糖酶能够降解木聚糖生成聚合度为2~10的低聚木糖混合物,该产物具有很高的经济价值,因此近年来,木聚糖酶在造纸工业、食品、能源、饲料以及环境等领域均显示了广阔的应用前景[2]。
木聚糖酶在去污洗涤,医药等行业中也有应用。另据报道,木聚糖酶在果实成熟、种子萌发、真菌的寄生及植物的抗性等诸多生理过程中也有重要作用[3]。
1 实验材料
1.1 菌株
好食脉孢霉(N.sitopHila),齐齐哈尔大学生命科学与工程学院生化工程实验室保藏提供,斜面(PDA)培养基保存。
1.2 主要仪器
电子天平(上海精密科学仪器有限公司),隔水式电热恒温培养箱(上海跃进医疗器厂),DL102电热鼓风干燥箱(天津市实验仪器厂),压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂),超净工作台(苏州净化设备股份公司),光学显微镜(Olympus),血球计数板(国营上海医用光学仪器厂),UV-120-02紫外分光光度计(日本津岛),酸度计(上海精密科学仪器有限公司),HYG-Ⅲ回旋式恒温调速摇瓶柜(上海新蕊自动化设备有限公司),电子万用炉(天津市泰斯特仪器有限公司),微量移液器(荆花)。
1.3 培养基
1.3.1 斜面培养基(PDA)
马铃薯200g去皮,切块煮沸30min,然后用纱布过滤,再加葡萄糖20g及琼脂20g,溶化后用水定容至1000mL,pH自然。
1.3.2 种子培养基:
3%麸皮水(麸皮水制备∶3g麸皮加水100mL,浸泡1h,煮沸 1h,过滤取汁、定容)、1.5%蛋白胨、pH5.0。
1.3.3 发酵培养基
3%麸皮水、0.5%蛋白胨、6%豆渣、pH自然。
2 实验方法
2.1 培养方法
2.1.1 斜面培养
取好食脉孢霉一支,打开后用接种环转入PDA斜面培养基中,28℃恒温培养3d,放入冰箱中备用。
2.1.2 液体种子培养
向保存的好食脉孢霉斜面中加入5~10mL无菌水,然后用接种针将培养基表面的菌落刮下,转入带玻璃珠的三角瓶中,震荡摇匀,制成孢子悬液,用显微镜计数后,再取适量的悬液接入装有50mL液体培养基的250mL三角瓶中,使其孢子数达到105个/mL,于28℃,150r/min 下震荡培养[4~6]。
2.1.3 液体发酵培养
将液体种子接入装有50mL发酵培养基的250mL三角瓶中,于一定的转速和温度的回转式摇床中培养,每个做三个平行样,并定时取样测定酶活力。
2.2 粗酶液的提取及酶活单位定义
将发酵液用滤纸真空抽滤后所得的清液,即为粗酶液。
酶活力定义为:在45℃,pH4.4条件下,每分钟分解木聚糖生成1μmol木糖所需的酶量为一个酶活力单位(U)。
2.3 木聚糖酶活力测定
木聚糖酶活力的测定常用方法有:Na3AsO4法、液相色谱法、DNS法,其中最常用的为DNS法,本文采用3,5- 二硝基水杨酸法(DNS)法[5~6]。
底物为0.4%木聚糖溶液(pH4.4),取0.5mL适当稀释的酶液于比色管中,加入1.5mL底物溶液,45℃水浴反应30min,加入1.5mLDNS溶液后在沸水浴中煮沸5min。迅速用冷水冷却至室温,加蒸馏水定容至25mL,540nm测定吸光值。
空白对照:取0.5mL适当稀释的酶液于比色管中,煮沸5min使酶失活,加入1.5mL底物溶液,45℃水浴反应30min,加入1.5mLDNS溶液后在沸水浴中煮沸5min。迅速用冷水冷却至室温,加蒸馏水定容至25mL,540nm测定吸光值。

X(mg)∶反应结束时酶水解底物产生的还原糖的毫克数;
Y(mL/g)∶酶的稀释倍数;
150.13 (mg/mmol)∶木糖的相对分子质量;
30(min)∶反应时间(min);
0.5 (mL)∶加入酶液量;
1000∶将mmol转化成μmol所乘的系数。
3 影响酶活力的因素
3.1 培养基对酶活力的影响
以3%麸皮水为碳源,分别以0.5%蛋白胨、6%湿豆渣、1.4%豆粕、0.5%蛋白胨和6%湿豆渣及0.5%蛋白胨和1.4%豆粕为氮源,发酵温度为28℃,转速为150r/min,初始pH值自然进行发酵培养,选择接种量为3%,每组三个平行,发酵72h后测酶活。
3.2 接种量对酶活力的影响
发酵温度为28℃、转速为150r/min、初始pH值自然条件下,分别选择接种量为0.5%、1%、3%、5%、7%,每组三个平行,发酵72h后测酶活。
3.3 发酵温度对酶活力的影响
分别选取发酵温度20℃、25℃、28℃、32℃、转速为150r/min、初始pH值自然进行液体发酵,选择接种量为3%,每组三个平行,发酵时间为72h,测定各温度下的酶活力。
4 结果与讨论
4.1 种子培养
在温度为28℃,转速150r/min、初始pH值为5.0的条件下培养48h,每4h取样一次,烘干至恒重,测干重,各发酵时间的菌体干重如表4-1所示。
如表1所示,在12~32h后的种子培养液中菌体含量明显增多,适宜接种到发酵培养液中培养。
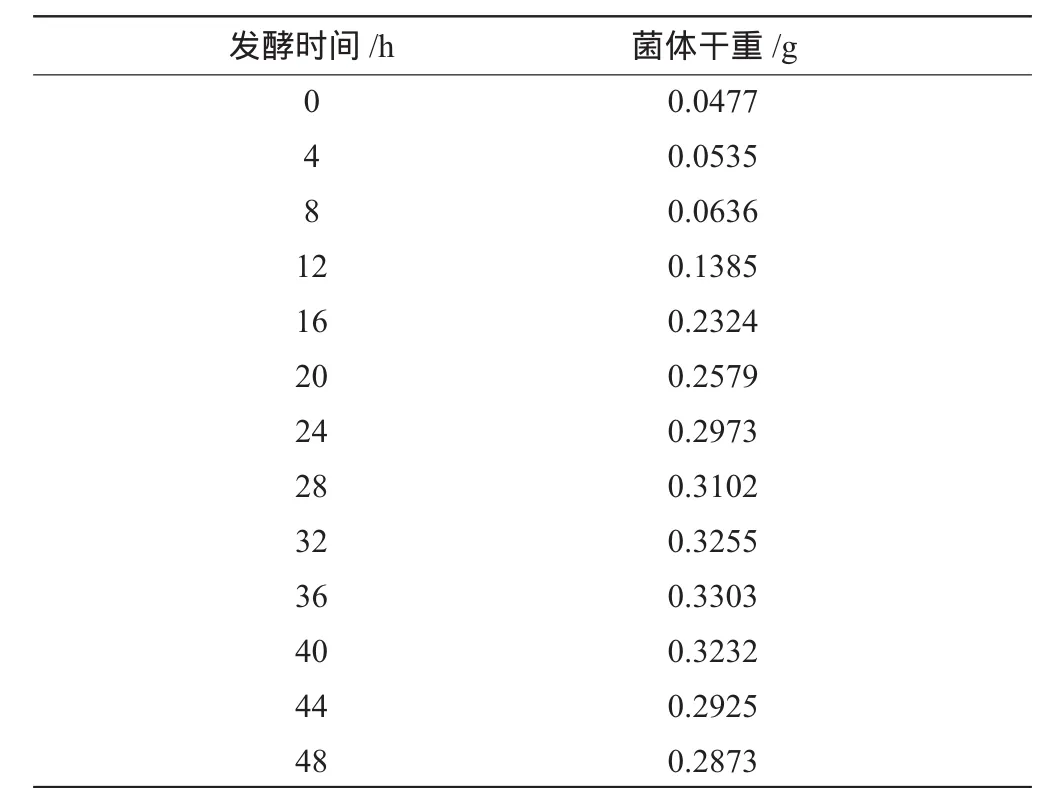
表1 各发酵时间的菌体干重Table 1 The dry weight at various fermentation time
4.2 不同培养基对产酶的影响
培养基是提供微生物生长繁殖和生物各种代谢产物所需要的按一定比例配制的各种营养物质的混合物。
按表2配制发酵培养基进行发酵,温度为28℃,转速为150r/min,初始pH值自然。进行发酵培养,发酵时间为72h。
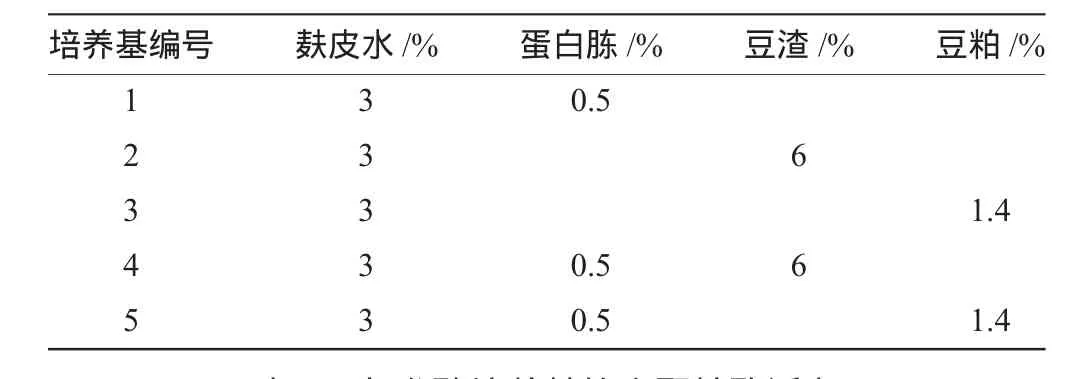
表2 发酵培养基Table 2 Fermentation medium

表3 各发酵培养基的木聚糖酶活力Table 3 The activities of xylanase produced by different fermentation mediums
各发酵培养基的木聚糖酶活力,如表3。4号培养基木聚糖酶活力相对较高,但是总的来说酶活力低,无法用于实际生产中。从4号和5号培养基可以看出豆渣更适合为这个菌株提供氮源,所以决定由豆渣提供氮源,考虑加大培养基中氮源的量,即豆渣的含量,并且同时加入直接碳源葡萄糖,看直接碳源和氮源量的变化是否对菌株产木聚糖酶活力有影响。

表4 不同豆渣含量的培养基Table 4 The culture mediums contains different dosages of bean dregs
豆渣含量不同的培养基木聚糖酶活力如表5。

表5 不同豆渣含量培养基的木聚糖酶活力Table 5 The activities of xylanase produced by culture mediums with different bean dregs contents
如从表5所示结果,直接碳源葡萄糖对木聚糖酶活力没有影响,并且不加蛋白胨只加豆渣的培养基产的木聚糖酶活力是无法达到加入蛋白胨的培养基产的木聚糖酶活力的。所以,选择发酵培养基为3%麸皮水、0.5%蛋白胨、6%豆渣、pH自然。
4.3 不同接种量对产酶的影响
接种量是指种子培养液体积和发酵液体积之比。本实验选取在温度为28℃、转速为150r/min、初始pH值自然条件下,分别选择接种量为0.5%、1%、3%、5%、7%进行发酵实验,在72h取样测酶活。本实验研究不同接种量对产酶的影响,木聚糖酶活力如表6。

表6 不同接种量的木聚糖酶活力Table 6 The activities of xylanase produced with different inoculating dosages
如表6所示,接种量以1%最佳,此时产生的木聚糖酶活力最高。接种量过低,所需要的培养周期长,木聚糖酶活力降低;接种量过高,虽然培养时间缩短,但木聚糖酶活力达不到最佳值。
4.4 不同培养温度对产酶的影响
本实验分别选取发酵温度 20℃、25℃、28℃、32℃、转速为150r/min、初始pH值自然进行液体发酵,发酵时间为72h。测定各温度下的酶活力如表7。

表7 不同温度的木聚糖酶活力Table 7 The activities of xylanase produced at different temperature
如表7所示,温度对该菌木聚糖酶的产生有显著影响。培养温度为25~28℃时,有利于木聚糖酶的合成,此时木聚糖酶活力较高。低于25℃时温度偏低,菌体生长较慢,产酶活力较低,所以选择在28℃下发酵。
5 总 结
本实验研究表明合理的碳氮比对好食脉孢霉产木聚糖酶有很大的影响,合理的碳氮比有利于木聚糖酶的合成。
实验研究表明脉孢霉在3%麸皮水、1.5%蛋白胨、pH5.0的种子培养基中培养,摇瓶转速150r/min,发酵温度为28℃条件下培养12~32h后的种子培养液适宜接种到发酵培养基中。
液态发酵产酶培养基为:3%麸皮水、0.5%蛋白胨、6%豆渣、pH自然。最适接种量为1%(v/v),最适发酵温度为28℃。
本实验用的好食脉孢霉菌种,相对产孢子多,菌体生长旺盛,但木聚糖酶的产量不是很高,有待于进一步对细胞破碎后木聚糖酶的活力进行研究。液态发酵接种量和温度的控制对木聚糖酶的产量有很重要的影响。
∶
[1]刘同军,张玉臻.半纤维素酶的应用进展[J].食品与发酵工业,1998,24(6):58~61.
[2]邓开野,李玉,任露泉.菌物产物的研究进展[J].中国林副特产,2005,6:56~59.
[3]侯炳炎.木聚糖酶及其应用[J].动物科学与动物医学,2002,19(4):52~53.
[4]朱启忠,赵宏,韩晓弟,等.青霉菌m8产半纤维素酶条件及酶性质研究[J].生物技术,2003,13(5):12~13.
[5]洪新.黑曲霉发酵产木聚糖酶的条件优化[J].中国畜牧兽医,2005,32(7):15~17.
[6]汪世华,胡开辉,余文英,等.木聚糖酶液体发酵条件的试验[J].河南科技大学学报∶自然科学版,2005,26(4):89~91.
- 黑龙江科学的其它文章
- 黑木耳不同生长期栽培基质中营养成分变化研究*

