酸土环脂芽孢犴菌检测与控制技术研究进展
王伟军,陈丽安,李延华
(1.通化师范学院制药与食品科学系,吉林通化134002;2.哈尔滨工业大学食品学院,黑龙江哈尔滨150090)
酸土环脂芽孢犴菌检测与控制技术研究进展
王伟军1,2,陈丽安1,*,李延华2
(1.通化师范学院制药与食品科学系,吉林通化134002;2.哈尔滨工业大学食品学院,黑龙江哈尔滨150090)
酸土环脂芽孢杆菌是造成果汁变质的一种主要腐败菌。在生产实践中快速、准确的检测手段必不可少,同时对该菌进行控制是提高产品质量、减少污染的重要环节,特别是对其耐热芽孢的抑制。通过对酸土环脂芽孢杆菌生长、代谢特性的分析,重点阐述了该菌污染的检测技术和菌种的分离、鉴定方法;同时从果汁生产环节入手探讨了控制该菌的各种方法,并指出今后应该进行的研究方向。
酸土环脂芽孢杆菌,检测,控制
环脂芽孢杆菌属(Alicyclobacillus spp.)为非致病性、嗜热耐酸、严格需氧、芽孢形成菌[1-2]。该属与芽孢杆菌属的主要区别在于:16S rDNA序列的不同;Alicyclobacillus spp.菌体生物脂膜中存在独特的环状脂肪酸,使其具有在低pH和高温下生存的能力[2],膜脂中的脂环为六环或七环,位置在ω位。主要脂肪酸有11-环己基十一烷酸、13-环己基十三烷酸、分支十七烷酸(如14-甲基十六烷酸)以及11-环庚基-4-甲基十一烷酸。磷脂酰甘油的脂肪酸相对含量见表1。酸土环脂芽孢杆菌(A.acidoterrestris)是该属中的一种主要的腐败菌,可致酸性果汁变质,产生愈创木酚,使产品具有药味和腐败味等异味[3]。注:微量脂肪酸略。

表1 磷脂酰甘油的脂肪酸分布[4]
1 污染检测与菌种鉴定
果汁中A.acidoterrestris腐败是很难用肉眼检测的,因为腐败果汁通常看起来正常,带有轻微的沉淀,但没有气体产生[5]。目前,常见的检测途径有:发酵代谢产物和特性分析,如菌体代谢产物的生物图谱分析;通过镜检、菌落观察、生理生化实验等手段进行的生长和形态特征分析;以PCR为基础的分子生物学方法。
1.1 化学检测
根据该菌种产生异味物质的代谢特点,krueger食品实验室使用二氯甲烷提取果汁产品中愈创木酚,并进行 GC-MS分析,建立一套嗜热耐酸菌(ATB)造成果汁愈创木酚污染的检测方法。图1是ATB污染果汁(a)与正常果汁(b)的色谱图比较。

图1 ATB污染果汁(a)与正常果汁(b)的色谱图比较
仅凭一种代谢产物为指标判定 A.acidoterrestris菌污染是很难的[6]。这是因为并不是所有的Alicyclobacillus spp.都能产生愈创木酚;而且也存在其他微生物代谢产生愈创木酚的可能。但以一系列代谢产物(一般选择具有挥发性的风味影响物质)为指标就可能带来正确的判定。虽然还没有人依此进行菌种检测的尝试,但大量的基础研究都表明A.acidoterrestris菌 具 有 独 特 的 风 味 影 响。 在Alicyclobacillus spp.相关腐败研究中,愈创木酚和卤代酚(halophenols)被认为是造成异味的成分,虽然形成这些异味成分的确切代谢途径仍未被确定,但研究认为培养基中Alicyclobacillus spp.的存在是这些异味形 成 的 主 要 原 因[7]。 Siegmund 等[8]认 为A.acidoterrestris是造成苹果汁异味主要菌种,它们能产生大量异味成分,使在正常存贮条件下的果汁散发出药味和泥土味。
此外,Alicyclobacillus spp.菌体生物脂膜中存在独特的环状脂肪酸可作为一种指示物来完成检测。众所周知,以质谱为基础的多种检测技术可以较好地完成简单分子的图谱分析。Rodrigues等[9]使用GC/MS方法很好地测定了A.acidoterrestris菌菌体细胞膜萃取物(甲酯化)中的ω-环己基十一酸。
但是就复杂分子(如磷脂)而言,通过分析这类化合物(生物图谱)而确定一种检测手段较难做到。这种难度不仅在于能否确定和量化目标菌中某一磷脂衍生物分子,如双磷脂酰甘油(cardiolipin,细胞质膜中主要的阴离子性四酰基磷脂),同时要考虑到链长和不饱和度的差异,而数个酰基链上的脂肪酸的组合也会增加这种难度。Rezanka等[10]使用电喷雾质谱(ESI-MS)技术分析了A.acidoterrestris菌体脂质萃取物中的氧酰糖基化双磷脂酰甘油。图2为O-酰基甘露糖基双磷脂酰甘油结构。虽然已经表明这种电喷雾的多级质谱技术适合于双磷脂酰甘油这类化合物的结构表征研究[11-12],如脂肪酸取代基的连接位置,但是为了获得更完全的结构信息,核磁和酶解技术是必不可少的[10]。
傅里叶变换红外光谱(FTIR)也是常用的检测技术,其谱带能反映出这类耐热菌株间在细胞膜成分上的差异。Lin等[13]分析了波数在1500~800cm-1之间的细胞膜成分(或称其为“指纹图谱”),通过分析不同菌株光谱样品间的主要成分差异来检出目标菌。该方法与16S rDNA序列分析方法得出了相同的结果[14]。
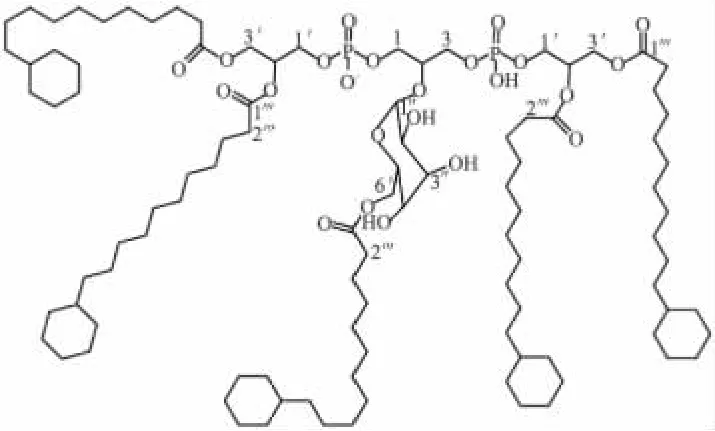
图2 O-酰基甘露糖苷双磷脂酰甘油
1.2 生物分离与鉴定
1.2.1 基本研究过程 在培养A.acidoterrestris菌时,通常需要热处理(heat-shock,如80℃,10 min),这显然有两种作用:杀死其他菌体以及促进A.acidoterrestris的芽孢萌发。如果样品中的目标菌很少,需进行富集,如0.45μm的微孔膜过滤后直接将膜放在酸性(如pH=3.7,也有更低的,如pH=3.5)培养基上培养。通常需要在45~50℃下培养2~5d才能得到菌落。选择革兰氏阳性、形成芽孢的菌落进行进一步的分离鉴定。
根据菌体生长和形态特征,也仅知道它们可能属于环脂芽孢杆菌属,使用传统的生理生化反应或生物技术可以进一步鉴定出它们属于哪个种,如借助UPGMA方法建立起来的 51种表型现象分析[15-16]、快速定性或定量的PCR鉴定技术。最后应该进行发酵实验,确定它们的污染特性。
1.2.2 培养与分离 酸化PDA、YSG和K氏培养基是目前应用于A.acidoterrestris分离与增殖的最为广泛的培养基。Murray等[17]考察了6株A.acidoterrestris菌在10种琼脂培养基上的生长效果,通过研究培养方法(倾注或涂布)、培养温度(43、50℃)以及培养时间(最多10d)对菌数的影响,认为涂布法优于倾注法;除一株菌之外,其它A.acidoterrestris菌的最适温度均为50℃;使用不同培养基分别在43℃和50℃下培养后得到了相同的芽孢数,另外,43℃培养3d本质上可以检测所有的芽孢。
1.2.3 鉴定技术 以PCR技术为基础建立起来多种快速的菌种鉴定技术。针对耐热菌的PCR检测,使用反转录(reverse transcriptase,RT)PCR方法可在24h内快速定性检测[18],但不能定量。Luo的研究小组[19-20]报道了实时PCR检测苹果汁中的耐热菌,可实现定量检测;李建科等[21]通过构建耐热菌竞争模板的引物,用获得的耐热菌竞争模板作为定量内标物,建 立 耐 热 菌 的 竞 争 定 量 (quantitatively competitive,QC)PCR快速检测方法。
2 控制方法
2.1 采后储存管理
A.acidoterrestris是一种嗜热的芽孢形成菌,能够污染酸性的果汁,在果园里,苹果可能被这些芽孢污染,从而可能导致其在果汁中生长并造成腐败,Lee等[22]研究发现气态的二氧化氯对苹果表面的A.acidoterrestris菌芽孢具有抑制效果,同时发现高强度处理可以将芽孢数量降到不可检出的水平,但苹果感官质量下降;如果低强度长时间处理也能得到很好的抑制效果,而且感官质量无明显变化。鉴于二氧化氯的效果,可以将其用于苹果储存和运输中对质量的控制,但其使用安全性值得注意。
2.2 果汁杀菌措施
A.acidoterrestris菌生长的温度范围是25~60℃。其芽孢能够生长在pH小于4的环境中,90℃时D值为16~23min[23-24]。K.Savas等[6]研究了pH、温度以及抗坏血酸浓度对苹果汁产品中嗜酸耐热菌芽孢D值的影响,结果表明温度是最主要的因素,它的影响要比pH的影响大3倍,而抗坏血酸(经常在果汁产品中做添加剂)的影响甚微。此外,培养条件(如果汁酸度或可溶性固形物含量)可以影响芽孢耐热性,但在传统的果汁巴氏杀菌后仍能存活[25]。
20世纪90年代以来,传统(如有机酸和商业消毒剂)和非传统(如二氧化氯、细菌素、溶菌酶、植物精油)的化学抑菌物质都被用于A.acidoterrestris菌及其芽孢的抑制研究。但是在消费者倡导绿色安全以及食品工业准备逐渐淘汰化学防腐剂的大背景下,天然化合物或者非热杀菌方法(如高压、微波和辐照等技术)可以在这个领域大显身手,本文的论述重点也依此原则展开。
2.2.1 天然植物抑菌剂 使用天然产物控制A.acidoterrestris在酸性食物中的生长已成为共识[26-27]。Bevilacqua等的研究表明,肉桂醛具有很好的抑菌效果[28],但肉桂醛对产品感官具有很大的影响。因此,可减少的肉桂醛使用量,或与其他手段复合使用[29];新型抗菌剂的开发应该是未来的研究方向。此外,也可以尝试使用天然的具有抗菌作用的植物精油(含有多种天然产物),即使它们的组成成分和作用机制尚不明确。
2.2.2 细菌素 Nisin是提取自乳酸乳球菌乳酸亚种的一种抗菌肽,对革兰氏阳性菌具有很好的抑制效果,对A.acidoterrestris的细胞和芽孢的抑制也得到了广泛的证实[30-31]。Walker和 Phillip的研究表明,5~10IU/mL的Nisin单独使用或者与苯甲酸钠或山梨酸钾复配使用对A.acidoterrestris都有显著的抑制效果[23]。其具体的使用量显然应该根据果汁类型、酸度以及固形物含量等因素来决定。Nisin可以直接添加到果汁中,也可以使用缓释技术以控制产品在存储过程中的腐败问题[31]。
另外,也应该研究和开发出对A.acidoterrestris营养体和芽孢有抑制作用的其他细菌素。Grande等[32]研究了肠球菌产生的抗菌素(enterocin AS-48)对A.acidoterrestris的抑制作用,在市售果汁中加入2.5μg/mL抗菌素,并接入A.acidoterrestris的营养体或者芽孢,在随后的37、15、4℃下90d培养中电镜观察该菌细胞的变化,发现该菌营养体和芽孢受到了实质性的损坏:细菌被降解,芽孢结构遭到破坏。
2.2.3 物理杀菌 高静水压可以使A.acidoterrestris的营养体和芽孢失活,此前的研究表明:通常使用的压力范围是200~620MPa;芽孢较营养体有更强的耐受性;杀菌效果受温度和作用时间的影响;能失活芽孢的压力(>600MPa)与高温一样会带来产品感官问题。在有关高均质压的研究中也遇到了相似的问题,虽然二者的作用机理不同:高静水压先使芽孢萌发然后灭活,而高均质压通过破坏细胞壁和生物质膜起作用。
辐射(UV、X和γ射线、电子束等)杀菌的作用机理可能是通过产生自由基破坏细胞DNA来实现的。Nakauma等[33]研究表明,通过与传统的热杀菌相结合,能够得到与高强度热处理相同的效果,并且能够有效抑制热杀菌尾效应(传统的热杀菌能快速的杀死芽孢,但随后未被杀死的芽孢具有很强的耐热性)。
微波技术已被应用于芽孢的灭活处理。Celandroni等[34]通过与传统的热杀菌相比较认为:微波处理会促使芽孢中特有的成分2,6-吡啶二羧酸(DPA)的释放,而且与热杀菌造成的芽孢细胞微观结构损害有明显差异。Giuliani等[35]将微波技术应用到A.acidoterrestris的灭活实验表明:微波强度和作用时间是决定因素,并指出针对不同的溶液体系,其杀菌效果可能不同。
2.3 加工过程控制
保持工厂加工环境的清洁卫生是十分必要的。常用消毒剂次氯酸盐在消除器皿和设备表面对A.acidoterrestris耐热芽孢的效率不高,而二氧化氯水溶液,如100mg/kg处理10min可以有效杀灭加工环境中耐热菌芽孢[36]。此外果汁成品除氧密封也是抑制A.acidoterrestris增殖的有效手段。
3 小结
根据生长和形态特征、代谢产物特征以及遗传特征都可以进行A.acidoterrestris定性检测。生长和形态特征方法耗时费力,但准确性高,是基础研究的重要方法;代谢产物方法重点是检测果汁的污染情况,具有实践性强、操作方便快捷的特点;遗传特征方法精度高,但检测成本昂贵。另外,生长和形态特征分离后结合平板计数的方法以及PCR方法都可以定量检测。
通过控制A.acidoterrestris的生长,使用复合杀菌手段将是抑制果汁腐败的有效途径。使用非传统的杀菌方法将会受到更多的重视,但具体的应用细节需要做深入研究,例如天然杀菌剂的开发、不同杀菌手段之间的相互作用、溶液体系、食品品质的影响。
[1]Chang S S,Kang D H.Alicyclobacillus spp.in the fruit juice industry:History,characteristics,and current isolation/detection procedures[J].Critical Reviews in Microbiology,2004,30(2):55-74.
[2]Wisotzkey J D,Jurtshuk P,Fox G E,et al.Comparative sequence analysis on the 16s rRNA DNA ofBacillus acidocaldarius,Bacillus acidoterrestris and Bacillus cycloheptanicus and proposal for creation of new genus Alicyclobacillus[J].Int J Syst Bacteriol,1992,44:263-269.
[3]Yamazaki K,Okubo T,Inoue N,et al.Randomly amplified polymorphic DNA(RAPD)for rapid identification of the spoilage bacterium Alicyclobacillus acidoterrestris[J].Bioscience,Biotechnology,and Biochemistry,1997,61:1016-1018.
[4]Rezanka T,Siristova L,Melzoch K.Identification of(S)-11-cycloheptyl-4-methylundecanoic acid in acylphosphatidylglycerol from Alicyclobacillus acidoterrestris[J].Chemistry and Physics of Lipids,2009,159:104-113.
[5]Sinigaglia M,Corbo M R,Altieri C,et al.Combined effects of temperature,water activity,and pH on Alicyclobacillus acidoterrestris spores[J].Journal of Food Protection,2003,66:2216-2221.
[6]Bahceci K S,Acar J.Determination of guaiacol produced by Alicyclobacillus acidoterrestris in apple juice by using HPLC and spectrophotometric methods,and mathematicalmodeling of guaiacol production[J].Eur Food Res Technol,2007,225:873-878.
[7]Siegmund B,Zierler B P.Growth behavior of off-flavorforming microorganisms in apple juice[J].J Agric Food Chem,2007,55(16):6692-6699.
[8]Siegmund B,Zierler B P,Fannhauser W.Formation and determination of microbially-derived off-flavour in apple juice[J].Developments in Food Science,2006,43:277-280.
[9]Rodrigues D C,de Vasconcellos S P,Alves P B.Relationship between cyclohexyl-alkanoic acids and the acidothermophilic bacterium Alicyclobacillus spp.:Evidence from Brazilian oils[J].Organic Geochemistry,2005,36:1443-1453.
[10]Rezanka T,Siristova L,Melzoch K.Direct ESI-MS analysis of O-acyl glycosylated cardiolipins from the thermophilic bacterium Alicyclobacillusacidoterrestris[J].Chemistryand Physics of Lipids,2009,161:115-121.
[11]Hsu F F,Turk J.Characterization of cardiolipin as the sodiated ions by positive-ion electrospray ionization with multiple stage quadrupole ion-trap mass spectrometry[J].J Am Soc Mass Spectrom,2006,17:1146-1157.
[12]Hsu F F,Turk J,RhoadesE R,etal.Structural characterization of cardiolipin by tandem quadrupole and multiple-stage quadrupole ion-trap mass spectrometry with electrospray ionization[J].J Am Soc Mass Spectrom,2005,16:491-504.
[13]Lin M S,Al-Holy M,Chang S S.Rapid discrimination of Alicyclobacillus strains in apple juice by Fourier transform infrared spectroscopy[J].International Journal of Food Microbiology,2005,105:369-376.
[14]Lin M S,Al-Holy M,Al-Qadiri H.Phylogenetic and spectroscopic analysis of Alicyclobacillus isolates by 16SrDNA sequencing and mid-infrared spectroscopy[J].Sens&Instrumen Food Qual,2007,1:11-17.
[15]Sahin N.Isolation and characterization of mesophilic,oxalatedegrading Streptomyces from plant rhizosphere and forest soils[J].Naturwissenschaften,2004,91(10):498-502.
[16]Chen S Q,Tang Q Y,Zhang X D,et al.Isolation and characterization ofthermo-acidophilic endospore-forming bacteria from the concentrated apple juice- processing environment[J].Food Microbiology,2006,23:439-445.
[17]Murray M B,Gurtler J B,Ryu J H,et al.Evaluation of direct plating methods to enumerate Alicyclobacillus in beverages[J].International Journal of Food Microbiology,2007,115(1):59-69.
[18]Yamazaki K,Teduka H,Inoue N,et al.Specific primers for detection of Alicyclobacillus acidoterrestris by RT-PCR[J].Letters in Applied Microbiology,1996,23:350-354.
[19]Luo H L,Yousef A E,Wang H H.A real-time polymerase chain reaction-based method for rapid and specific detection of spoilage Alicyclobacillus spp.in apple juice[J].Letters in Applied Microbiology,2004,39(4):376-382.
[20]Connora C J,Luo H L,Brian B,et al.Development of a real-time PCR-based system targeting the 16S rRNA gene sequence for rapid detection of Alicyclobacillus spp.in juice products[J].International Journal of Food Microbiology,2005,99:229-235.
[21]李建科,冯再平,仇农学.耐热菌的竞争定量PCR检测方法优化与建立[J].中国农业科学,2006,39(2):375-380.
[22]Lee S Y,Dancer G I,Chang S S,et al.Efficacy of chlorine dioxide gas against Alicyclobacillus acidoterrestris spores on apple surfaces[J].International Journal of Food Microbiology,2006,108(3):364-368.
[23]Walker M,Phillps C A.The effect of preservatives on Alicyclobacillus acidoterrestris and Propionibacterium cyclohexanicum in fruit juice[J].Food Control,2008,19(10):974-981.
[24]Nakauma M,Saito K,Katayama T,et al.Radiation-heat synergism for inactivation of Alicyclobacillus acidoterrestris spores in citrus juice[J].J Food Prot,2004,67(11):2538-2543.
[25]Bevilacqua A,Sinigaglia M,Corbo M R.Alicyclobacillus acidoterrestris:New methods for inhibiting spore germination[J].International Journal of Food Microbiology,2008,125:103-110.
[26]Bevilacqua A,Corbo M R,Sinigaglia M.Inhibition of Alicyclobacillus acidoterrestris spores by natural compounds[J].International Journal of Food Science and Technology,2008,43:1271-1275.
[27]Pena W E,De Massanguer,P R.Microbial modeling of Alicyclobacillus acidoterrestris CRA 7152 growth in orange juice with nisin added[J].Journal of Food Protection,2006,69:1904-1912.
[28]Bevilacqua A,Corbo M R,Sinigaglia M.Combined effects of pH and cinnamaldehyde in inhibiting Alicyclobacillus acidoterrestris spores[J].JournalofFood Processing and Preservation,2008,32:839-852.
[29]Bevilacqua A,Corbo M R,Sinigaglia M.Combining eugenol and cinnamaldehyde to control the growth of Alicyclobacillus acidoterrestris[J].Food Control,2010,21:172-177.
[30]Yamazaki K,Murakami M,Kawai Y,et al.Use of nisin for inhibition of Alicyclobacillus acidoterrestris in acidic drinks[J].Food Microbiology,2000,17(3):315-320.
[31]BuonocoreG G,SinigagliaM,CorboM R,etal.Antimicrobial release systems from highly swellable polymers[J].Journal of Food Protection,2004,67:1190-1194.
[32]Grande M J,Lucas R,Abriouel H,et al.Control of Alicyclobacillus acidoterrestris in fruit juices by enterocin AS-48[J].International Journal of Food Microbiology,2005,104(3):289-297.
[33]Nakauma M,Saito K,Katayama T,et al.Radiation-heat synergism for inactivation of Alicyclobacillus acidoterrestris spores in citrus juice[J].Journal of Food Protection,2004,67:2538-2543.
[34]Celandroni F,Longo I,Tosoratti N,et al.Effect of microwave radiation on Bacillus subtilis spores[J].Journal of Applied Microbiology,2004,94:1220-1227.
[35]Giuliani R,Bevilacqua A,Corbo M R,et al.Use of microwave processing to reduce the initial contamination by alicyclobacillus acidoterrestris in a cream of asparagus and effect of the treatment on the lipid fraction[J].Innovative Food Science and Emerging Technologies,2009,in press.
[36]Friedrich L M,Schneider R G,Parish M E,et al.Mitigation of Alicyclobacillus spp.spores on food contact surfaces with aqueous chlorine dioxide and hypochlorite[J].Food Microbiology,2009,26:936-941.
Research progress in detection and control of Alicyclobacillus acidoterrestris
WANG Wei-jun1,2,CHEN Li-an1,*,LI Yan-hua2
(1.Department of Pharmercutics and Food Science,Tonghua Normal University,Tonghua 134002,China;2.Department of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090,China)
Alicyclobacillus acidoterrestris has been recognized as a significant spoilage organism in fruit juice.It is important part to detect them rapidly and accurately and to control them,especially their heat-resistant spores,for a high quality and less pollution in the juice products.It focused on the detection technologies and the separation and identification methods by analyzing growth and metabolism characteristics of A.acidoterrestris,discussed various control means from the view of juice production chain,and pointed out the direction that future research should be conducted.
Alicyclobacillus acidoterrestris;detection;control
TS201.3
A
1002-0306(2011)04-0437-05
2010-11-27 *通讯联系人
王伟军(1979-),男,博士研究生,讲师,研究方向:食品科学。
吉林省教育厅“十一五”科学技术研究项目(2008220);通化师范学院自然科学院级项目(2008027)。

