真菌产人参皂苷葡萄糖苷酶基因的调取
杜 枫, 金 凤 燮, 鱼 红 闪
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
人参的有效成分主要包括人参皂苷、多糖等[1]。人参皂苷在延缓衰老和治疗老年性疾病及其引起的认知性功能障碍和性功能障碍等方面均有很好的疗效,并且具有抑制肿瘤的生长、调节机体免疫功能的作用[2-3]。人参皂苷是由糖和苷元相连而成的糖苷类化合物[4]。其中Rb1、Rd、Re等皂苷含量较高,而Rh1,Rh2和C-K等则非常稀有。本实验室筛选出的AbsidiaSp.R84g菌株所产的人参皂苷糖苷酶可以水解Rb1为F2和C-K,此酶暂命名为人参皂苷葡萄糖苷酶,英文缩写为GluGF。本实验室前期实验测得该酶的最适酶反应温度为30 ℃、最适酶反应pH为5.0,酶蛋白分子质量约为71 ku,但其基因未知。本文应用RACE法调取该菌株产GluGF基因。
1材料方法
1.1 材 料
1.1.1 菌 株
Absidiasp.R84g菌株由大连工业大学生物与食品工程学院菌种保藏所提供。
1.1.2 培养基
采用麸皮浸出液40 mL +人参浸出液60 mL,经过121 ℃、20 min高压高温灭菌后使用。
1.1.3 设备仪器
电泳仪,高速冷冻离心机,PCR仪,快速离心机,紫外分析仪,快速混匀器,分光光度计。
1.1.4 主要试剂
TaKaRa RNAiso Reagent,Clontech SMARTTMRACE cDNA Amplification Kit, TaKaRa LA Taq,DNaseI(RNase Free),RNase Inhibitor,DNA Marker,TaKaRa Agarose Gel DNA Purification Kit, High Fidelity PrimeScriptTMRT-PCR Kit等,Takara公司;苯酚、氯仿、乙醇、琼脂糖,异戊醇等,科密欧(天津)化学试剂有限公司。
1.2 方 法
1.2.1 简并引物
根据测得的人参皂苷葡萄糖苷酶蛋白N端序列ATLDSWLSNEATVAR,并借助软件Primer Premier 5.0[6]试剂盒中找到相应的5′-CDS Primer与3′-CDS Primer。
1.2.2 总RNA的提取和检测
使用RNAiso Reagent提取总 RNA:菌体经低温冻结后加入适量液氮后研磨,滴加RNAiso匀浆并于室温下静置5 min随后滴加氯仿(1/5 RNAiso体积),于室温下静置5 min再经由12 000 r/min 4 ℃离心15 min,然后移至新离心管滴加等体积的异丙醇,于室温下静置10 min,再经由12 000 r/min 4 ℃离心10 min并向沉淀中滴加乙醇,然后12 000 r/min 4 ℃离心5 min后弃上清,将沉淀用适量DEPC水溶解,取1 μL进行3%琼脂糖凝胶电泳。
1.2.3 RT-PCR扩增出cDNA片段
使用RT-PCR试剂盒进行反转录合成cDNA,同时设立M-MLV(-)对照。
5′RACE:反应体系中含有RNA,5′-CDS Primer,BD SMART A oligo, Sterile H2O反应所采用的条件为70 ℃,2 min,反应结束后立即放置于冰上2 min。随后加入5×First-Strand Buffer、200 μL Reverse Transcriptase M-MLV(RNase H),dNTP(10 mmol/L)与DTT(20 mmol/L)继续反应,反应所采用的条件为42 ℃、90 min,滴加100 μL Tricine-EDTA buffer继续反应,反应条件为72 ℃、7 min。
3′RACE:反应体系中含有RNA、3′-CDS Primer、Sterile H2O,反应条件为70 ℃、2 min。反应后立即冰上放置2 min,加入5× First-Strand Buffer、200 μL Reverse Transcriptase M-MLV(RNase H),DTT(20 mmol/L)和dNTP(10 mmol/L)继续反应,反应条件为42 ℃、90 min,然后加入100 μL Tricine-EDTA buffer继续反应,反应条件为72 ℃、7 min。
1.2.4 cDNA3′、5′RACE法全长扩增
1.2.4.1 引物设计
使用软件Primer Premier 5.0[5],根据RT-PCR得到的cDNA片段,同时参考真菌偏爱的密码子,设计特异性引物如下:
3′RACE上游外侧引物F3:
5′-CCCTTTTAGACGCAACTGAGAGC-3′
23 mers
3′RACE上游内侧引物F4:
5′-CCCAGCATCATTACTCCTCAGCA-3′
23 mers
5′RACE R1:
5′-AGC NAC NGT NGC YTC RTT-3′
18 mers
1.2.4.2 Outer PCR反应
根据5′和3′-Full RACE 试剂盒的操作手册中的方法,分别配置含5′RACE Outer Primer、LA Taq,3′RACE Outer Primer以及特异性引物F3、F4,R1的Outer PCR反应液,采用反转录得到的产物作为模板进行Outer PCR反应。
1.2.4.3 Inner PCR反应
根据5′和3′-Full RACE Kit的操作手册中的方法,采用Outer PCR反应中得到的产物作为模板进行Inner PCR反应。分别取反应液5 μL,应用3%和1%琼脂糖凝胶电泳进行检测。
1.2.4.4 产物回收及测序
采用产物回收试剂盒中提供的手册中的方法,进行PCR产物回收操作,并送交TaKaRa公司进行序列测定。
2 结果与讨论
2.1 总RNA提取结果检测
用“1.2.2”的方法提取总 RNA,采用RNA纯化法除去样品中的染色体DNA。纯化后取1 μL进行3%琼脂糖凝胶电泳检测,结果如图1所示。从图1可以看出,染色体DNA已基本被除去,RNA条带清晰,完整性较好。测得A260/A280约为1.95,可以进行反转录操作。

1,DNase I处理的总RNA;M,DL 2000 DNA Marker
2.2 cDNA 3′、5′ RACE法全长扩增结果
2.2.1 cDNA 5′RACE扩增结果
经反转录合成cDNA的片段,进行套式PCR反应和反转录反应后,取5 μL反应液进行3%的琼脂糖凝胶电泳,结果见图2。由图2可以看出,在250 bp处以下有清晰条带。对PCR产物切胶回收,测序得长度为154 bp。

1,5′RACE PCR产物;2,M-MLV(-)对照;M,DL 2000 DNA Marker
2.2.2 cDNA 3′RACE扩增结果
经过反转录得到cDNA片段,进行套式PCR反应和反转录反应后,吸取5 μL反应液采用3%琼脂糖凝胶电泳进行检测,检测结果见图3。由图3可以看出在2 000 bp左右有清晰条带。对PCR产物切胶回收,测序得长度为1 920 bp。
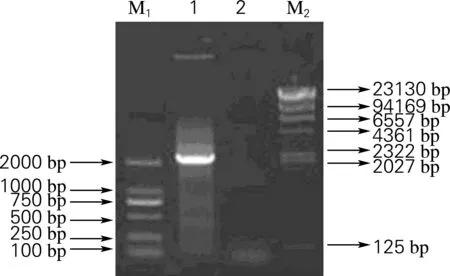
1,3′RACE PCR产物;2,M-MLV(-)对照;M1,DL 2000 DNA Marker;M2,λ-Hind Ⅲ DNA Marker
2.3 产物GluGF基因全序列的获得
根据实验测得的5′和3′RACE产物序列,再次设计引物进行二次RT-PCR得到反应液,取1 μL进行琼脂糖凝胶电泳,结果如图4所示。由图4可以看出在2 000 bp处有清晰条带。

1,二次RT-PCR产物; M,DL 2000 DNA Marker
将得到的二次RT-PCR产物测序得到产GluGF基因全序列。应用SequencherTM软件分析确定其CDS区并翻译成氨基酸序列,包括640个氨基酸,CDS区全长为1 923 bp。使用Propsearch软件计算其组成的蛋白质分子质量约为70.4 ku,与实验前期得到的人参皂苷葡萄糖苷酶的分子质量71 ku基本一致,因此可以认定所得到的序列是目的基因的序列。
3 结 论
根据人参皂苷糖苷酶的N端氨基酸序列设计简并引物,以RT-PCR得到cDNA片段,采用3′与5′端的特异性引物,以菌种总RNA为模板进行扩增,得到cDNA3′及5′末端的基因序列,进而得到目的基因的CDS区全序列。将得到的序列翻译成氨基酸,经计算可知由其编码的蛋白质分子质量约为70.4 ku,与前期实验纯化出的人参皂苷糖苷酶的分子质量71 ku基本一致,可以认定所得目的基因的CDS区全序列是正确的。
[1] 白龙律,臧蕴霞,尹成日. 微生物转化人参皂苷Rb1为Rg3的研究[J]. 延边大学学报, 2009, 35(2):141-144.
[2] SHIBATA S. Future development of ginseng studies[M]. Tokyo:Hirokawa Publishing Company, 1989:145-148.
[3] 张均田. 人参研究的回顾和展望[J]. 药学学报, 1995, 30(5):321-325.
[4] 张怡轩,陈晓莹,赵文倩. 人参皂苷生物转化的研究进展[J]. 沈阳药科大学学报, 2008, 25(5):419-422.
[5] 任亮,朱宝芹,王海燕,等. 利用软件Primer Premier 5. 0进行PCR引物设计的研究[J]. 锦州医学院学报, 2004, 25(6):43-46.

