刺参体壁胶原蛋白的检测条件
赵 兴 坤, 朱 蓓 薇, 董 秀 萍, 周 大 勇, 杨 静 峰, 秦 磊, 刘 海 英
(1.大连工业大学 海洋食品教育部工程研究中心, 辽宁 大连 116034;2.大连工业大学 农业部农产品加工技术研发贝类专业分中心, 辽宁 大连 116034;3.时代海洋食品(大连)有限公司, 辽宁 大连 116044)
0 引 言
胶原蛋白是动物结缔组织,如皮、腱、韧带、软骨等的主要蛋白成分,广泛应用于医药、化妆品、食品、饲料等工业中。不同来源的胶原具有不同的化学组成和结构。胶原蛋白含有大量的甘氨酸、脯氨酸、羟脯氨酸等,其中羟脯氨酸和羟赖氨酸在其他蛋白中很少见,为胶原蛋白所特有。通过对羟脯氨酸的检测可以较准确地反映胶原蛋白的含量情况,但是在测定羟脯氨酸前需对胶原蛋白进行酸水解。传统的酸水解方法是在110 ℃使用6 mol/L的盐酸水解24 h,此方法水解时间较长,同时,由于水解时间不同会导致胶原蛋白水解片段(肽链)长度不同,羟脯氨酸的测定值也会随之产生变化[1],因而,传统方法很难准确反映不同来源胶原蛋白中羟脯氨酸的含量。
刺参(Stichopusjaponicus)体壁主要由蛋白质组成,而刺参体壁蛋白中约有70%是胶原蛋白。胶原蛋白的质量分数可以通过测定其中羟脯氨酸的质量分数来间接确定,为了简化刺参体壁胶原蛋白质量分数检测的操作,本研究计划对刺参体壁酶促溶性胶原蛋白(pepsin-solubilized collagen,PSC)和酸溶性胶原蛋白(acid-soluble collagen,ASC)的水解条件分别进行优化,并对PSC和ASC中羟脯氨酸质量分数进行测定。
1 材料和方法
1.1 材 料
新鲜刺参(Stichopusjaponicus),产地为大连海洋岛。
氯胺T晶体,分析纯,天津傲然精细化工研究所;高氯酸,分析纯,天津市新亚化工厂;对二甲氨基苯甲醛,分析纯,天津市化学试剂研究所;羟脯氨酸,Sigma。
UV-2100型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;PH070A型培养箱/干燥箱,上海一恒科技有限公司。
1.2 试剂的配制
1.2.1 缓冲液
取柠檬酸5.0 g、醋酸1.2 mL、醋酸钠12.0 g、氢氧化钠3.4 g,混合后定容至100 mL,pH为6.0,冷藏保存。
1.2.2 氯胺T溶液
准确称取氯胺T 1.4 g,加入蒸馏水20 mL,异丙醇30 mL和缓冲液50 mL,混合均匀。
1.2.3 高氯酸溶液
量取高氯酸27 mL,加水定容至100 mL。
1.2.4 对二甲氨基苯甲醛溶液
称取对二甲氨基苯甲醛2 g,加入60%高氯酸7 mL,异丙醇13 mL,混匀后冷藏保存。
1.3 方 法
1.3.1 刺参酶促溶性胶原蛋白和酸溶性胶原蛋白的提取
刺参体壁胶原纤维的提取方法在文献[2-5]基础上稍做修改。称取50 g体壁切成碎块,加入适量的去离子水,打浆,水洗2次,盐洗过夜,水洗至中性,碱洗3 d,水洗至中性得粗胶原纤维。
将粗胶原纤维用乙酸进行酸提,用NaCl进行盐析,用10倍体积乙酸透析12 h,每4 h换1次透析液,再用去离子水透析至中性,冻干得酸溶性胶原蛋白。
酸提后的不溶物,用去离子水冲洗,放在2倍体积乙酸中,加入胃蛋白酶,缓慢搅拌3 d,加入NaCl盐析,于10倍体积NaH2PO3中透析24 h,每4 h换1次透析液,再用去离子水透析至中性,冻干得酶促溶性胶原蛋白。
1.3.2 刺参体壁酶促溶性胶原蛋白和酸溶性胶原蛋白中羟脯氨酸质量分数的测定
取待测胶原蛋白样品7 mg于安醅瓶中,加入3 mL 6 mol/L盐酸溶液,酒精喷灯封口。封口的安醅瓶置于烘箱中保温一定时间后,将水解液移至小烧杯中,滴入1滴甲基红试剂,然后加入2 mol/L NaOH中和至pH 6.5~7.0,定容至50 mL。取定容后溶液1 mL,加入1 mL柠檬酸缓冲液和1 mL氯胺T溶液在室温(25 ℃)氧化10 min,加入27%高氯酸1 mL放置10 min,加入对二甲基氨基苯甲醛1 mL,振荡,65 ℃水浴显色20 min,立即冷却后在560 nm处测其吸光度,吸光值越大表示羟脯氨酸质量分数越高。
1.3.3 标准曲线的制作
分别吸取不同浓度羟脯氨酸标准溶液1 mL(溶于0.01 mol/L盐酸),加入1 mL柠檬酸缓冲液和1 mL氯胺T溶液在室温(25 ℃)氧化10 min,加入27%高氯酸1 mL放置10 min,加入对二甲基氨基苯甲醛1 mL,振荡,65 ℃水浴显色20 min,立即冷却后在560 nm处测吸光度。以羟脯氨酸的质量分数为横坐标,吸光值为纵坐标制作羟脯氨酸标准曲线如图1所示。羟脯氨酸的标准曲线的回归方程为y=0.059x-0.003,归一化系数R2=0.999 3。
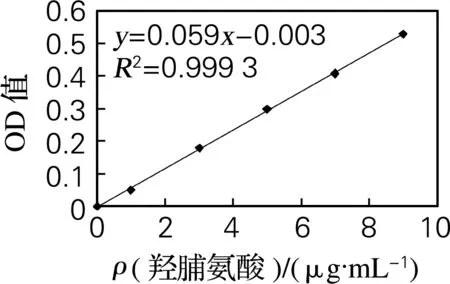
图1 羟脯氨酸标准曲线
1.3.4 水解条件的优化
酶促溶性胶原蛋白和酸溶性胶原蛋白在110、115、120、125和130 ℃ 5个温度下,分别水解2~30 h,时间间隔为2 h,选取所测羟脯氨酸的质量分数最高的条件为最佳水解条件。
2 结果与讨论
2.1 刺参体壁PSC和ASC最佳水解条件的确定
羟脯氨酸的吸光值随时间的变化如图2所示。由图2可知,在110、115、120、125和130 ℃的水解温度下,PSC分别水解12、10、6、6和4 h时羟脯氨酸的吸光值最高。在不同水解温度的最佳水解时间条件下,羟脯氨酸的吸光值的变化如图3所示。可以看出,PSC在120 ℃水解6 h时,所测得羟脯氨酸的吸光值最高,说明此水解条件能充分释放胶原蛋白中所含有的羟脯氨酸,因此PSC的最佳水解条件确定为温度120 ℃,时间6 h。
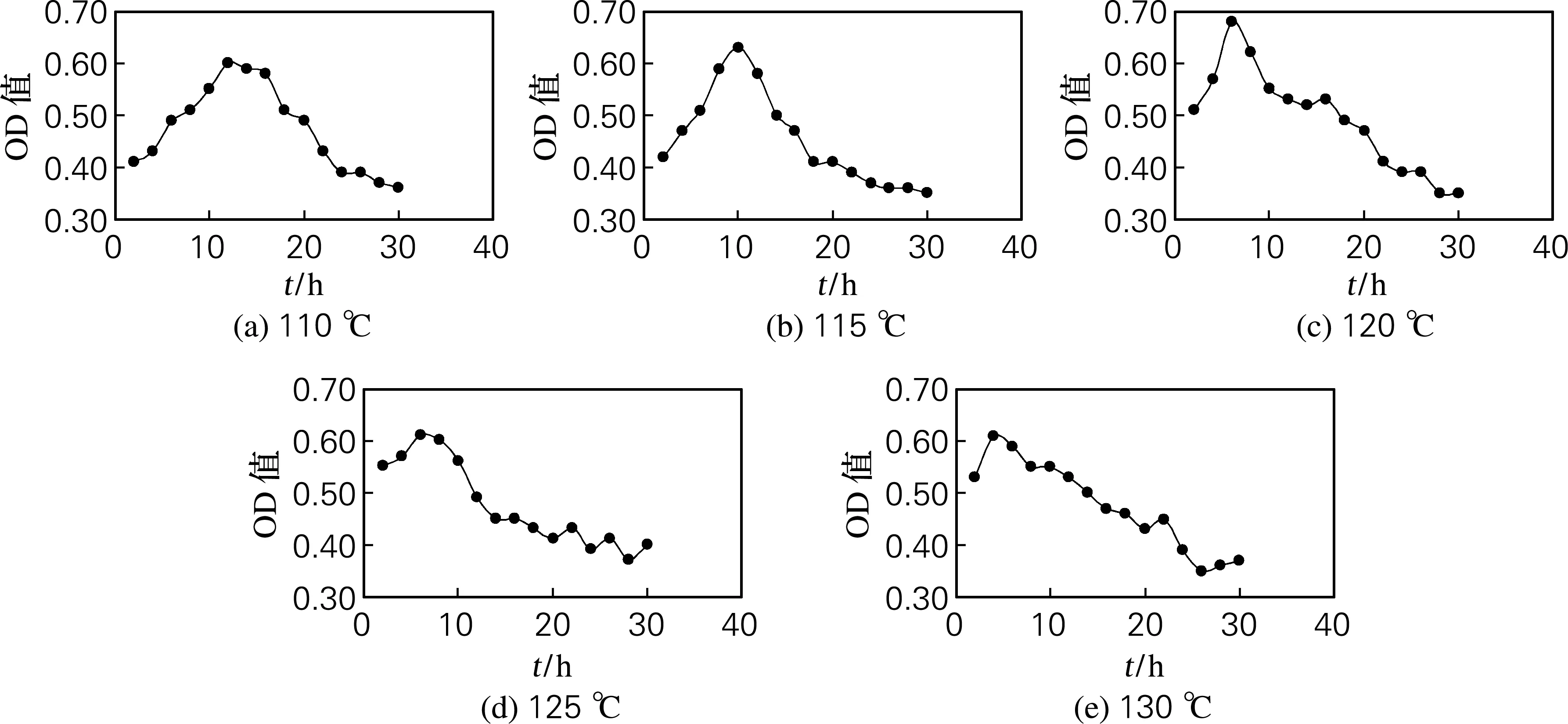
图2 PSC在不同水解温度下的羟脯氨酸的吸光值随水解时间变化趋势

图3 PSC在不同水解温度的最佳水解时间下的羟脯氨酸的吸光值变化
Fig.3 Hydroxyproline contents of PSC hydrolyzed at different temperature and time
由图4可知,ASC在110、115、120、125和130 ℃水解时,相应水解时间分别为14、10、6、6和4 h时羟脯氨酸的吸光值最高。在不同水解温度的最佳水解时间条件下,羟脯氨酸的吸光值的变化如图5所示。可以看出,ASC在 120 ℃水解时,所测得羟脯氨酸的吸光值最高,说明此水解条件能充分释放胶原蛋白中所含有的羟脯氨酸,因此ASC最佳水解条件也确定为温度120 ℃,时间6 h。
由图2、4分析可知,胶原蛋白在不同的水解温度均存在一个最佳水解时间,在同一温度水解时,羟脯氨酸的吸光值的变化趋势是先上升后下降,水解20 h以后,所测得羟脯氨酸的吸光值趋于平稳,上下波动幅度不大。这是由于胶原蛋白在水解初期,羟脯氨酸逐渐释放出来,待胶原蛋白完全水解,充分释放羟脯氨酸后,游离的羟脯氨酸会随着水解时间延长而逐渐分解,导致所测得羟脯氨酸的吸光值下降,但最终会趋于平稳,这可能是由于引起羟脯氨酸分解的化学反应趋于平衡所致。
2.2 刺参体壁PSC和ASC中羟脯氨酸的质量分数的测定
由图3和图5分析可知,刺参体壁中酶促溶性胶原蛋白和酸溶性胶原蛋白的最佳水解条件均为温度120 ℃,时间6 h。在最佳水解条件下,可测得酶促溶性胶原蛋白中羟脯氨酸的质量分数为8.29%,酸溶性胶原蛋白中羟脯氨酸的质量分数为8.16%。此结果与文献所报道过的海参(Cucumariafrondosa)羟脯氨酸的质量分数占其胶原蛋白7.7%[6]的结论相接近。
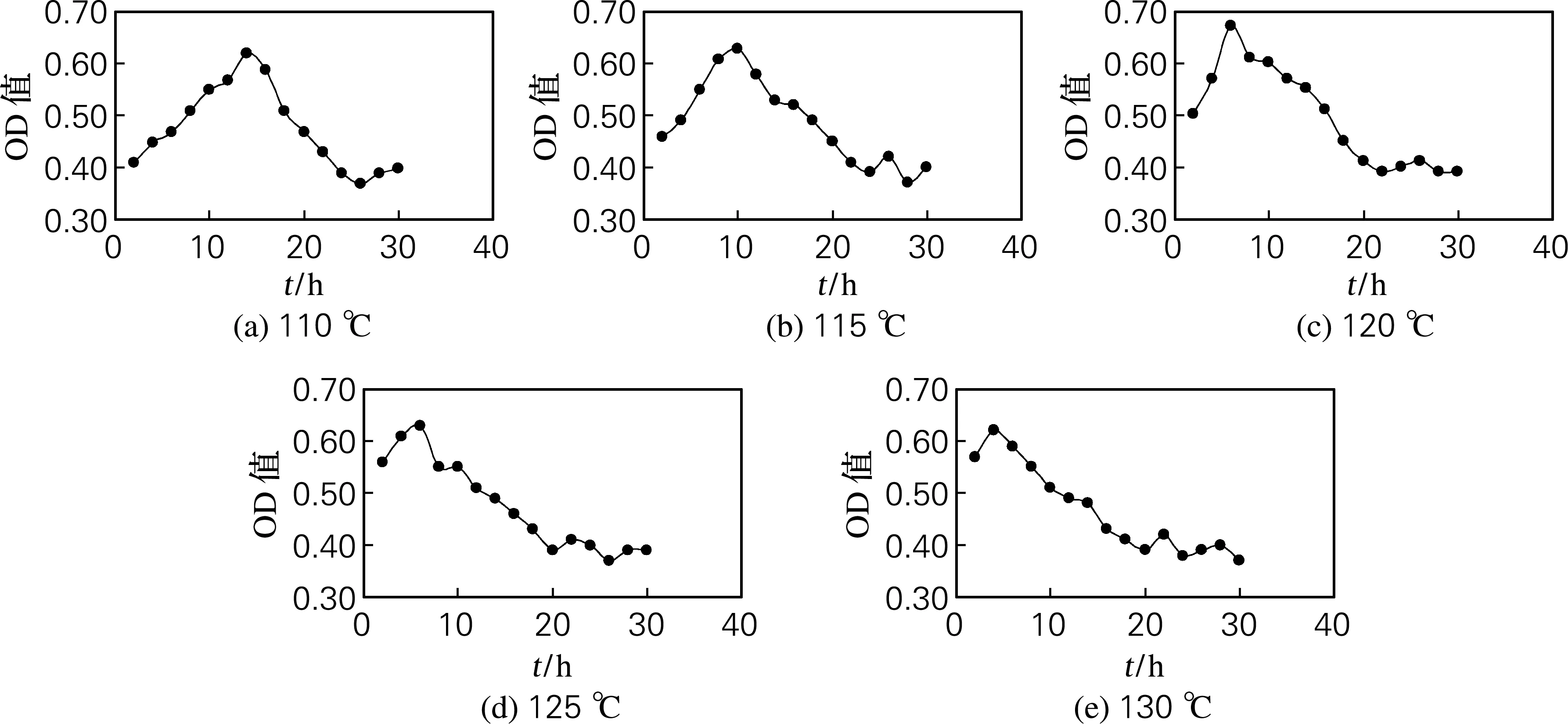
图4 ASC在不同水解温度下的羟脯氨酸的吸光值随水解时间变化趋势
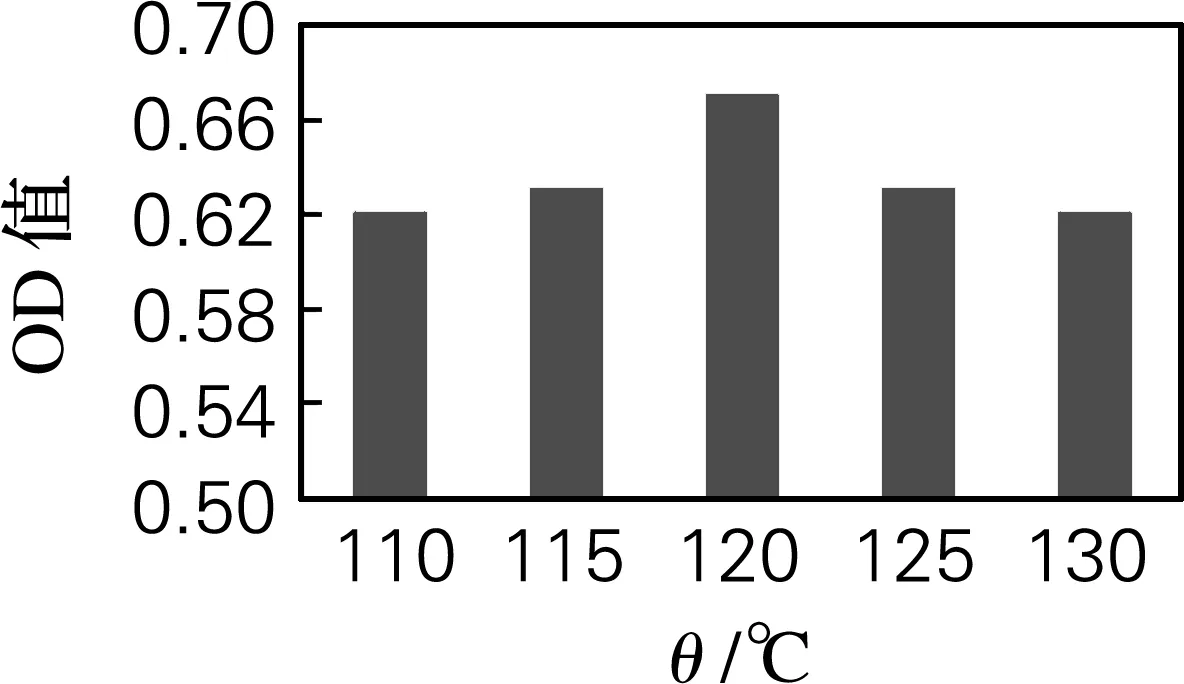
图5 ASC在不同水解温度的最佳水解时间下的羟脯氨酸的吸光值变化
Fig.5 Hydroxyproline contents of ASC hydrolyzed at different temperature and time
3 结 论
刺参体壁酶促溶性胶原蛋白和酸溶性胶原蛋白的最佳水解条件均为温度120 ℃,时间6 h。
通过对刺参体壁胶原蛋白水解条件进行优化,有利于准确测定刺参体壁中胶原蛋白的质量分数,缩短水解时间,简化实验操作。
刺参体壁酶促溶性胶原蛋白中羟脯氨酸的质量分数为8.29%,酸溶性胶原蛋白中羟脯氨酸的质量分数为8.16%。
[1] LEE J Y, LEE H D, LEE C H. Characterization of hydrolysates produced by mild-acid treatment and enzymatic hydrolysis of defatted soybean flour[J]. Food Research International, 2001, 34(2/3):217-222.
[2] HWANG J H, MIAUTA S, YOKOYAMA Y, et al. Purification and characterization of molecular species of collagen in the skin of skate (Rajakenojei)[J]. Food Chemistry, 2007, 100(3):921-925.
[3] 赵海英,梁程超,廖锦来,等. 鳕鱼皮胶原蛋白的制备及其成分分析[J]. 中国海洋药物杂志, 2005, 24(5):30-32.
[4] 李翠翠,董秀萍,高杨,等. 海参体壁酶促溶性胶原的提取工艺[J]. 大连工业大学学报, 2008, 27(1):1-3.
(LI Cui-cui, DONG Xiu-ping, GAO Yang, et al. Extraction technology of pepsin soluble collagen from body wall of sea cucumberStichopusjaponicus[J]. Journal of Dalian Polytechnic University, 2008, 27(1):1-3.)
[5] 高杨,董秀萍,肖桂华,等. 海参体壁酸溶性胶原提取及氨基酸组成分析[J]. 食品与发酵工业, 2008, 34 (11):171-174.
[6] TROTTER J A, LYONS-LEVY G, THURMOND F A, et al. Covalent composition of collagen fibrils from the dermis of the sea cucumber,Cucumariafrondosa, a tissue with mutable mechanical properties[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1995, 112(3/4):463-478.

