幽门螺杆菌重组1188蛋白的表达*
韩 飞,杨致邦
(1.重庆三峡中心医院微生物免疫科,万州404000;2.重庆医科大学基础医学院病原生物学教研室 400016)
幽门螺杆菌重组1188蛋白的表达*
韩 飞1,杨致邦2
(1.重庆三峡中心医院微生物免疫科,万州404000;2.重庆医科大学基础医学院病原生物学教研室 400016)
目的表达幽门螺杆菌(H.pylori)重组1188蛋白,为研究幽门螺杆菌的黏附机制奠定基础。方法用聚合酶链反应(PCR)技术从H.pylori标准株NCTC 11637的基因组DNA中扩增hp1188基因片段,插入原核表达载体pQE-30,构建重组载体pQE30-hp1188,经DNA测序分析确认后,转化大肠杆菌DH5α,异丙基硫代半乳糖苷(IPTG)诱导表达。Ni2+-N TA树脂纯化表达蛋白,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析表达形式和表达量。结果重组表达质粒pQE30-hp1188构建成功,所得序列完整,插入的基因片段全长810 bp,与基因文库中的hp1188基因同源性达98%。SDS-PAGE显示表达产物相对分子质量约为30.6 kD,与预期一致,蛋白表达量占全菌总蛋白的47%,上清液和沉淀中均有表达,重组蛋白纯化后纯度达90%以上。结论成功克隆hp1188基因,并在大肠杆菌DH5α中获得高效表达。
螺杆菌,幽门;hp1188基因;克隆;表达
幽门螺杆菌(helicobacter pylori,H.pylori)感染与慢性胃炎、消化性溃疡、胃腺癌和黏膜相关性淋巴样组织淋巴瘤密切相关,被世界卫生组织列为胃癌等肿瘤发生的相关致病菌[1-2]。目前,关于H.pylori的致病机制尚不明了,但H.pylori必须首先定植于人胃黏膜才能进一步发挥其致病作用,而黏附是H.pylori定植在胃黏膜表面的前提。决定H.pylori黏附的因素包括动力、尿素酶和黏附素。黏附素是H.pylori黏附的物质基础。目前国内外文献报道的H.pylori黏附素较多[3-6],其中已经证实的有HpA、A lpA、A lpB、BabA和Hop Z,尚有SabA、OipA等仍待确认[7]。2005年Rubinsztein-Dunlop等[8]利用一种新方法即镍珠模型筛选出一种新的蛋白1188,该蛋白存在于H.pylori细菌表面,表达量很高,并与黏附有关。Rubinsztein-Dunlop等[8]研究发现编码该蛋白的hp1188基因为H.pylori所特有,且相当保守,与已知的黏附素序列无同源性。本实验根据基因文库中提供的hp1188序列,以标准菌株H.pylori NCTC 11637基因组为模板,利用基因工程技术克隆和表达重组hp1188蛋白,为进一步研究H.pylori感染的黏附机制、防治H.pylori感染奠定基础。
1 材料与方法
1.1 菌株与质粒 H.pylori标准菌株NCTC 11637由重庆医科大学基础医学院病原生物学教研室保存,大肠杆菌DH5α菌株和pQE-30质粒均为重庆三峡中心医院微生物免疫科保存。
1.2 试剂 细菌基因组DNA提取试剂盒购自北京百泰克生物公司,质粒提取试剂盒购自OM EGA公司,胶回收试剂盒为上海华舜公司产品,聚合酶链反应(PCR)试剂盒、蛋白质Marker为Fermentas公司产品,DL-2000 DNA Marker、T4连接酶试剂盒、限制性内切酶(Bam H I、Xhol I)购自Takara公司,Ni2+-NTA层析柱为Invitrogen产品,琼脂糖、IPTG、SDS、DTT、EDTA、丙烯酰胺、N,N′-亚甲基双丙烯酰胺、考马斯亮蓝R250均为Sigma公司产品。
1.3 H.pylori菌株的获取 将H.pylori标准菌株NCTC 11637接种于7%羊血琼脂平板上,用产气袋法形成微需氧环境,37℃培养3~4 d后,挑取可疑菌落按常规方法鉴定,确认后传代培养。
1.4 H.pylori基因组DNA的提取 从固体培养基上刮取生长良好的菌落,按细菌基因组DNA提取试剂盒操作说明书提取H.pylori基因组DNA。
1.5 引物设计及合成 根据GeneBank公布的hp1188基因序列(Gene ID:899950),利用Premier Premier5.0软件设计引物,引物序列为P1:5′-CGC-CTCGAG-A TGAAGAGAGTTAGAGAA-3′(引入XhoⅠ酶切位点),P2:5′-CCC-GGA TCC-TCA GCA AA T A TT TTT T-3′(引入Bam HⅠ酶切位点)。引物由Invitrogen公司合成。
1.6 hp1188基因的PCR扩增 以提取的DNA为模板进行PCR扩增。扩增条件:95℃预变性5 min;94℃30 s,47℃30 s,72℃58 s,共35个循环;最后72℃延伸10 min。PCR扩增片段经终浓度10 g/L琼脂糖凝胶电泳纯化切胶回收。
1.7 重组质粒pQE30-hp1188的构建 参照文献[9]方法,将质粒pQE-30和纯化回收的hp1188基因片段分别用Bam HⅠ和XhoⅠ进行双酶切,回收酶切片段,在T4连接酶试剂盒作用下16℃连接6 h。将连接产物转化大肠杆菌DH5α,氨苄抗性筛选阳性重组子,抽提质粒,经PCR和双酶切鉴定,筛选出阳性克隆,并送上海英骏生物科技有限公司测序。
1.8 重组蛋白的诱导表达 将重组质粒转化菌的单菌落接种于LB(含氨苄西林100 mg/L)液体培养基中,于37℃培养过夜,以1∶20的比例接种上述过夜菌于新鲜的LB液体培养基中,37℃振荡培养至菌浓度为A600=0.4~0.6。加入异丙基硫代半乳糖苷(IPTG)至终浓度分别为0.1、0.3、0.5、0.8、1.0 mmol/L,37℃诱导表达,分别收集诱导表达1、3、4、5、24 h菌体进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,确定最佳诱导表达条件。在最佳条件诱导下,收集菌液1 m L进行全菌蛋白的SDS-PAGE,考马斯亮蓝染色,通过诱导前、后全菌蛋白染色条带的对照,检测相应分子质量的外源性蛋白表达条带。将诱导表达的菌液在4℃,5 000×g离心10 min收集菌体,按每克湿菌3 mL比例加入超声破碎缓冲液(每100 mL含2 mol/L Tris-HCL 1 m L、β-巯基乙醇0.03 g)重悬菌体,冰浴下超声破碎细菌,条件为功率280 W,破碎3 s,间隔3 s,总破碎时间为40 min。然后4℃,10 000×g离心20 min,分别收集裂解后所得到的沉淀与上清液,经12%SDS-PAGE分析重组蛋白的表达形式。
1.9 重组蛋白的纯化 收集2 L诱导表达的菌液,在冰浴下超声裂解后的上清液中加2 mL 50%Ni2+-NTA树脂溶液, 0℃冰浴1 h,其间不断振荡。将混合物转入下垫滤纸的注射器中,自然流干。用洗涤液(50 mmol/L NaH2PO4, 300 mmol/L NaCl,20 mmol/L咪唑)洗柱。分别收集洗涤液W 1~4。用洗脱液(50 mmol/L NaH2PO4,300 mmol/L NaCl, 250 mmol/L咪唑)洗柱,分别收集洗涤液E1~11。取适量样品进行SDS-PAGE分析,收集目的蛋白管,PEG 8000浓缩,最后将纯化样品分装,低温保存。采用Bradford法对纯化的重组蛋白进行定量。
2 结 果
2.1 hp1188基因的PCR扩增 PCR产物经10 g/L琼脂糖电泳分析可见约810 bp的单一条带,片段大小与预期一致,见图1。
2.2 重组质粒pQE30-hp1188的鉴定 重组质粒pQE30-hp1188转化大肠杆菌DH5α后,经PCR及双酶切鉴定,均可见约810 bp的目的条带,见图2。阳性克隆DNA测序结果显示,插入的基因片段全长810 bp,与GenBank公布的H.pylori菌株26695相应序列进行核苷酸序列比对分析,基因序列的同源性为98%。
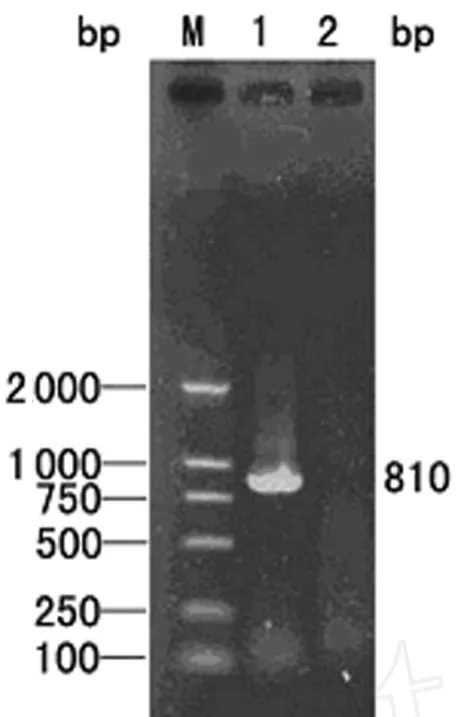
图1 hp1188基因片段的PCR扩增结果

图2 重组质粒pQE30-hp1188的PCR及酶切鉴定

图3 重组蛋白最佳IPTG诱导浓度的测定
2.3 重组蛋白的最佳表达条件 收集诱导前、后的细菌全菌蛋白进行SDS-PAGE分析,诱导后的细菌较诱导前在相对分子质量约30.6 kD处可见明显增加的外源蛋白表达条带。最佳诱导表达条件为37℃,IPTG浓度1.0 mmol/L,诱导时间4 h,可得到最大的表达量,见图3、4。
2.4 重组蛋白的表达形式 SDS-PAGE分析表明,超声破碎菌的上清液与沉淀中均可见目的蛋白表达条带,见图5。用图像软件分析表明可溶性蛋白占全菌蛋白的47%。
2.5 重组蛋白纯化产物的鉴定 SDS-PAGE分析表明,纯化产物主要存在于第2~7管洗脱液中,纯度可达90%,见图6。用Bradfo rd法测定纯化重组蛋白的含量为1.0 mg/m L。
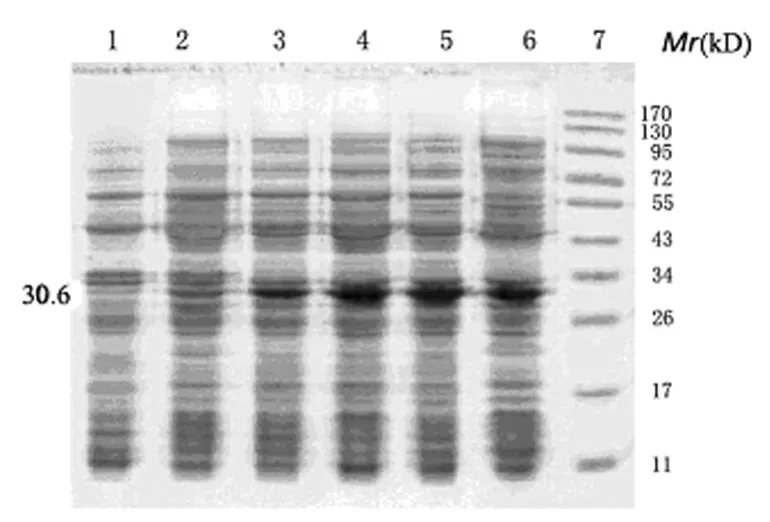
图4 重组蛋白最佳诱导时间的测定

图5 重组蛋白表达形式的鉴定

图6 纯化重组蛋白的SDS-PAGE分析
3 讨 论
H.pylori在胃内集中定植于胃窦部,生长于胃黏膜上皮表面与黏液层之间,是组织细胞外的寄生菌。H.pylori的高感染率及其对人类健康的危害越来越引起广泛关注,目前H.pylori治疗主要应用抗生素和质子泵抑制剂,但H.pylori感染存在治疗后易复发和再感染、易产生耐药性、患者对药物依从性差,以及药物不良反应和价格昂贵等问题。因此,学者们认识到有必要研制H.pylori疫苗[10-11],疫苗的成功研制及应用在H.pylori感染的防治策略中意义重大。
合理选择抗原是疫苗成败的关键。对H.pylori的研究表明,H.pylori在胃内定植的关键环节是黏附,宿主细胞的特异性黏附由黏附素受体系统介导,依赖于黏附分子上某些特定的氨基酸位点与受体的结合。随着对黏附素[12-14]本质的认识不断加深和黏附素在H.pylori定植过程中的决定性作用,黏附素作为保护性抗原可能成为一个新的疫苗研究尝试,可以从黏附素出发寻找保护性抗原,从而在感染的初期就能通过阻断黏附将H.pylori清除出人体。黏附素能够成为H.pylori疫苗候选抗原是由于其具备以下几个优点:位于细菌表面从而为免疫反应提供靶位;具有较高的保守性,而保守性抗原通常是疫苗成分的要求之一;蛋白质成分能够通过基因工程大规模生产和纯化。
Rubinsztein-Dunlop等[8]从H.pylori的全基因组中挑选出5个可能编码膜蛋白的开放阅读框(ORF),分别在E.coli BL21中表达出带组氨酸标签的这5种蛋白,研究发现经hp1188基因编码的蛋白hp1188具有黏膜结合特性,其包被的镍珠能够与人AGS细胞结合,且hp1188蛋白在H.pylori菌体表面表达量很高。hp1188基因全长810 bp,其核苷酸或氨基酸序列高度保守,为H.pylori所特有,编码蛋白的相对分子质量为30.6 kD。因此,研究hp1188的功能以及作为抗H.pylori感染的保护性抗原都具有重要意义。本研究选择H.pylori的hp1188基因,将全长hp1188基因克隆入原核表达质粒pQE30,成功构建了pQE30-hp1188重组载体,并在DH5α中获得高效表达,为下一步表达产物的特性分析,进一步研究H.pylori黏附的分子机制和免疫保护作用、制备防治H.pylori定植的疫苗奠定了实验基础。
[1]Penta R,De FM,Iaquinto G,et al.Helicobacter pyloriand gastric epithelial cells:from gastritis to cancer[J].J Exp Clin Cancer Res,2005,24(3):337-345.
[2]Fireman Z,Trost L,Kopelman Y.Helicobacter pylori:seroprevalence and colo rectal cancer[J].Isr Med A ssoc J, 2000,2(1):6-9.
[3]吴利先,杨致邦,林姗姗,等.幽门螺杆菌临床株黏附素HpaA基因的克隆表达及在诊断中的价值[J].中国人兽共患病杂志,2004,20(4):275-278.
[4]Odenbreit S,Faller G,Haas R.Role of the alpAB proteins and lipopolysaccharide in adhesion of Helicobacter pylori to human gastric tissue[J].Int J Med Microbiol,2002, 292(3-4):247-256.
[5]Azevedo M,Eriksson S,Mendes N,et al.Infection by Helicobacter pylori expressing the Bab A adhesin is influenced by the secretor phenotype[J].J Pathol,2008,215 (3):308-316.
[6]Yamaoka Y,Kita M,Kodama T,et al.Helicobacter pylori infection in mice:role of outer membrane proteins in colonization and inflammation[J].Gastroenterology,2002, 123(6):1992-2004.
[7]Hennig EE,Mernaugh R,Edl J,et al.Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA[J].Infect Immun,2004,72(6):3429-3435.
[8]Rubinsztein-Dunlop S,Guy B,Lissolo L,et al.Identification of two new Helicobacter pylori surface proteins involved in attachment to epithelial cell lines[J].JMed Microbiol,2005,54(Pt 5):427-434.
[9]Ausubel FM.精编分子生物学实验指南[M].颜子颖,王海林,译.3版.北京:科学出版社,1998:22.
[10]李晶,张建中.幽门螺杆菌黏附素及受体研究与疫苗发展[J].中国人兽共患病学报,2006,22(6):580-582.
[11]吕琳,王丕龙.重组幽门螺杆菌疫苗的研究现状[J].重庆医学,2009,38(8):984-987.
[12]Aebischer T,Schmitt A,Walduck A K,et al.Helicobacter Pylori vaccine development:facing the challenge[J].Int J Med Microbiol,2005,295(5):343-353.
[13]Odenbreit S.Adherence propertiesof Helicobacter pylori: impact on pathogenesis and adaptation to the host[J].Int J Med Microbiol,2005,295(5):317-324.
[14]Sugiyama T,Asaka M.Helicobacter pylori infection and gastric cancer[J].Med Electron Microsc,2004,37(3): 149-157.
Expression of recombinant Helicobacter pylori1188 protein*
Han Fei1,Yang Zhibang2
(1.Department of Microbiology and Immunology,Chongqing Three Gorges Central Hospital,Chongqing 404000,China;2.Department of Pathobiology of Basic Medicine,Chongqing Medical University,Chongqing 400016,China)
ObjectiveTo express the recombinant Helicobacter pylori 1188 protein in order to lay a foundation for the study on its adhesion.MethodsThe hp1188 gene was amplified from chromosomal DNA of strain NCTC 11637 by PCR.The PCR product was inserted into the expression vector pQE-30.And the recombinant vector pQE30-hp1188 was identified by DNA sequencing and transformed to E.coli DH5αfor expression under IPTG induction.The recombinant protein was purified by Ni2+-NTA agarose and identified by SDS-PAGE.ResultsThe recombinant expression vectors pQE30-hp1188 was successfully constructed.It was found that the total length of gene cloned was 810 bp with 98%sequence homology with hp1188 genes in GenBank.The molecular weight of its expression products was found to be about 30.6 kD as determined by SDS-PAGE,the percentage of expression was about 47%of total cell proteins,and the supernatant and pellet had both expressed.Its purity was over 90%after purified with Ni2+-NTA agarose.Conclusionhp1188 gene is successfully cloned and highly expressed in E.coli DH5α.
helicobacter pylori;hp1188 gene;clone;exp ression
2010-03-18
2010-05-09)
10.3969/j.issn.1671-8348.2011.03.004
A
1671-8348(2011)03-0218-03
重庆市教委项目(渝教科2003-7-3);重庆市科委攻关项目(CSTC,2005EA 5020)。

