配合物[Co(phendione)(SO4)(H2O)]·5H2O非等温热分解动力学
赵蔡斌,郭小华,孙妩娟,张 妮
(1.陕西理工学院 化学与环境科学学院,陕西 汉中 723000;2.陕西汉江药业股份有限公司,陕西 汉中 723001)
继续教育
配合物[Co(phendione)(SO4)(H2O)]·5H2O非等温热分解动力学
赵蔡斌1,郭小华1,孙妩娟1,张 妮2
(1.陕西理工学院 化学与环境科学学院,陕西 汉中 723000;2.陕西汉江药业股份有限公司,陕西 汉中 723001)
以热重-差热法(TG-DTG)为手段,研究配合物[Co(phendione)(SO4)(H2O)]·5H2O非等温热分解过程动力学。结果表明,标题配合物第一阶段热分解为相界控制反应(三维)机理,表观活化能为59.85 kJ·mol-1,指前因子ln A为16.36,反应速率方程为dα/d t=Ae-E(1-α)2/3。第四阶段热分解过程为成核和生长机理,表观活化能为203.11 kJ·mol-1,指前因子ln A为27.46,反应速率方程为dα/d t=0.25Ae-E(1-α)/[-ln(1-α)]-3。
[Co(phendione)(SO4)(H2O)]·5H2O;非等温热分解;指前因子;表观活化能
Abstract:The kinetics of the title complex[Co(phendione)(SO4)(H2O)]·5H2O was studied under the nonisothermal condition by TG and DTG techniques.The results showed that the thermal decomposition reaction mechanism of the complex in the first stage was phase boundary reaction (three dimensional),apparent activation energy and pre-exponential factor are 59.85kJ·mol-1and 16.36,respectively.The kinetic equations may be expressed as dα/d t=Ae-E(1-α)2/3.The thermal decomposition reactionmechanism of the complex in the forth stage is nucleation and growth,apparent activation energy and pre-exponential factor are 203.11kJ·mol-1and 27.46,respectively.The kinetic equationsmay be expressed as dα/d t=0.25Ae-E(1-α)/[-ln(1-α)]-3.
Key words:[Co(phendione)(SO4)(H2O)]·5H2O;non-isothermal decomposition;pre-exponential factor;apparent activation energy
过渡金属铁、钴、镍、铜、锌都是人体所必须的微量元素,他们在有机体代谢中有着重要的生物活性[1]。由于这类原子有未充满的3d轨道,可作为电子受体与含N,S,O等原子的分子形成结构新颖、性质独特的配合物,因此,引了诸多研究者的兴趣。1,10-邻菲罗啉-5,6-二酮及其衍生物作为稠杂环共轭配体,具有良好的配位特性,又是重要的有机合成反应中间体。由该化合物的衍生物与金属离子形成的配合物可以用于抗肿瘤药物、DNA探针、非线性光学材料、超等许多领域,已引起了有关研究人员的高度重视[2]。热重分析(TG)是在程序控制温度下测量物质质量随温度变化情况的技术,它可以直接准确地测定样品在受热过程中重量的变化,因而已成为研究各种无机、有机和高分子材料的热稳定性和热降解过程的重要实验手段[3]。热分解动力学研究可以为深入了解配合物的属性提供有价值的信息,特别是结合到材料化学和生命化学,它可以就配合物在信息材料、光电技术、激光能源、生物技术等分子光电功能材料等潜在的工业应用提供十分重要的理论依据[4,5]。本文合成了标题配合物,并以热重-差热法(TG-DTG)为手段,采用积分法和微分法相结合,研究该配合物的非等温热分解动力学,探讨了其热分解反应机理,并运用动力学补偿效应得到了配合物热分解动力学参数E与ln A的数学表达式。
1 实验部分
1.1 试样及仪器
固体配合物[Co(phendione)(SO4)(H2O)]·5H2O为红褐色晶体,按文献[6]方法合成;1,10-邻菲罗啉-5,6-二酮为黄色针状晶体,按文献方法[7]合成。热重分析采用德国耐驰公司STA449C综合热分析仪完成。
1.2 TG-DTG测试条件
用 α-Al2O3做参比,升温速率:20℃·min-1;升温范围:室温~1000℃;TG量程:10mg;DTA量程:20mg·min-1;DTG量程:50μV;气氛:动态N2(流速40mL·min-1);试样质量:9.16mg。
1.3 非等温热分解动力学数据处理
采用Coats-Redfen法(积分法)和Achar法(微分法)[8]对非等温动力学数据进行分析,两种方法的动力学表达式如下:
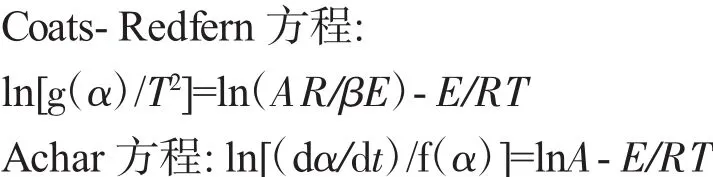
式中 α:温度T(K)时的反应分解率;β:线性升温速率,℃·s-1;R:摩尔气体常数,J·(mol·K)-1;E:表观活化能,J·mol-1;A(s):指前因子;dα/d t:分解反应速率。f(α)和g(α):微分和积分形式的动力学模型函数,函数详细描述参见文献[9]。通过对比动力学参数、相关系数,确立动力学模型函数,提出热分解反应可能的机理。
2 结果与讨论
2.1 配合物的热分析
标题配合物的TG-DTG曲线见图1。
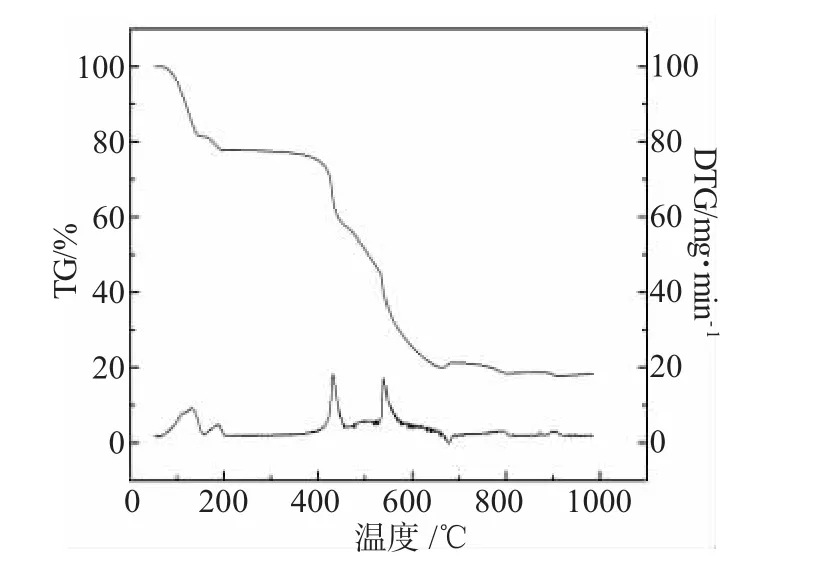
图1 标题配合物的TG-DTG曲线Fig.1 The TG-DTG plotof the title complex
由图1可以看出,标题配合物热分解过程有4次明显的失重过程,其中95.2~140.3℃失去5分子结晶水;在140.3~191.3℃失去1分子配位水;在415.4~456.90℃为 SO42-的分解;在 456.9~679.2℃为配体骨架的热分解;最终的热分解产物为CoO。
2.2 配合物的热分解动力学
根据TG-DTG曲线,选择配合物第一阶段(95.2~140.3℃)和第四阶段(456.9~679.2℃)热分解过程进行非等温热分解动力学研究。由TG-DTG曲线可得到配合物第一阶段和第四阶段热分解基本数据分解百分数 αi,(dα/d t),温度 Ti列于表 1 中。

表1 标题配合物第一和第四阶段热分解基本数据Tab.1 The base data of the thermal decomposition in firstand forth stages of the title complex
将28个动力学模型函数代入各自的微分和积分方程中,通过对1/T,对1/T作图,经最小二乘法线性拟合,得到了不同动力学模型函数的活化能E,指前因子ln A及相关系数r(数据列于表2)。
对比Coats-Redfern法和Achar法所得动力学参数,选出了两种方法中E和ln A值彼此接近且相关系数(r)好的动力学模型函数。
从表2可以看出,标题化合物的第一步分解过程,机理函数为24号时,用微分法和积分法所得的E和ln A值最为接近,且相关系数(r)也较好,该步对应的热分解反应的机理函数为g(α)=3[1-(1-α)1/3],f(α)=(1-α)2/3,即标题配合物第一步热分解过程为相界控制反应(三维)机理,其活化能为59.85 kJ·mol-1(Coats-Redfern 法和 Achar法的平均值),指前因子ln A为16.36(Coats-Redfern法和Achar法的平均值),热分解动力学方程为dα/d t=Ae-E(1-α)2/3。标题化合物的第四步分解过程,当机理函数为18号时,用微分法和积分法所得的E和lnA值最为接近,且相关系数(r)也较好,对应的热分解反应的机理函数为 g(α)=[-ln(1-α)]4,f(α)=0.25(1-α)[-ln(1-α)]-3,即配合物第四步热分解过程为成核和生长机理,其活化能为 203.11kJ·mol-1(Coats-Redfern法和Achar法的平均值),指前因子ln A为 27.46(Coats-Redfern法和Achar法的平均值),热分解动力学方程为dα/d t=0.25Ae-E(1-α)[-ln(1-α)]-3。
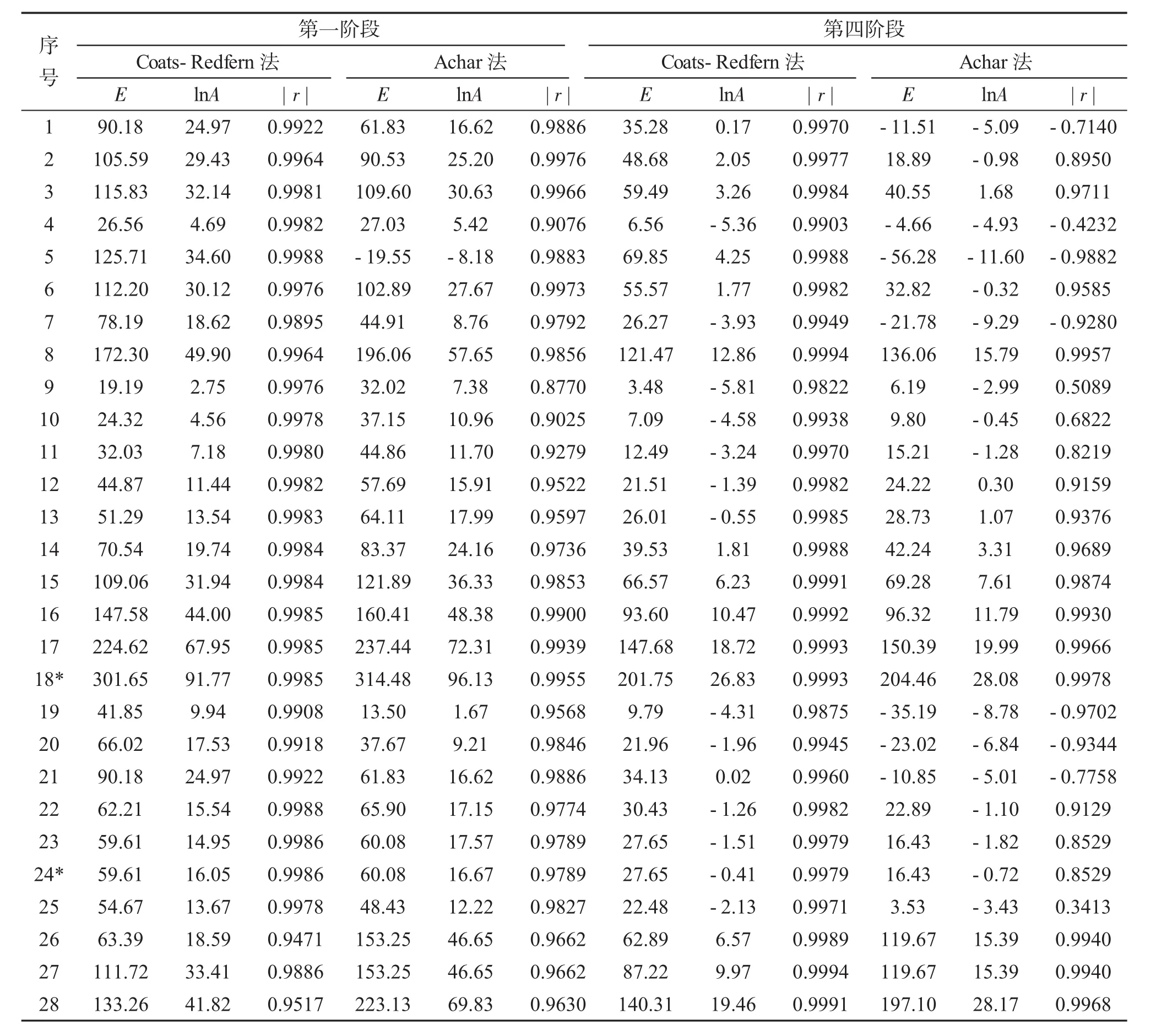
表2 配合物第一阶段和第四阶段热分解过程计算结果Tab.2 The calculated results of the thermal decomposition in firstand forth stages of the title complex
2.3 配合物热分解反应动力学补偿效应
根据动力学补偿效应表达式ln A=aEj+b(a、b为补偿参数)[10],利用28种反应机理函数求得的E、A(见表2),以ln A对E用最小二乘法进行线性拟合,求得第一步热分解的补偿参数a=0.3161,b=-2.7292,相关系数r=0.9990。因而,第一阶段热分解反应的动力学补偿表达式为ln A=0.3161E-2.7292。同理求得第四步热分解的补偿参数a=0.1568,b=-3.7643,相关系数 r=0.9967。第四阶段热分解反应的动力学补偿表达式为ln A=0.1568E-3.76433。计算结果表明,选用不同反应机理函数进行计算时,会导致求算的动力学参数的不同,各种不同的动力学参数E和A的值可用ln A和E的形式通过补偿参数联系起来[11,12]。
3 结论
根据上述分析,可以得到如下结论:
(1)配合物[Co(phendione)(SO4)(H2O)]·5H2O第一阶段热分解过程为相界控制反应(三维)机理,活化能为 59.85 kJ·mol-1,指前因子 ln A 为 16.36,热分解动力学方程为dα/d t=Ae-E(1-α)2/3。。第四阶段热分解过程为成核和生长机理,活化能为203.11kJ·mol-1,指前因子ln A为27.46,热分解动力学方程为dα/d t=0.25Ae-E(1-α)[-ln(1-α)]-3。
(2)配合物[Co(phendione)(SO4)(H2O)]·5H2O第一阶段热分解反应的动力学补偿表达式为ln A=0.3161E-2.7292;第四阶段热分解反应的动力学补偿表达式为ln A=0.1568E-3.76433。
[1]胡珍珠,许高波,方正东.过渡金属亮氨酸配合物的热分解动力学研究[J].武汉科技学院学报,2004,17(5):47-50.
[2]胡晓洁,朱晓芳,郑人华.1,10-邻菲罗啉-5,6-二酮的合成工艺研究[J].浙江化工,2007,38(3):4-5.
[3]刘玉坤,朱玉,杨光,等.热重分析技术在配合物[Co(py)4Cl2](py=pydine)的热分解动力学研究中的应用[J].云南大学学报(自然科学版).2005,27(5):507-510.
[4]F.Bentiss,M.Lagrenée,J.P.Wignacourt,et al.Complexes of cobalt(II),nickel(II)and copper(II)with a thia ligand;2,5-bis(2-pyridyl)-1,3,4-thiadiazole:structural identification[J].Polyhedron,22(4):403-408.
[5] Gloria A,Joaquín B,Francisco E,et al.Zinc complexation to N-substituted sulfonamide ligands:Preparation,properties and crystal structure of copper(II) doped{[Zn(sulfamethizolate)2(py)]·H2O}∞[J].Inorganica Chimica Acta,2003,343(30):56-60.
[6]葛红光,郭小华,孙妩娟,等.配合物[Co(phendione)(SO4)(H2O)]·5H2O的合成及表征[J]. 人工晶体学报.2008,37(1):167-169.
[7]张智斌,闫文鹏,樊美公.一种1,10-菲 啉-5,6-二酮及其单肟的高效合成方法[J].应用化学,2005,22(1):13-14.
[8]胡荣祖,史启祯.热分析动力学[M].北京:科学出版社,2001,65-66.
[9]赵红坤.草酸盐-过氧化氢-水三元体系的相平衡及过氧草酸钾热分解动力学研究[D].江苏扬州:扬州大学,2008.
[10]何翊,孙挺.升温速率对β-CD/1-MCP热分解反应动力学的影响[J].东北大学学报(自然科学版),2006,27(4):69-72.
[11]李大武,李继荣,李展超,等.升温速率对TiH2热分解反应动力学的影响[J].材料与冶金学报,2009,8(3):175-178.
[12]武宏香,李海滨,赵增立.煤与生物质热重分析及动力学研究[J].燃料化学学报,2009,37(5):538-545.
Non-isothermal kinetics of thermal decomposition of the com plex[Co(phendione)(SO4)(H2O)]·5H2O
ZHAO Cai-bin1,GUO Xiao-hua1,SUNWu-juan1,ZHANG Ni2
(1.School of Chemistry&Environment Science,ShanXi University of Technology,Hanzhong 723000,China;
2.Shanxi Hanjiang Pharmaceutical Group Co.,Ltd.,Hanzhong 723001,China)
O643.12
A
1002-1124(2011)02-0018-04
2010-12-20
赵蔡斌(1974-),男,讲师,从事物理化学教学与科研工作。

