采用湿法技术从废旧锂离子电池中回收有价金属*
赵东江,马松艳
(绥化学院 生物与食品工程系,黑龙江 绥化 152061)
(Departmentof Biologic and Food Engineering,Suihua University,Suihua 152061,China)
环境工程
采用湿法技术从废旧锂离子电池中回收有价金属*
赵东江,马松艳
(绥化学院 生物与食品工程系,黑龙江 绥化 152061)
采取湿法回收技术对废旧锂离子电池进行处理,研究了回收铝、钴、锂金属元素的工艺条件。在90℃时,用10%NaOH浸出铝,其浸出率达到96%。在温度90℃、4mol·L-1H2SO4、固-液比1∶8、反应时间100min的浸出条件下,钴、锂浸出率为92%。利用NaHCO3和Na2CO3为沉淀剂,从酸浸出液分别制备得到CoCO3和Li2CO3产品。
废旧锂离子电池;浸取;回收;有价金属
(Departmentof Biologic and Food Engineering,Suihua University,Suihua 152061,China)
Abstract:The spent lithium-ion batteries were treated by using hydrometallurgy technology and the process conditions of the recovery of aluminum,cobalt and lithium metallic elements were studied.The leaching ratio of aluminum element reached 96%in 10%NaOH solution at 90℃.As the leaching conditions are temperature 90℃,4mol·L-1H2SO4,solid-liquid ratio 1∶8 and reaction time 100min,the leaching ratio of cobalt and lithium is 92%.The CoCO3and Li2CO3products were obtained from the acid-leaching solution using NaHCO3and Na2CO3for precipitation agent,respectively.
Key words:spent lithium-ion batteries;leaching;recycling;valuablemetals
随着电池产销量的逐年增长,废旧电池的回收和处理引起人们的极大关注。比如,利用废旧锌锰电池可以回收锰、锌等金属,不但减少了废旧电池对环境的污染,而且可以实现锌、锰等金属资源再生利用[1,2]。锂离子电池广泛应用在电动汽车、航天以及小型移动电子设备等领域[3,4],其平均寿命在500~1000次循环,使用时间为3年左右,因此,废旧锂离子电池回收处理问题同样受到了普遍重视[5-7]。文献报道[8],一支重约40g的手机锂离子电池,钴、铜、铝、铁、锂等金属含量分别为15%、14%、4.7%、25%和0.1%,对其回收处理可以实现资源综合利用,变废为宝。目前,废旧锂离子电池回收处理技术主要分为火法处理和湿法处理两种,湿法冶金技术具有对环境污染小的优点,已被国内外研究者广泛采用[9]。本文利用湿法处理技术,采取碱浸-酸溶的方法对废旧锂离子电池正极材料进行处理,研究了回收钴、铝、锂金属元素的工艺条件,制备得到氢氧化铝、碳酸钴、碳酸锂等化合物。
1 实验部分
1.1 试剂与仪器
NaOH,H2SO4,Na2CO3,SnCl2,NaHCO3,ZnSO4,NH4SCN,六亚甲基四胺,乙二酸四乙酸钠,丙酮,Na3CO(NO2)6,以上试剂均为分析纯。
JHS-1/60A型电子恒速搅拌机(杭州仪器电机厂);SZ-93型自动双重纯水蒸馏器(上海亚荣仪器厂);SXKW型数显控温电热套(北京市永光明医疗仪器厂);SHE-D型循环水式真空泵(河南斯泰仪器有限公司);DK-98-1型电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 工艺流程
工艺流程见图1。
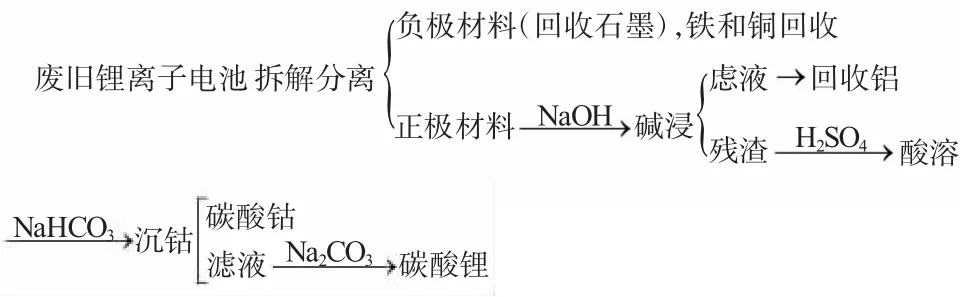
图1 工艺流程图Fig.1 Process flow diagram
2 结果与讨论
2.1 碱浸回收铝
在室温下,将废旧锂离子电池正极材料按10∶1的液固比浸泡到NaOH溶液中,反应时间为5h。此过程中LiPF6电解质可按下述反应分解除去,避免产生的HF对环境造成污染[10]。
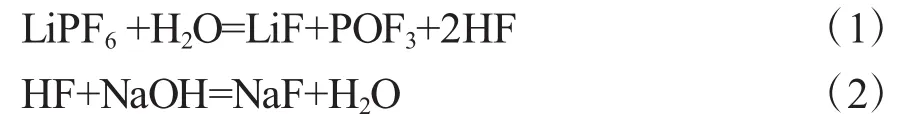
同时,正极集流体铝将以NaAlO2的形式溶解到碱液中,不溶的LiCoO2作为碱浸渣待处理,从而实现了铝与钴、锂的分离。用H2SO4调节碱浸液的pH值,使铝以Al(OH)3形式沉淀回收,回收率达96%。
实验发现,碱浸取液的浓度对Al的浸出率有较为明显的影响,随着碱浓度的增大,Al的浸出率增加,但当碱浓度达到10%以上时,Al的浸出率增加不明显,见图2。因此,本实验采用10%的NaOH作为正极材料的碱浸取液。
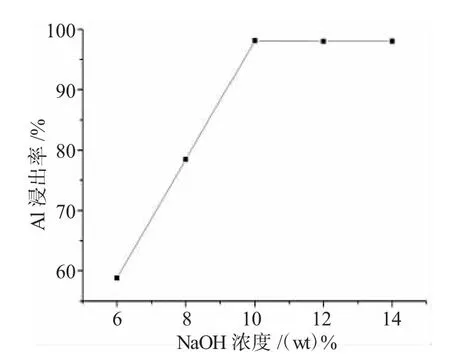
图2 铝的浸出率与NaOH浓度的关系Fig.2 The relationship of leaching efficiency of aluminum element and NaOH concentrations
2.2 酸溶回收钴、锂
用H2SO4溶液处理碱浸所剩滤渣,LiCoO2将溶解进入溶液,乙炔黑不溶留在滤渣中,从而达到两者分离的目的。硫酸的浓度、反应温度、浸取时间和固-液比等因素对浸取效果有明显影响。
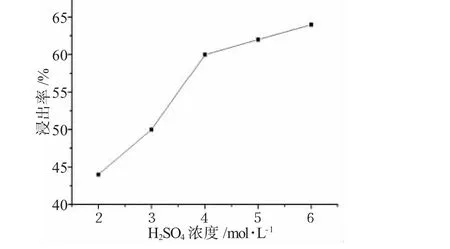
图3 浸出率与硫酸浓度的关系Fig.3 The relationship of leaching efficiency and H2SO4concentrations
2.2.1 H2SO4浓度 图3是碱浸渣的浸出率对H2SO4浓度的依赖关系。由图3可见,当浓度低于4mol·L-1时,浸出率随H2SO4浓度增加明显增大,而当浓度高于4mol·L-1时,浸出率增大程度变缓。由于在碱浸渣进行酸溶后,还需用NaHCO3来沉淀钴,如果残留的酸过多,会对下步工艺产生较大压力,因此,从工艺流程的效率和经济角度考虑,本实验选用4mol·L-1H2SO4作为酸浸取液。2.2.2 反应温度 在含有 H2O2的4mol·L-1H2SO4混合溶液(H2O2与H2SO4的摩尔比为1∶3)中,当反应时间为100min时,浸出率随反应温度的增加呈现出先增大后降低的变化规律,在90℃时达到最大值,见图4。
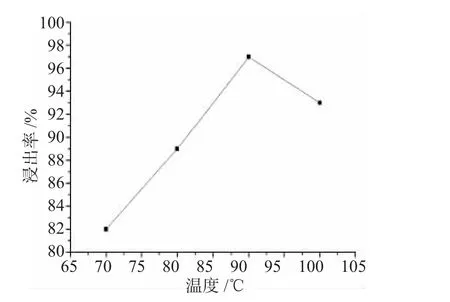
图4 浸出率与反应温度的关系Fig.4 The relationship of leaching efficiency and reaction temperature
LiCoO2在H2SO4与H2O2混合溶液中的分解反应可表示为:
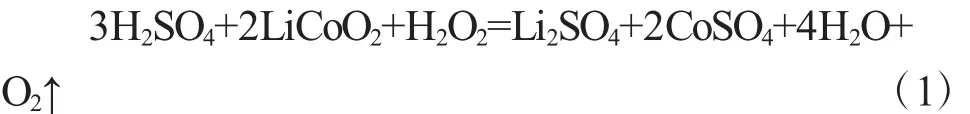
在式(1)中,H2O2起到还原剂的作用,能够将LiCoO2在酸性条件下分解产生的Co3+还原为Co2+。随反应温度升高,上述反应速率加快,在相同反应时间内浸取率相应增加,但是,当温度过高时,部分H2O2本身会因发生分解而失去还原作用,导致反应(1)的速率降低,从而使浸取率有所降低。因此,本实验选择90℃作为反应最适温度。
2.2.3 固-液比 在温度为90℃,反应时间为100min时,固-液比对Co2+浸出率有较大影响,随着固-液比增大,浸出率呈现出先增加后小幅度减小的变化规律,并在1∶8时达到最大,此后,随固-液比的增大,浸出率变化不大,见图5。
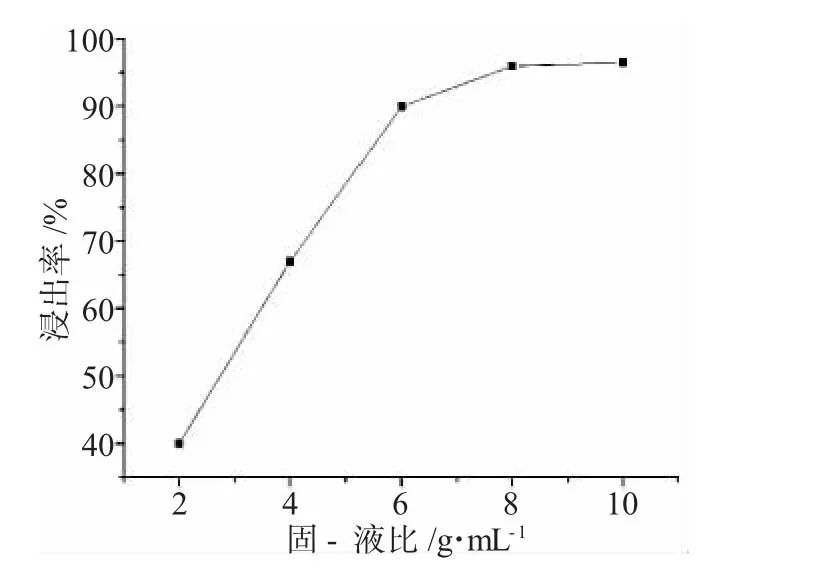
图5 浸出率与固-液比的关系Fig.5 Relationship of leaching efficiency and solid-liquid ratio
由图5可见,由于浸出反应在固-液界面处发生,当固-液比增大时,参加反应的H2SO4和H2O2的量增加,使反应(1)更容易进行,因此,浸出率相应增加。本实验选择1∶8的固-液比为最适比例。
2.2.4 浸出时间 在温度为90℃,固-液比为1∶8的条件下,浸出率随时间的延长逐渐增大,当浸取时间超过100min后,浸出率没有明显变化,见图6。
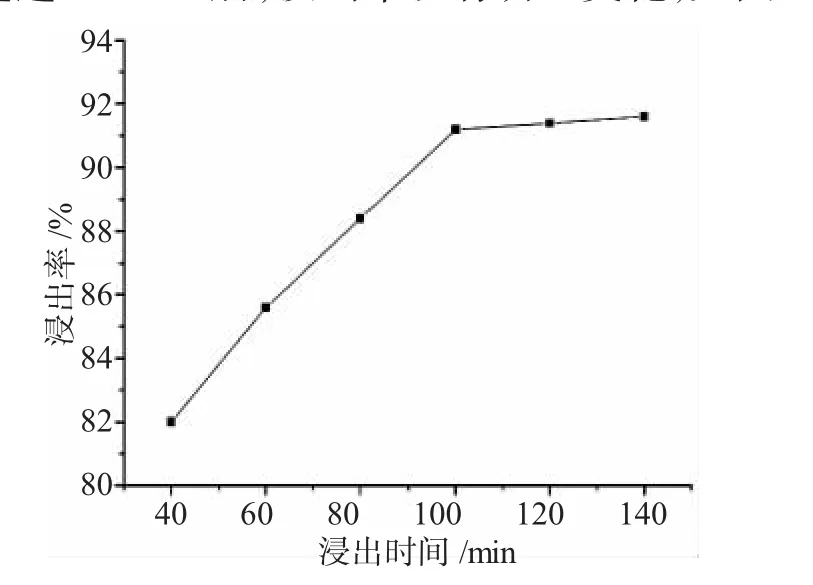
图6 浸出率与浸出时间的关系Fig.6 Relationship of leaching efficiency and reaction time
由图6可见,浸出40min时,浸出率已达80%以上,100min后,浸出率超过90%。在浸出最初阶段,H2SO4对碱浸渣浸出的反应较快,浸出率随时间增加较快,随浸出时间的延长,反应物固体表面积不断减小,导致固-液界面反应速率变慢,浸出率增加变缓。因此,在综合考虑浸出效益的情况下,选择100min为最适反应时间。
综上,在考虑经济效益和浸出效率的情况下,采用H2SO4溶液处理碱浸渣的最佳工艺条件是:反应温度 90℃、H2SO4浓度 4mol·L-1、固 - 液比 1∶8、反应时间100min。此时,钴、锂的浸出率可达92%。
2.3 CoCO3和Li2CO3的制备
2.3.1 CoCO3的制备 含有钴、锂的硫酸浸出液呈强酸性,在沉淀钴之前需用NaOH溶液调节酸度,以免消耗过多NaHCO3沉淀剂而造成浪费。在搅拌条件下,向调节酸度后的浸出液中加入NaHCO3至沉淀完全,沉淀经烘干处理,得到粉红色CoCO3粉末。将制备的CoCO3用4mol·L-1H2SO4溶解得到Co2+溶液,用浓度为0.02061mol·L-1EDTA标准液测定CoCO3产品中钴的含量(平行测定3份),见表1。
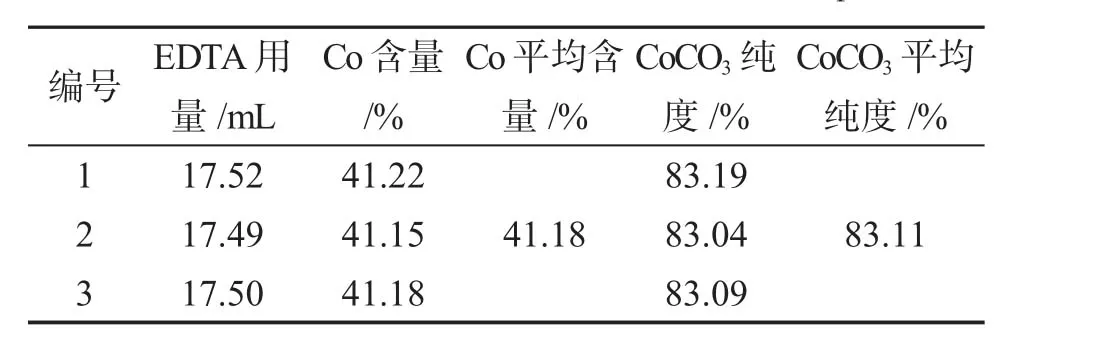
表1 CoCO3产品中Co含量的测定数据Tab.1 Determination data of Co content in CoCO3products
由表1可见,制备的CoCO3产品中钴含量的平均值比理论值49.5%低,说明产品的纯度有待进一步提高。
2.3.2 Li2CO3的制备 Li2CO3的溶解度随温度的升高而下降,因此,在较高温度下,Li+能够以Li2CO3形式沉淀析出。本实验选择反应温度为90℃,以饱和Na2CO3溶液为沉淀剂[11],在搅拌下向沉钴后的滤液中逐滴加入沉淀剂,Li+将以Li2CO3的形式不断沉淀析出,待沉淀完全后,抽滤、干燥,得到白色的Li2CO3固体粉末。
3 结论
采用碱浸-酸溶的湿法技术,回收废旧锂离子二次电池中的铝、锂和钴,得出回收处理较为适宜工艺条件。碱浸回收铝的最佳条件是:温度90℃、10%NaOH溶液,铝的回收率达到96%;酸溶回收钴、锂的最佳条件是:温度 90℃、4mol·L-1H2SO4、固-液比1∶8、反应时间100min,钴、锂的浸出率达到92%。经调解酸度后的酸浸出液,用NaHCO3和Na2CO3作为沉淀剂,分别制备得到CoCO3和Li2CO3产品。采用碱浸-酸溶的方法可以回收废旧锂离子电池中有价金属,其工艺流程简单,对环境无二次污染,具有一定的实用价值。
[1]蒋玉萍,张建强,李杏兰,等.废旧锌锰干电池回收利用的探讨[J].实验技术与管理,2002,19(6):68-70.
[2]白晓波,赵东江,马松艳.利用废旧锌锰电池制取锌盐和氧化锌的研究[J].应用化工,2007,36(8):839-841.
[3]J.Nan,D.Han,X.Zuo.Recovery ofmetal values from spent lithium-ion batteries with chemical deposition and solvent extraction[J].J.Power Sources,2005,152:278-284.
[4]D.Ra,K.Han.Used lithium ion rechargeable battery recycling using Etoile-Rebatt technology[J].J.Power Sources,2006,163:284-288.
[5]C.K.Lee,K.I.Rhee.Reductive leachingof cathodic activematerials from lithium ion battery wastes[J].Hydrometallurgy,2003,68(1):5-10.
[6]徐源来,孙晓玮,徐盛明,等.失效锂离子电池资源化利用[J].新材料产业,2008,(3):36-39.
[7]席国喜,焦玉字,路迈西.废旧锂离子电池资源化研究现状[J].再生资源与循环经济,2008,1(1):38-41.
[8]欧秀芹,孙新华,程耀丽.废锂离子电池的综合处理方法[J].中国资源综合利用,2002,(6):18-19.
[9]谢光炎,凌云,钟胜.废旧锂离子电池回收处理技术研究进展[J].环境科学与技术,2009,32(4):97-101.
[10]李啊林,梁勇,程 ,等.从废旧电池中回收钴镍的研究进展[J].中国有色冶金,2008,6(3):57-60.
[11]张晓峰,别凤喜,艾海马,等.利用废锂渣制备碳酸锂[J].化工环保,2001,(1):39-43.
Recovery of valuablemetals from spent lithium-ion batteries using hydrometallurgy technology*
ZHAO Dong-jiang,MA Song-yan
X705
A
1002-1124(2011)02-0052-04
2010-12-14
绥化学院科研基金资助项目(K061003)
赵东江(1965-),男,教授,硕士,主要从事化学电源研究。

