由废铝制备明矾及其组成测定
程相春
(黑龙江省化工研究院,黑龙江 哈尔滨 150078)
(Heilongjiang Provircial Chemical Enginering Institute,Harbin 150078,China)
科研与开发
由废铝制备明矾及其组成测定
程相春
(黑龙江省化工研究院,黑龙江 哈尔滨 150078)
以生活废铝易拉罐为原料,采用不同的方法制备明矾,通过XRD、TG、EDTA配位法、重量法等对产物进行了表征,获得了很好的结果。
易拉罐;明矾;组成测定;重量法;配位法
Preparation and determ ination of potassium alum inum sulfate from waste alum inum CHENG Xiang-chun
(Heilongjiang Provircial Chemical Enginering Institute,Harbin 150078,China)
Abstract:Potassium aluminum sulfate were prepared by different ways used pop can as material,the complexeswere characterized by XRD,TG and EDTA coordination and weightmethod,and the result is satisfying.
Key words:pop can;alum;determination of content;weightmethod;coordinationmethod
铝是使用量仅次于钢铁的第二大金属材料,由于其具有优异的性能而重要性愈来愈大。废铝大致可分为以下几类:生铝、合金熟铝、型材铝、铝线、生活杂铝等,日常生活中随处可见被抛弃的易拉罐、卷烟包装的铝箔纸、铝质牙膏皮等均属于生活杂铝。本文利用废弃的易拉罐,采用酸、碱两种方法制备出明矾,通过热重、重量法和配位滴定法对其中的各种成分进行测定,从而确定了该化合物的组成,该研究既有效地利用了废弃资源、变废为宝,又培养了学生的绿色环保意识,对于提高学生的综合素质具有十分重要的意义。
1 实验部分
1.1 仪器与试剂
X-射线粉末衍射仪(日本理学公司);热重分析仪(美国PE公司);WD900B型微波炉(广东顺德市格兰仕电器有限公司);101-2型干燥箱(上海市实验仪器总厂);AE200型分析天平(METTLER公司);各种试验用玻璃仪器、抽滤装置等。
所有化学试剂均为分析纯。
1.2 明矾的制备
明矾又称白矾、钾矾、钾明矾、酸矾,学名十二水合硫酸铝钾,是含有结晶水的硫酸钾和硫酸铝的复盐,水溶液有涩味。化学式KAl(SO4)2·12H2O,式量474.39,具有玻璃光泽的无色正八面体,三方晶系,密度 1.757g·cm-3,在 20℃、1 个标准大气压下,溶解度约为5.90g。
明矾用途非常广泛,通常在工业上用作印染媒染剂和净水剂,医药上用作收敛剂,食品工业中用作膨松剂及色谱分析试剂等。明矾有多种制备方法[1,2],本文利用废弃的易拉罐,采用酸、碱两种方法制备明矾。
1.2.1 KOH法 铝屑溶于浓氢氧化钾溶液,生成可溶性的四羟基合铝(Ⅲ)酸钾K[Al(OH)4],加入一定量稀H2SO4溶液,将其转化为Al(OH)3,再加过量的H2SO4,Al(OH)3溶解生成Al2(SO4)3,Al2(SO4)3能同碱金属硫酸盐如K2SO4在水溶液中结合成一类在水中溶解度较小的同晶的复盐,此复盐称为明矾[KAl(SO4)2·12H2O],当冷却溶液时,明矾则以大块晶体结晶出来。制备中的化学反应如下:
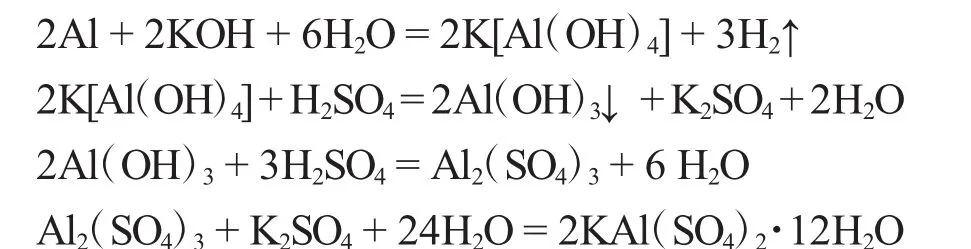
称取4.5g KOH于250mL烧杯中,加入60mL蒸馏水溶解,分批加入2.0g剪碎的易拉罐(反应激烈,防止溅出,应在通风橱内进行),至不再有气泡产生,反应完毕后加水至80mL,趁热用布氏漏斗抽滤。
将滤液转入250mL烧杯中,加热至近沸,在不断搅拌下,滴加6mol·L-1H2SO4溶液至生成的大量白色沉淀完全溶解,溶液澄清,趁热抽滤。
滤液转至蒸发皿中,小火加热浓缩溶液至45mL,放置充分冷却至室温,抽滤,乙醇淋洗,抽干得无色透明晶体,称重并计算产率。
1.2.2 H2SO4法 铝屑可以直接与硫酸反应,但反应速度不是很快,因此,在实际反应中加入FeCl3、HgCl2等盐溶液作为“催化剂”,来提高金属铝在稀H2SO4中的溶解能力,主要反应如下:
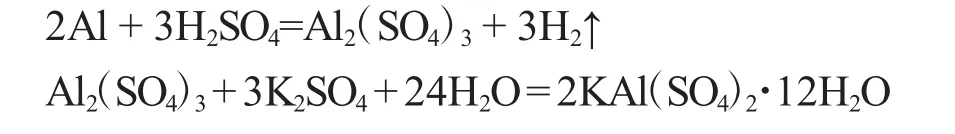
称取2.0g铝屑于250mL烧杯中,加入40mL 4.5mol·L-1H2SO4溶液,滴加 5D作为“催化剂”的0.1mol·L-1FeCl3或HgCl2等溶液,加热并不断搅拌,反应过程中应适当补充水分,直至反应完全。
趁热减压过滤,滤液转移至烧杯中,残渣经烘干后称重,计算出已反应的铝屑质量,并根据反应方程式计算出Al2(SO4)3的理论产量,据此称取所需固体K2SO4,配成饱和溶液混合到Al2(SO4)3溶液中,搅拌均匀,蒸发浓缩至45mL,自然冷至室温,抽滤,乙醇淋洗,抽干得无色透明晶体,称重并计算产率。
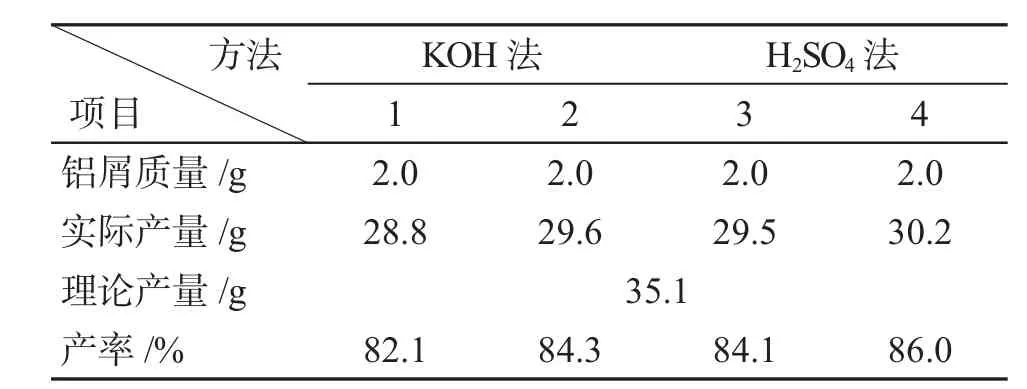
表1 明矾制备Tab.1 Preparation of alums
2 结果与讨论
2.1 明矾XRD谱图

图1 制备的明矾样品与分析纯样品XRD对比图Fig.1 Collation map for alums samples and analytical reagent samples
由图1中可以看出,制备的明矾样品结晶较好。
2.2 结晶水含量测定
明矾结晶水含量测定采用热重(TG)和差减法两种方法对比测定[3-5]。2.2.1 TG法 测试工作在美国PE公司TGA7热分析仪上完成,反应气氛为N2,流速为50mL·min-1,升温速率为 25~300℃为 10℃·min-1;300~900℃为5℃·min-1,温度范围 25~900℃,样品经重结晶,研磨成粉末后使用。明矾的热分解曲线见图2。

图2 明矾TG曲线Fig.2 TG curve of alums
由图2可以看出,明矾的分解分两步进行,根据TG曲线出现的平台及失重百分率,可推断出第一步分解在30~270℃温度范围内,失重率为45.50%(理论失重值45.53%),相当于失去12个水分子,第二步分解在 680~810℃温度范围内,失重百分率为25.50%(理论失重值为25.31%),相当于失去1.5个SO3分子,生成最后产物为K2SO4和Al2O3,至此,KAl(SO4)2·12H2O总失重 70.0%(理论值为 70.88%),各分解阶段反应失重率的实验值与计算值相当吻合。根据以上推断,在此条件下KAl(SO4)2·12H2O的热分解过程如下:
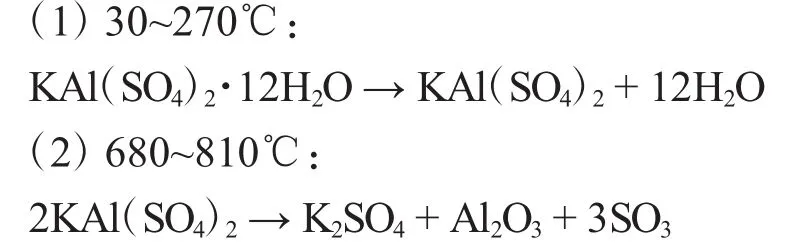
2.2.2 差减法 将洗净的称量瓶放入烘箱内,在280℃下干燥2h,然后置于干燥器中冷至室温,称量。重复上述操作至恒重(即两次称量相差不超过0.5mg)。
精确称取明矾试样0.7~0.8g于已恒重的称量瓶中,置于烘箱中,在280℃下干燥2h,再在干燥器中冷至室温,称量,重复干燥、冷却、称量等操作,直到恒重。根据称量结果,计算结晶水含量(每克试样中所含结晶水的摩尔数n1)。
结晶水的测定结果见表2。
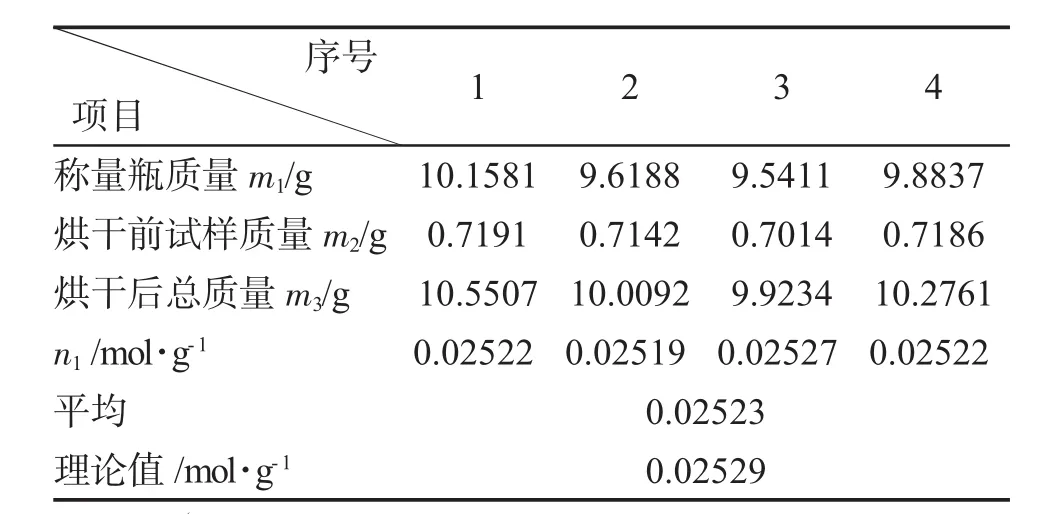
表2 结晶水含量测定Tab.2 Determination of crystalwater
2.3 SO24-含量测定
2.3.1沉淀的制备称取4.0gBaCl2·2H2O于250mL烧杯中,加入200mL水和溶液2mL,加热溶解。
准确称取明矾试样0.7~0.8g于250mL烧杯中,加50mL水和2mol·L-1HCl溶液2mL,加热至近沸溶解,不断搅拌下滴加热的钡盐溶液,待BaSO4沉淀完全后,盖上表面皿,放在水浴或沙浴上,保温40min陈化。
2.3.2 玻璃坩埚的恒重 用水洗净两个坩埚,用真空泵抽2min以除掉玻璃砂板微孔中的水分,便于干燥。放进微波炉于500W的输出功率(中高火)下进行干燥,第一次干燥10min,第二次4min。每次干燥后放入干燥器中冷却15~20min,然后在分析天平上快速称量。两次干燥后称量所得质量之差若不超过0.4mg,表明已恒重,否则,还要再次干燥4min,冷却、称量,直至恒重。
2.3.3 沉淀的过滤和洗涤 BaSO4沉淀冷却后,用已恒重的玻璃坩埚进行减压过滤。上层清液滤完后,将沉淀转移到坩埚中,用沉帚擦“活”粘附在杯壁和搅棒上的沉淀,再用水冲洗烧杯和玻璃棒直至沉淀转移完全。用稀H2SO(40.5mol·L-1H2SO40.5mL加100mL水配成)洗涤沉淀3~4次,每次约10mL,再用水洗一次,最后用水淋洗沉淀及坩埚内壁4次以上,这时沉淀基本已洗涤干净(用HNO3酸化的AgNO3检查)。继续抽干2min以上至不再产生水雾,将坩埚放入微波炉进行干燥(第一次10min,第二次4min),冷却、称量、直至恒重。计算明矾试样中S的含量(mol·g-1)。S测定结果见表3。
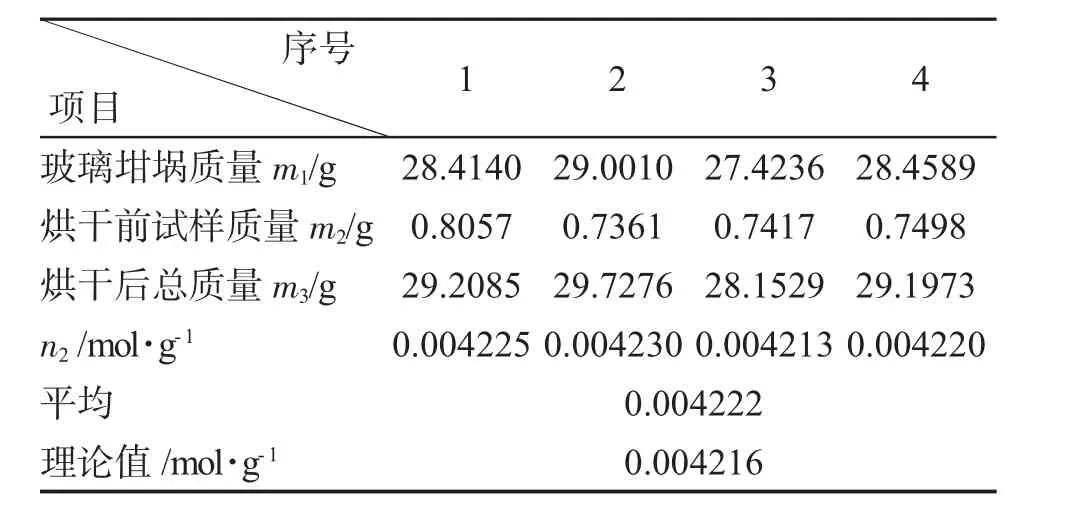
表3 SO24-含量测定Tab.3 Determination of SO2-4
2.4 铝含量测定
铝含量的测定方法较多[8-10],主要有重量法、容量法、分光光度法、ICP-AES法和原子吸收法等(改进的酸碱滴定法测定铝合金化铣液中的铝含量——分光光度法测定硅铝矿渣中铝的含量)。测定高浓度铝含量主要有容量法的配位滴定和酸碱滴定两种方法。
由于Al3+具有易水解、与EDTA反应速度缓慢且在酸性介质中对常用的指示剂二甲酚橙有封闭作用等特点,在用配位滴定法对其进行测定时常采用返滴定法,对于试样成分复杂多样,为了防止其他金属离子的干扰,传统的方法是用置换滴定法。Al3+与EDTA配位反应比较缓慢,需加入过量的EDTA,并加热煮沸才能反应完全;Al3+对二甲酚橙指示剂有封闭作用,酸度不够时容易水解,在pH值为3~4时Al3+与过量的EDTA在煮沸时配位完全,再调节pH值为5~6,以二甲酚橙指示剂,用锌盐标准溶液返滴定剩余EDTA,加入过量的NH4F加热煮沸,置换出与Al3+配位的EDTA,再用锌盐标准溶液滴定释放出来的EDTA,至溶液由黄色变为紫红色为终点。本文采用返滴定法和置换法两种方式进行对比测定明矾中的Al3+含量。


2.4.1 0.01mol·L-1Zn2+标准溶液的配制 准确称取0.21~0.22g基准ZnO于 100mL烧杯中,加 6mol·L-1HCl溶液5mL,立即盖上表面皿,待ZnO完全溶解,以少量水冲洗表面皿和烧杯内壁,定量转移Zn2+溶液于250mL容量瓶中,用水稀释至刻度,摇匀,计算锌标准溶液的浓度。
2.4.2 0.01mol·L-1EDTA溶液的配制与标定 称取1.0g EDTA于100mL烧杯中,加水80mL,温热并搅拌使其完全溶解,冷却后转入试剂瓶中,稀释至250mL。
用移液管吸取25.00mLZn2+标准溶液于锥形瓶中,加2D二甲酚橙指示剂,滴加20%六亚甲基四胺至溶液呈现稳定的紫红色,再加5mL六亚甲基四胺。用EDTA滴定,当溶液由紫红色恰好转变为黄色时即为终点。平行滴定3次,计算EDTA的准确浓度。
2.4.3 铝含量的测定 准确称取明矾试样0.31~0.32g铝盐,加6mol·L-1盐酸5mL,将上述溶液定量转移至100mL容量瓶中,稀释至刻度,摇匀。
移取25.00mL铝盐溶液于250mL锥形瓶中,定量加入0.01mol·L-1EDTA标准溶液30mL,加2D二甲酚橙,此时溶液呈黄色,滴加6mol·L-1氨水调至溶液恰好出现红色,再滴加3mol·L-1HCl溶液,使溶液呈现黄色。加热煮沸3min,放冷后加入六亚甲基四胺20mL,此时溶液应呈黄色(pH值为5~6),如不呈黄色,用3mol·L-1HCl来调节,使其变黄,用0.01mol·L-1锌标准溶液滴定至溶液由黄色变为紫红色。
于上述溶液中加入200g·L-1NH4F溶液10mL,加热至微沸,流水冷却,再补加2D二甲酚橙指示剂,此时溶液应呈现黄色(pH值为5~6)。若溶液呈现红色,应滴加3mol·L-1HCl溶液使其变为黄色。再用0.01mol·L-1锌标准溶液滴定至溶液由黄色变为紫红色,即为终点。根据消耗的锌盐溶液的体积,计算Al的含量n3(mol·g-1)。
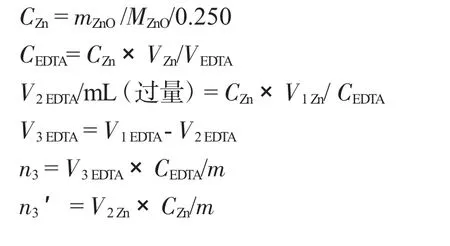
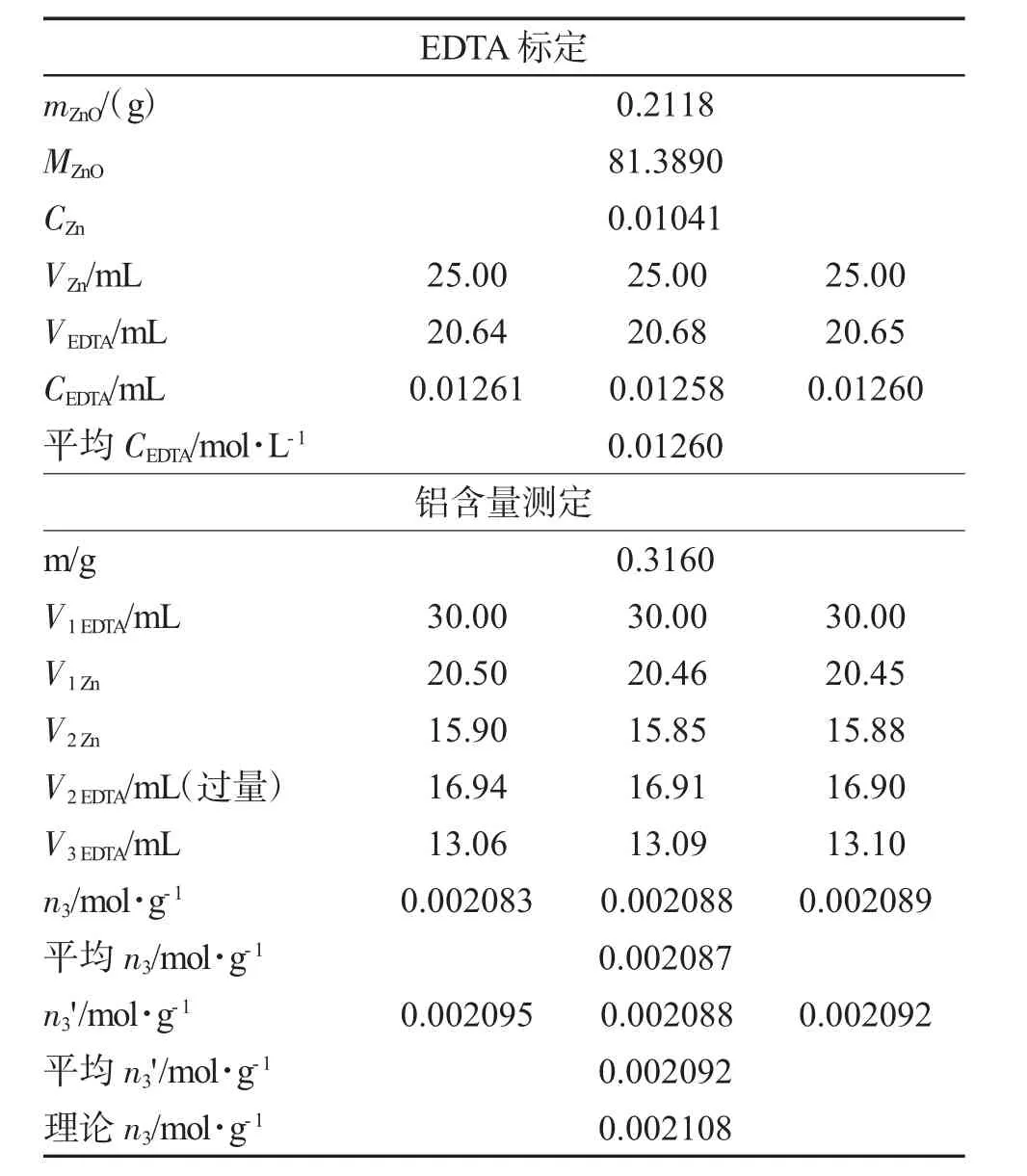
表4 铝含量测定Tab.4 Determination of aluminium
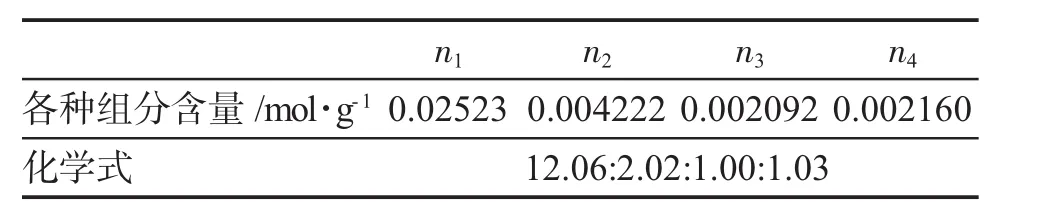
表5 明矾化学式确定Tab.5 Definition of alums chemical formula
3 结论
(1)以生活废铝易拉罐为原料,采用两种不同的方法制备明矾,均获得了很好的结果。
(2)结晶水测定中,差减法的测定结果与热重分析非常吻合,明矾脱水的温度应控制在260~280℃,最适宜恒温时间为2h,否则脱水不完全,达不到理论失重率。但烘箱测定结晶水耗时较长,若能够使用大功率的微波炉进行加热,则会大大节省时间,提高效率。
(4)铝含量测定中返滴定法与置换法结果吻合很好,在控制条件的前提下,结果均符合测定要求。
(5)所测定明矾的组成非常接近理论值:1∶1∶2∶12。
[1]王红云,钟四姣.硫酸铝钾制备实验的改进研究[J].化工设计通讯,2009,35(2):56-57.
[2]马毓晨.回收铝制备明矾晶体的实验探究[J].中国科教创新导刊,2010,(6).
[3]宋婧,曾令可,税安泽,等.钾明矾蓄热性能的研究与改善[J].人工晶体学报,2007,36(2):358-362.
[4]张建军,魏海玉,任志强.硫酸铝钾热分解反应动力学模型[J].无机化学学报,2001,17(2):279-284.
[5]宋粤华,孙玉芬,曾忠民,等.明矾脱水工艺条件研究[J].盐湖研究[J].2000,8(3):27-30.
[6]冉广芬,马海州.硫酸根分析技术及应用现状[J].盐湖研究,2009,17(4):58-62.
[7]宋金如,刘淑娟,朱霞萍.测定水中硫酸根方法的概述[J].华东地质学院学报,2002,25(2):154-158.
[8]孔德明,李一峻.返滴定法测定未知物中铝含量的实验改进[J].实验室科学,2009,(5):79-80.
[9]阳小宇,姜玉梅.EDTA置换滴定法和返滴定法测定矿石中铝含量[J].辽宁化工,2009,38(6):424-425.
[10]师玉荣.铝盐中铝含量的测定中出现的问题及解决方法[J].广东化工,2006,33(9).
O614.43
A
1002-1124(2011)02-0014-05
2010-12-20
程相春,女,高级工程师,硕士研究生,从事科研工作。

