紫外分光光度法研究酸性介质中IO氧化TU的反应机理*
武银华,王新红
(1.盐城技师学院,江苏 盐城 224002;2.盐城师范学院 化学化工学院,江苏 盐城 224051)
科研与开发
武银华1,王新红2
(1.盐城技师学院,江苏 盐城 224002;2.盐城师范学院 化学化工学院,江苏 盐城 224051)
IO与TU在不同的酸性溶液中反应,存在着不同的化学计量方程式。当IO大大过量时,TU完全转化为SO,随着酸度的增大,SO的生成量也逐渐的减小,而I单质的量逐渐增加。当TU逐渐过量时,IO
2完全转化为I-,并有大量的S单质生成,随着酸度的增大,体系中仍有少量的I2单质生成。根据定量结果提出反应在不同条件下的计量方程,这能初步说明一些非线性动力学行为。
高碘酸盐;硫脲;紫外-可见分光光度计
Abstract:Different stoichiometric equations for TU oxidation by IOwere obtained in different acid solution.TU transformed to SOwhen IOwas overdose,I2elementary substance increased instead of SOwhen acidity increased.IOwas transformed to I-completely when TU was overdose,besides with elemental sulfur.There were still a spot of I2elementary substance in system when acidity increased.Based on results the stoichiometric equation under different conditionswere broughtoutwhich explained some nonlinear dynamics actions.
Key words:periodate;thiourea;UV-vis
近来在发现与分析低价含硫物质的氧化过程中准振荡与振荡反应时,涉及到了在不同条件下的反应计量方程,所以系统地测量体系H+浓度(及初始浓度比)对反应的影响是必不可少的。氧化SC(NH2)2的动力学行为已有报道[1-3]。但氧化的计量学的研究工作尚未见报道。本文对这一复杂计量学做了一些探索。
1 实验部分
1.1 仪器及药品
紫外/可见分光光度计(美国PE公司Lambda 40);303型碘离子选择性电极(江苏电分仪器厂);232型甘汞电极(上海雷磁仪器厂);231型PH玻璃电极(上海雷磁仪器厂);精密移液管(5mL、0.5mL各一支,德国Volac公司);电子天平(北京Startorius有限公司);超纯水系统(瑞士Millipore公司产品);SHZ-B水浴恒温震荡器(上海跃进医疗器械厂);PXSJ-216离子分析仪(上海精科雷磁);可控硅温度控制器(上海实验电炉厂)。
高碘酸钠(>99.5%);硫脲(TU)(>99.0%);高氯酸(70.0%~72.0%)等,均为分析纯。
1.2 实验方案
在不同的酸度(4.0、3.0、2.0、1.0、0.1、0.01、10-3.6、10-4、10-5mol·L-1)及不同反应物的初始浓度比(10∶1,5∶1,8∶7,1∶5)条件下,进行反应最终产物的类别和量的分析测定。反应物的配比方案见表1。反应在250mL的棕色瓶里进行,每组反应液配好之后,放入恒温摇床,在25℃下反应至少48h。反应结束,用紫外分光光度计做多波长扫描(其中I2和在 288、351、460nm处有紫外吸收[4]和全波长扫描,全波长扫描范围在190~600nm。

表1 不同浓度比的[NaIO4]与[TU]反应液的配制Tab.1 [NaIO4]and[TU]solution preparation ofdifferent ratio of concentration
反应产物中的[I-]用碘离子选择性电极测定其电极电位后用标准曲线法确定。[I2]用分光光度法测量。用碘量法测定反应后体系的氧化容量 [IO]+[IO]。[SO]用重量法测定。硫脲及甲脒亚磺酸分别在234和269nm处有吸收峰,标准曲线法定量确定。
2 结果与讨论
2.1 结果
2.1.1 R=[NaIO4]0/[TU]0=1∶5时,稳态产物的分析紫外扫描结果见图1。
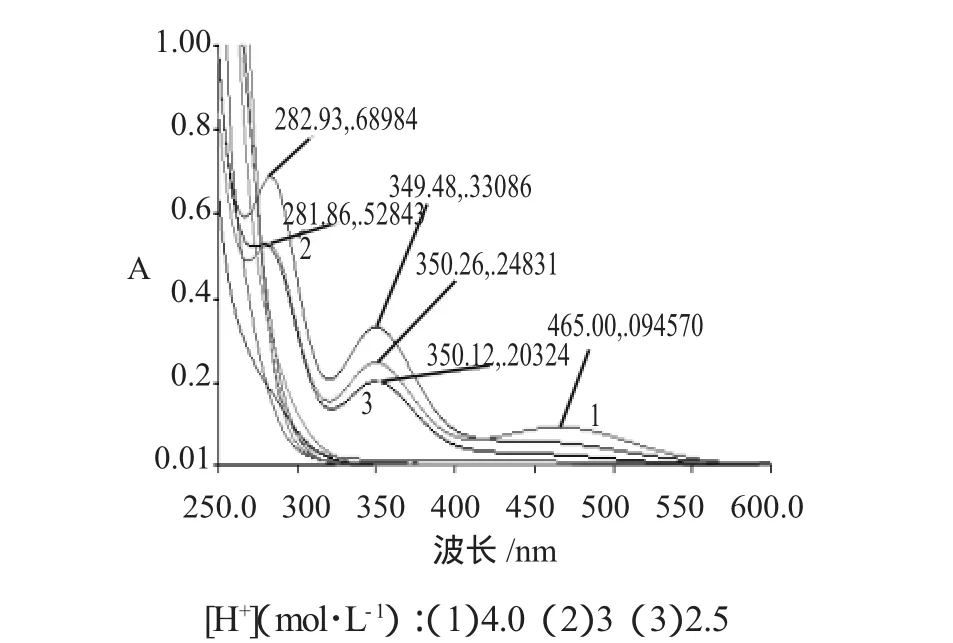
图1 R=1∶5时稳态产物的A-λ曲线Fig.1 A-λ curve of productwhen R=1∶5
2.1.2 R=10∶1时,稳态产物分析 在高酸度条件下(pH值小于1)有I2单质生成。紫外扫描结果见图2。
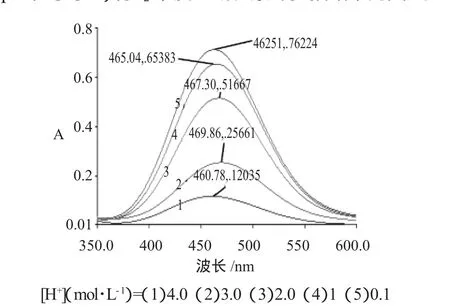
图2 R=10∶1时,稳态产物的A-λ曲线Fig.2 A-λ curve ofproductwhen R=10∶1
由图 2 可见,在[H+]为 4.0、3.0、2.0、1、0.1mol·L-1时,460nm附近的吸收证明都有I2单质的生成。
2.1.3 R=5∶1时,稳态产物分析 定性分析表明,反应达稳态时体系的产物有IO、SO等。在高酸度条件下(pH值小于2)有I2单质生成,低酸度下则无I2单质。在3、1及0.1mol.L-1酸度下有I2晶体析出。紫外扫描显示[H+]为 4.0、3.0、1、0.1、0.01mol·L-1时有I2生成。这与定量结果吻合。
紫外线扫描结果见图3。

图3 R=5∶1时稳态产物的A-λ曲线Fig.3 A-λcurve ofproductwhen R=5∶1

2.1.4 R=8∶7时,稳态产物分析 扫描结果表明,pH 值为 0、1.0、2.0、3.6、4.0 时,有 I2生成,另外,pH值为3.6、4.0时,检测到了。
2.2 讨论
2.2.1 R>4∶1时的化学计量方程式 由R=10∶1和R=5∶1的定量结果表明,体系起始酸度较低时,反应达稳态后硫脲完全转化为SO,同时体系无I2单质和的生成,体系只检测到I和反应剩余的;当体系酸度较高时,硫脲并没有完全转化为SO24-,比如当 R=10∶1,[H+]=4mol·L-1时,SO24-的生成量只有理论量的 90.81%(图 4);R=5∶1时 SO24-的生成量更低,只有53.11%(图5)。同时在酸度较高时体系还有I2单质生成,且[H+]的起始浓度为 1mol·L-1时,体系生成I2的浓度最大(图6)。

图4 R=10∶1时TU转化为S的转化率随pH值的变化曲线Fig.4 Curve for fractional conversion of TU transform to SO2-4
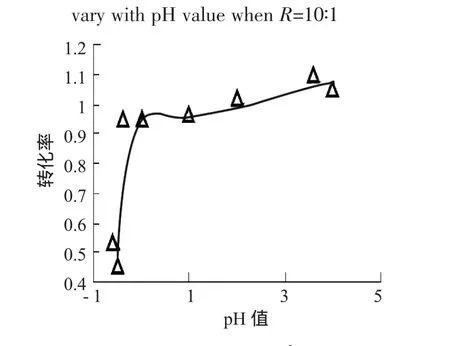
图5 R=5∶1时,TU转化为S的转化率随pH值的变化曲线Fig.5 Curve for fractional conversion of TU transform to SO2-4
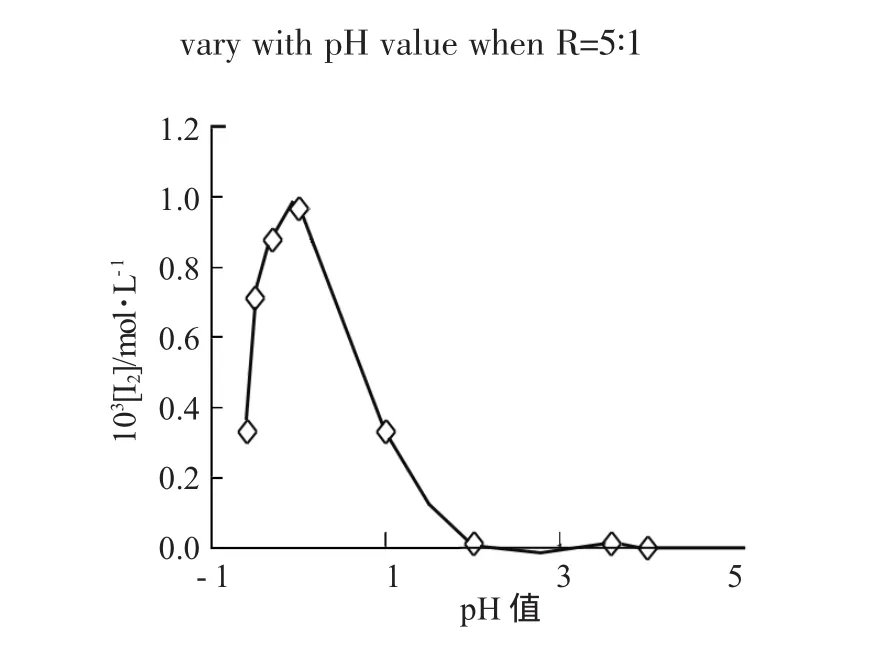
图6 R=10∶1时稳态体系[I2]与pH值关系图Fig.6 Curve for bistable system[I2]and pH valuewhen R=10∶1
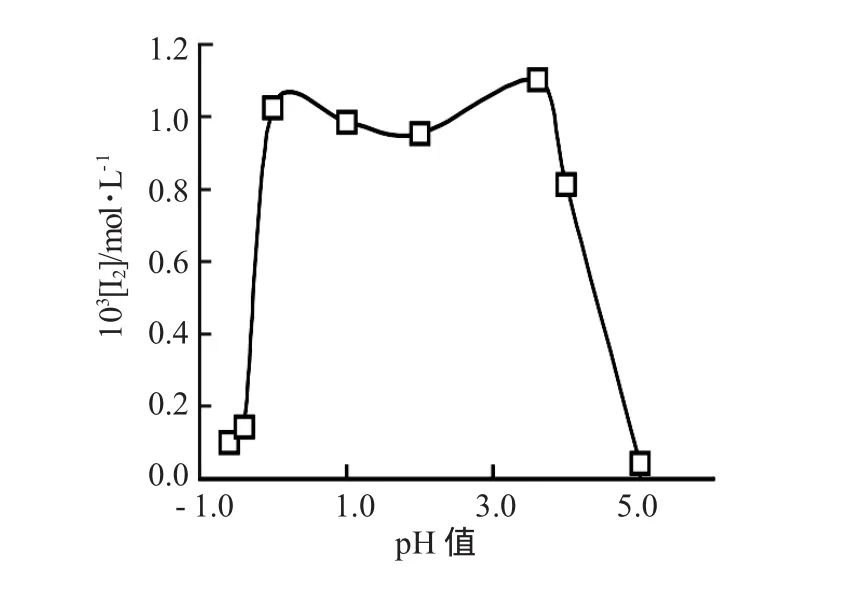
图7 [I]0/[TU]0=8∶7 时,[I2]随 pH 值的变化曲线Fig.7 Curve for[I2]varywith pH valuewhen[I]0/[TU]0
因此,高碘酸盐氧化硫脲的反应,当氧化剂大大过量时(R>4∶1),考虑尿素的水解,其化学计量方程式可分为如下几种情况:
当2<pH<1时,化学计量方程式为:

2.2.2 R=8∶7时的化学计量方程式 定性和定量结果表明,(1)在中等酸度I大部分转化为I2,体系主要发生 R3反应;(2)高酸度(pH值小于 0),S的生成量小于理论值的80%,但全波长扫描时未观察到甲脒亚磺酸(269nm)和硫脲(234nm)的特征紫外吸收峰,同时增大pH值,没有发现有S单质析出。说明体系无双硫脲盐的存在,即硫脲在高酸度下有可能部分转变为甲脒磺酸。可见体系除发生R3反应外,还可能发生R4反应;(3)当pH值大于3.6时,体系检测到的存在,体系发生R5反应。另从测定结果及图4可知,S的生成量随pH值的升高而增大,随pH值的改变呈现“M”形分布(图7)。

2.2.3 R<1∶4时的化学计量方程式 当R=1∶5时,在低酸度条件下([H+]<1mol·L-1),I完全转化为I-,并有大量的S单质生成,此时体系主要的计量方程为 R6反应;当[H+]>1mol·L-1时,体系中仍有少量的I2单质,因酸度较高,观察不到S单质,但向体系加入适量的碱,再加热后即可看到有大量S单质析出,这可证明在高酸度下稳定体系中存在双硫脲盐。

3 结论
高碘酸盐氧化硫脲反应的机理非常复杂,反应条件不同,其对应的反应机理也不尽相同。通过对最终稳态反应产物的定量分析,得出高碘酸盐氧化硫脲在不同初始反应比和不同酸度范围内的化学计量方程式。这与体系的准振荡以及开放系统中的振荡行为[1,2]一致,可以推断I2的生成与消耗是驱使反应非线性的主要因素之一。这为进一步摸清含硫物质被氧化时的非线性机理提供了有用的信息。
[1]王舜,林娟娟,黄振炎,等.高碘酸盐-硫脲-硫酸反应体系的非线性动力学[J].物理化学学报,2002,18(3):264-267.
[2]王舜,林娟娟,陈帆,等.碘酸盐-硫脲非缓冲体系的动力学行为与机理[J].中国科学(B辑),2004,34(4):315-321.
[3]林娟娟,王舜,高庆宇,等,高碘酸盐氧化硫脲的非线性动力学行为和机理[J].化学学报,2003,61(9):1346-1351.
[4]Mundoma,C.;Simoyi,R.H.[J].J.Chem.Soc.FaradayTrans.,1997,93:15.
Reaction mechanism of TU oxidation by IOin acid medium by UV
WU Yin-hua1,WANG Xin-hong2
(1.Yancheng Technicians College,Yancheng 224002,China;2.College of Chemistry and Chemical Engineering,Yancheng Teachers University,Yancheng,224051,China)
O657.32
A
1002-1124(2011)01-0014-04
2010-11-21
江苏省高校自然科学基础研究项目(10KJD150006);盐城师范学院校级自然科学研究项目
武银华(1967-),女,硕士,高级讲师,现从事化学化工技术应用研究和教学工作。

