一种能源微藻IOAC689S的筛选和优化培养
刘 倩, 何梅琳, 李 凌, 于文俊, 徐年军 刘建国
(1. 宁波大学 生命科学与生物工程学院, 浙江 宁波 315211; 2.中国科学院 海洋研究所, 山东 青岛 266071)
一种能源微藻IOAC689S的筛选和优化培养
刘 倩1,2, 何梅琳2, 李 凌2, 于文俊2, 徐年军1, 刘建国2
(1. 宁波大学 生命科学与生物工程学院, 浙江 宁波 315211; 2.中国科学院 海洋研究所, 山东 青岛 266071)
利用氯仿-甲醇(2:1)提取和气相色谱技术, 对采集自渤海、黄海、东海、南海海域以及实验室现有的海洋微藻进行了总脂和脂肪酸检测, 从中筛选到一株高产油微藻 IOAC689S, 其油脂含量在快速生长阶段达到37.5%, 其中可作为生物柴油开发的18C以下脂肪酸占总脂肪酸的91.03%。通过对其ITS和5.8S rDNA全序列进行扩增, 得到了包括18S rDNA及28S rDNA部分序列在内的全长为998bp的DNA片段, 初步确定为一种绿藻。随后利用氧电极检测藻液净光合放氧速率的方法, 研究了光照强度、温度、盐度、pH值、碳源、N和P浓度等不同理化因子对IOAC689S光合作用的影响, 从而得到该藻优化后的培养参数如下: 光照强度200 μmol/(m2·s)、光下培养温度30~35℃, 黑暗培养温度24℃、盐度30、pH值7~9、NaNO3氮源质量浓度75 mg/L、NaH2PO4磷源质量浓度40 mg/L, 而NaHCO3碳源对该藻生长没有明显作用。利用上述优化条件培养该藻获得了较好生长效果, 平均比生长速率为0.210 d−1,每周生物量可增加3.8倍。实验结果还表明在培养后期当pH值提高至10~11时, 藻体易发生沉降, 可以利用该特性进行藻体收获。
生物柴油; 光合放氧; 脂肪酸; 优化培养; 微藻
传统化石燃料资源紧缺且具有不可再生、易产生环境污染等问题, 目前国际上很多国家正在寻求一种可再生无污染的新型清洁能源作为替代能源, 用以缓解日益严峻的能源危机。其中, 利用玉米甘蔗和大豆等农作物为原材料生产生物柴油并部分取代化石燃料,已经在巴西和美国等少数国家得到应用。然而此方法存在与人争粮、与粮争地等问题, 与食品安全存在严重冲突, 特别不适宜于人口众多、人均耕地面积少的中国国情。同高等植物相比, 微藻特别是海洋微藻生产生物柴油优势明显, 如光能利用效率更高、生长繁殖更快、可利用海水以及可在盐碱荒地上通过光生物反应器进行高密度生产而不占用耕作土地资源等, 因此微藻生物柴油开发受到了国内外的特别关注。
众所周知, 含油量和细胞繁殖速度是评价微藻是否适合生物柴油开发最基础也是最关键的 2个指标, 通常两者存在负相关关系。Brown等报道葡萄藻含油量最高能够达到 80%以上[1], 但其生长速率非常缓慢[2-3], 因此难以进行生物柴油开发。到目前为止, 有希望用于生物柴油开发的几株藻株包括Chlorellasp.,Isochrysissp.,Phaeodactylum tricornutum,Dunaliellasp. 和Nannochlorissp.等, 一般生长相对较快同时含油量相对较高, 约为20%~30%[4-7]。为筛选得到含油量更高同时生长也较快的藻株, 作者对实验室保存的微藻和新近从中国沿海分离的微藻进行了筛选, 发现其中藻株 IOAC689S不仅含油率高(37%左右), 而且90%的脂肪酸链长与柴油接近,同时生长速度比较快等特点, 非常适合于微藻柴油开发, 本文将相关实验结果予以报道。
1 材料与方法
1.1 藻种来源和基本培养条件
在实验筛选藻株中, 部分株系从我国渤海、黄海、东海、南海不同站点分离得到, 即借助海上科学考察机会随船出海并采集水样, 分别利用孔径大小不一的滤网按照微孔从大到小的顺序逐级过滤, 仔细收集滤液, 将采集到的水样保活运输到实验室,然后结合稀释、显微挑选和涂布等传统微生物分离方法对藻株进行分离和纯化, 挑选出单细胞藻落,从中获得纯化海洋微藻藻株。另一部分藻株系中国科学院海洋研究所海洋生物技术中心室保存藻种。
上述实验筛选藻株(包括 IOAC689S等)均以Guillard和Hargraves的 L1海水培养基为基础[8], 采用间歇性培养在温度 24℃±0.1℃、光照周期 12 h:12 h、光照强度40 μmol/(m2·s)条件下进行间歇性培养, 培养期间每天定时摇瓶8次。
1.2 DNA序列测定及分析方法
DNA 的提取: 取对数生长期的藻液, 在 4 000 r/min和4 ℃离心10 min, 弃上清, 沉淀藻体用150 μL Milly-Q水重悬后置于离心管中, 采用TaKaRa基因组DNA提取试剂盒提取并纯化藻株基因组DNA。
PCR扩增及其产物的纯化、克隆: 参照文献[9]设计引物扩增其ITS1、5.8S rDNA及ITS2全序列。引物序列为: For 5’-GAAGTCGTAACAAGGTTTCC-3’; Rev 5’-TCCTGGTTAGTTTCTTTTCC-3’。引物由上海生工生物工程技术服务有限公司合成。PCR 反应条件如下: 95℃预变性5 min; 95℃变性30 s, 50℃退火30 s, 72℃延伸1 min, 35个循环; 72℃延伸10 min。PCR 反应体积为25 μL, 其中包括DNA 模板50 ng、Taq DNA 聚合酶 0.2 μL(1U)、引物(10 μmol/L) 各1 μL、dNTP(2.5 mmol/L)2 μL、10 ×buffer 2.5 μL、MgCl2(25 mmol/L)1.5 μL 和 ddH2O 15.8 μL。扩增反应在TaKaRa-TP600型PCR 仪上进行。PCR扩增产物以 1.0% 琼脂糖凝胶电泳检测, 从胶上回收目的DNA片段, 纯化后连接到 pMD18-T载体(TaKaRa)上。参照萨姆布鲁克等[10]转化大肠杆菌 DH5α感受态细胞, 挑取阳性转化子。
菌液选取后送至北京诺赛基因组研究中心有限公司测序。所得序列用Vector NTI软件进行拼接, 然后在 NCBI 服务器上(http://www.ncbi.nih.gov)用BLAST 进行同源检测。
1.3 生物量测定
培养过程中藻生物量的变化采用叶绿素含量指标间接表示[11], 叶绿素采用传统的丙酮法提取, 并利用722型可见分光光度计检测645 nm和663 nm波长下的光吸收, 叶绿素含量按照下列公式计算[11]:Chlorophyll a (mg/L) = (12.7×A663nm−2.69×A645nm) ×稀释倍数。
培养后期藻体生物量采用干重法测定。藻体收获采用离心法, 藻泥用pH4.0的稀HCl冲洗3次, 去除沉淀在藻体表面的矿物质, 藻体采用真空冷冻方法干燥, 藻体质量以电子天平称量。
1.4 粗脂提取和脂肪酸检测方法
粗脂的提取参照Bligh and Dyer方法[12], 脂肪酸含量分析采用气相色谱法, 上机前预处理采用硫酸-甲醇法[13-14]。气相色谱仪采用上海精密科学仪器有限公司产 GC-112A; 脂肪酸测试条件为色谱柱:OmegawaxTM320: 30 m×0.32 mm×0.25 μm; 程序升温条件: 自 60℃以 20 ℃/min速率升至 150 ℃并停留2 min, 再以4 ℃/min速率升至265 ℃。利用标准参照样品标定各脂肪酸出峰时间和顺序, 脂肪酸含量以其峰面积参比内标C17的含量和面积进行计算。
1.5 生长条件逐级优化
生长条件优化按照光合放氧和呼吸耗氧方法,藻液中溶氧量采用OXY-LAB液相氧电极(Hansatech,英国)精确检测, 以单位时间内液体中溶解氧变化计算放氧和耗氧速率, 进而反映微藻生长对不同培养条件的需求。光合溶氧测定过程中外接恒温水浴锅控制温度, 转子转速保持在80 r/min, 以波长660 nm的冷红光为光源。藻液均取自对数生长期藻体且浓度维持在A750nm=0.4, 每个样品测定重复3次以上。
逐级优化培养条件时以L1海水培养基为基础,先进行光强优化[15], 在选取最佳光照强度基础上再进行温度优化, 然后根据最适光温进行酸碱度优化实验, 依次类推。培养参数的优化按照光强、温度、pH、氮、磷浓度和碳源浓度和盐度的顺序逐级完成。
其中, 为保障氮、磷营养盐优化实验的准确性,实验前离心收获 IOAC689S藻泥, 将其重新接种到无N、P的培养液中洗涤和饥饿处理, 以减少培养液中和藻细胞内残余N、P影响。具体操作如下: 将藻液4 000 r/min离心浓缩后, 用无N、P的L1培养基清洗浓缩液 3次, 然后将离心收集的藻液均分两份,一份置于无氮改良 L1培养基中, 一份置于无磷改良L1培养基中, 在光强 40 μ mol/(m2· s)、光暗比 12 h:12 h、温度24℃±0.1℃条件下, 培养72 h, 分别达到N、P饥饿处理效果。然后将经氮饥饿处理过的藻液接种到氮源NaNO3梯度为0、18.8、37.5、75、150、300和600 mg/L的修正L1培养基中培养48 h, 并检测其净光合放氧速率。同样磷实验采用的 NaH2PO4梯度为 0、10、20、40、80、160和 320 mg/L, 实验培养48 h后检测其净光合放氧速率。
2 结果与分析
2.1 含油藻种的筛选
实验过程中对绿藻门(27株)、硅藻门(13株)、金藻门(15株)共55株海洋微藻进行总脂和脂肪酸检测,得到总脂含量在30%以上的9株(其中绿藻3株, 金藻5株, 硅藻1株), 20%~30%的23株(其中绿藻13株, 金藻6株, 硅藻4株), 20%以下的23株(绿藻11株, 金藻4株, 硅藻8株), 其中含油量最低的为一株杜氏藻(Dunaliellasp.), 其总脂含量仅占干藻粉的10%, 而筛选出的一种含油量较高、生长速率也较快且适宜于人工培养生产生物柴油的藻株 IOAC689S,其总脂含量未经诱导情况下达藻粉干质量的37.5%。
该藻ITS1、5.8S rDNA和ITS2 片段经PCR反应后, 成功扩增出一条清晰明亮的条带, 大小 998 bp,与预期片段大小相符(图1)。经BLAST 分析, 发现藻株IOAC689S的DNA扩增片段与Nannochloropsissalina(EU165326)、Nannochloropsis granulata(EU165-324)、Nannochloropsis maritima(DQ074696)、Nannochloropsis limnetica(EU165325)和Nannochloropsis oceanica(DQ069777)中18S rDNA和28S rDNA部分序列在内的ITS1、5.8S rDNA和ITS2 全序列具有较高的同源性, 其相似性分别达到95%、81%、80%、81%和 80%。进一步序列比对表明, 本文所得 DNA片段包含18S rDNA部分序列40 bp, ITS1全序列325 bp, 5.8S rDNA全序列163 bp, ITS2 全序列393 bp和28S rDNA部分序列 77 bp。上述该序列已提交GenBank, 收录号为 GU111540。结合藻细胞其他性状、直径5~12 µm, 健康藻体呈绿色, 悬浮状态生长和显微观察结果确定藻株IOAC689S应为绿藻门。

图1 IOAC689S的18S rDNA部分序列、ITS1、5.8S rDNA、ITS2全序列和28S rDNA部分序列Fig. 1 Partial sequence of 18S rDNA gene; complete sequence of ITS1, 5.8S rDNA gene, and ITS2; and partial sequence of 28S rDNA gene in strain IOAC689S
2.2 脂肪酸组成分析
藻株IOAC689S的脂肪酸组成的气相色谱图(图2)表明, 该藻主要含有8种脂肪酸, 其中脂肪酸碳链长度小于 18C可作为生物柴油开发的占绝大多数,约占总脂肪酸含量91.03%, 而含量最多的16C脂肪酸含量达到总脂肪酸的69.54%。
2.3 生长条件的逐级优化
2.3.1 光照

图2 IOAC689S脂肪酸的气相色谱图Fig. 2 Gas chromatogram of the fatty acids in strain IOAC689S
在温度 25℃±0.1℃及光照强度 0~600 μmol/(m2·s)范围内, 光照强度对该藻净光合放氧速率的影响如图3所示。光照强度小于 200 μmol/(m2·s)时,IOAC689S由耗氧转变到放氧, 且净放氧速率逐渐升至最大值 2.6 nmol/(mL·min), 光照强度大于 200 μmol/(m2·s)时, 光合放氧速率开始缓慢下降。从图3中可以得到: 该藻的光补偿点在光强50 μmol/(m2·s)处, 光饱和点在 200 μmol/(m2·s)处。因此, 适宜IOAC689S光合作用的光照强度在 200 μmol/(m2·s)左右。

图3 不同光强对IOAC689S净光合放氧速率的影响Fig. 3 Effect of light intensity on net photosynthetic O2evolution of IOAC689S
2.3.2 温度
最佳生长光强 200 μ mol/( m2·s)条件下, 温度在15、20、25、30、35、40、45℃变化时, 藻液每分钟溶解氧变化情况如图4所示。结果表明: 当温度处于15~35℃范围内, 藻液的净光合放氧速率随着温度的增高而上升, 在 30~35℃时净光合放氧速率达到最大值, 而当温度进一步升高到 35℃以上净光合放氧速率迅速下降, 到 45℃时呼吸耗氧速率超过了光合放氧速率, 净光合放氧速率变为负值。因此, 适宜IOAC689S光合的温度在相对较高的 35℃左右, 在生产上属于较为耐热的藻株, 比较适宜于在我国亚热带地区全年或温带地区从春、夏和秋季人工培养生产生物柴油。

图4 不同温度对IOAC689S净光合放氧速率的影响Fig. 4 Effect of temperature on net photosynthetic O2evolution of IOAC689S
2.3.3 酸碱度
以氢氧化钠和盐酸调节藻液pH值分别到5、7、9、11、13, 在光暗比12 h:12 h、温度24℃±0.1℃恒温条件下预培养 24 h, 然后在最佳光强和温度条件下, 研究不同pH对IOAC689S的净光合放氧速率影响(图5)。氧电极检测结果表明在pH值5~7时藻净光合放氧速率呈迅速上升趋势并达到最大, pH值大于7时净光合放氧速率迅速下降, pH值11~13时生长活性明显降低, 到 pH值 13时净光合放氧速率降到最低。适宜于IOAC689S光合与生长的pH在7~9之间。由于pH值变化与水体中无机碳源分布有密切关系, 上述结果意味着该藻可能主要以二氧化碳为碳源, 对碳酸氢根利用效率次之, 对碳酸根利用效率最差, 这点可从下面实验中进一步证实。作者还注意到, 在培养过程中当pH值在5 ~ 9时, 藻液呈悬浮状态生长; 但当pH值进一步增加至11以上时, 藻体虽然保持一定的生理活性但出现沉降。因此, 可充分利用该藻对pH值反映的上述特性进行藻体培养和收获。

图5 不同pH值下IOAC689S净光合放氧速率的变化Fig. 5 Effect of pH on net photosynthetic O2evolution of IOAC689S
2.3.4 营养盐
氮磷饥饿后的 IOAC689S在不同浓度氮、磷营养盐的藻液中预培养适应 48 h, 然后在上述最佳光强、温度和pH条件下测定净光合放氧速率, 结果分别如图6和图7所示。其中, 氮质量浓度低于75 mg/L以下时, 净光合放氧速率随氮浓度升高迅速增大,氮质量浓度 75 mg/L时净光合放氧速率达到最大;当氮质量浓度超过 75 mg/L后净光合放氧速率开始降低, 意味着藻生长受到一定程度的抑制(图6)。在磷质量浓度为 0~40 mg/L时, 该藻的光合放氧速率迅速上升, 并于磷质量浓度为 40 mg/L时达到最高(5 nmol/(mL·min), 而磷源质量浓度升高到 40 mg/L后, 藻的光合放氧速率逐步下降, 整体放氧速率曲线呈抛物线状(图7)。因此适宜于IOAC689S生长的氮、磷营养盐浓度分别为75 mg/L和40 mg/L。氮: 磷比率较低(接近2 : 1), 表明该藻生长对磷需求相对较高。
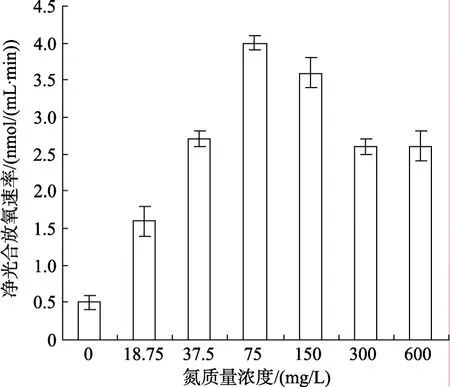
图6 氮浓度对IOAC689S净光合放氧速率的影响Fig. 6 Effect of nitrate concentration on net photosynthetic O2evolution of IOAC689S

图7 磷浓度对IOAC689S净光合放氧速率的影响Fig. 7 Effect of phosphate concentration on net photosynthetic O2evolution of IOAC689S
2.3.5 无机碳源和盐度
在最佳光强、温度、pH和氮、磷营养盐浓度条件下, 碳酸氢钠对 IOAC689S净光合放氧速率的影响如图 8所示。藻净光合放氧速率在不加入碳酸氢钠时最高, 在加入碳酸氢钠的情况下有所下降, 并且随碳酸氢钠浓度加大无明显的波动, 这说明该藻光合作用并不需求碳酸氢钠, 或者也可能是碳酸氢钠的加入改变了藻液的酸碱度, pH值上升导致了其光合放氧速率发生了改变。

图8 不同碳浓度对IOAC689S净光合放氧速率的影响Fig. 8 Effect of sodium bicarbonate on net photosynthetic O2evolution of IOAC689S
同样, 我们开展的盐度实验表明, 藻液盐度对IOAC689S净光合放氧速率存在一定影响, 其中自然海水盐度即 30‰的培养液对其生长最为有利(结果未列出)。
综上所述, 该产油藻株 IOAC689S的优化培养条件如下: 光照强度200 μmol/(m2· s), 光照下温度为30~35℃之间, 黑暗温度24℃左右, 盐度30, pH值7~9, 氮源质量浓度75 mg/L(NaNO3), 磷源质量浓度40 mg/L(NaH2PO4)。
进一步利用上述优化的培养条件与未优化前的培养方法进行对比, 结果表明优化培养条件后IOAC689S的比生长速率由未优化时的 0.168 d−1增加到0.210 d−1, 净增加25%, 生长培养时间明显缩短;优化后IOAC689S平均每周生物量可增加3.8倍, 藻生物量积累速度得以加快。
另外, 作者比较了稳定期、对数期的藻体、高温强光抑制下生长的藻体和氮磷营养盐亏缺培养后的藻体总脂和脂肪酸含量, 发现其脂肪酸组成比例并没有显著改变, 而稳定期所收获的藻产油量要高于对数期所收获的藻(结果未列出), 因此建议在藻生长到稳定期时进行收获以获得更多的油量。
3 讨论
微藻生物柴油作为替代传统化石燃料的可再生新型能源, 已经被证实是可行的[4], 选择一种合适的藻种作为生物柴油原材料至关重要, 其中最基本的选择标准就是具备高含油量和高生长速率。IOAC689S产油率不经诱导就达37.5%, 比大多数含油 20%~30%的产油藻株要高[4-7], 并且其 18碳以下的脂肪酸占总脂肪酸含量 90%以上, 适宜于开发生产生物柴油。同时, IOAC689S平均比生长速率可达到0.210d−1, 比含油非常高的葡萄藻最大比生长速率0.095d−1[3]要高很多。因此, IOAC689S兼有高含油量和高生长速率双重特性, 同时对温度需求在较高的 30℃~35℃之间, 因此是比较好的海洋产油微藻藻株。
温度优化实验中显示 35℃时该藻的净光合放氧速率最高, 但在 35℃长期培养时藻体出现生长不健康的现象, 这可能是因为液相氧电极所测结果反映的仅是藻体在短期内的净光合放氧情况, 而参与光合作用的一部分酶类若长时间处在高温的状态下会钝化甚至失活所造成的。同时, 由于黑暗状态时较高的温度能够使得藻呼吸作用加强, 因此为避免白天积累的有机物和能量在夜间被迅速转化, 加快藻体生长速度和生物量积累速度, 藻体夜间培养温度最好低于白天, 我们建议培养温度在光照条件下为30~35℃之间, 而夜间黑暗条件下24℃左右。
微藻个体较小, 悬浮性强, 通常难以有效收获,收获成本较大, 限制着该藻产业的进一步发展, 因此寻求简易快速、经济廉价的有效收获工艺方法成为该产业关注的重要技术。针对IOAC689S而言, 该藻在近中性和微碱性环境(pH 值 7~9)中具有最佳生长速率, 当 pH值升高至 11时藻体虽然仍具有一定活性, 但容易出现沉降。我们可以充分利用IOAC689S的上述特性, 在生产前期通过控制pH值在9以下培养实现生物量增加; 然后, 在培养后期通过pH值自然升高方法造成藻体自然沉降, 在花费较少的前提下实现藻体第一步浓缩, 大大减少设备投入和能源消耗, 降低收获成本, 然后再采用其他技术对浓缩藻液进行收获。
IOAC689S藻株最适生长条件同很多中国近海区域的自然条件非常接近, 如对昼夜温度、海水酸碱度和盐度的要求等, 这种易于获得的培养条件使其更能满足微藻培养的规模化需求。我国拥有1.8万公里长的海岸线, 1.5亿亩盐碱荒地, 适宜于规模化培养IOAC689S开发生物柴油。
[1] Brown A C, Kyle D J. Hydrocarbon content and its relationship to physiological state in the green algaBotryococcus braunii[J]. Phytochemistry, 1969, 8:543-547.
[2] Dayananda C, Sarada R, Usha Rani M, et al. Autotro phic cultivation of Botryococcus braunii for the production of hydrocarbons and exopolysaccharides in various media [J]. Biomass Bioenergy, 2007, 31: 87-93.
[3] 王军, 杨素玲, 丛威, 等. 营养条件对产烃葡萄藻生长的影响[J]. 过程工程学报, 2003, 3(2): 141-145.
[4] Chisti Y. Biodiesel from microalgae [J]. Biotechnol Adv, 2007, 25: 294-306.
[5] Gordillo F J L, Goutx M, Figueroa F L, et al. Effects of light intensity, CO2and nitrogen supply on lipid class composition of Dunaliella viridis [J]. J Appl Phycol,1998, 10: 135-144.
[6] Takagi M, Karseno S, Yoshida T. Effect of salt concentration on intracellular accumulation of lipids and triacylglyceride in marine microalgae Dunaliella cells [J]. J Biosci Bioeng, 2006, 101: 223-226.
[7] Takagi M, Watanabe K, Yamaberi K, et al. Limited feeding of potassium nitrate for intracellular lipid and triglyceride accumulation ofNannochlorissp.UTEX LB1999 [J]. Appl Microbiol Biotechnol, 2000, 54:112-117.
[8] Guillard R R L, Hargraves P E. Stichochrysis immobilis is a diatom, not a chrysophyte [J]. Phycologia, 1993, 32:234-236.
[9] Timmins M, Thomas-Hall SR, Darling A, et al. Phylogenetic and molecular analysis of hydrogen-producing green algae [J]. J Exp Bot, 2009, 60:1 691-1 702.
[10] 萨姆布鲁克J, 弗里奇E F, 曼尼阿蒂斯T. 分子克隆实验指南[M]. 黄培堂, 译. 第3版. 北京: 科学出版社, 2002: 96 -105.
[11] Arnon D I. Copper enzymes in isolated chloroplasts,polyphenol oxidase in Beta vulgaris [J]. Plant Physiology, 1949, 24: 1-5.
[12] Bligh E G, Dyer W J. A rapid method of total lipid ex traction and purification [J]. Can J Biochem Physiol,1959, 37: 911-917.
[13] Liu JG, Zvi C, Amos R. Fatty acids profile in a high cell density culture of arachidonic acid-richParietochloris incisa(Trebouxiphyceae, Chlorophyta) exposed to high PFD [J]. Chinese Journal of Oceanology and Limnology, 2002, 20(2): 149-156.
[14] 刘建国, 刘伟. 雪藻高密度连续培养中生物量和花生四烯酸的高产率[J]. 海洋与湖沼, 2002, 9(5):499-508.
[15] 苏建宇, 何茜, 贾士儒. 液体悬浮培养条件下发菜细胞的光合速率与呼吸速率[J]. 植物生理学通讯, 2006,6(3): 417-420.
Received: Oct., 21, 2009
Key words:Bio-diesel; photosynthetic O2evolution; fatty acid; optimization; micro algae
Abstract:Total lipid contents and fatty acid compositions of marine microalgae collected from Bohai, Huanghai,Donghai, and Nanhai area and the ones that already existed in the lab of Institute of Oceanology, Chinese Academy of Sciences were analyzed by chloroform-methanol (2:1) extraction and gas chromatography (GC) technology. Marine microalga listed as IOAC689S was unique and suitable for biodiesel production because of its high total lipid content (37.5%) and its high content (91.03%) of short- chain fatty acids (carbon chain length shorter than 18). Total ITS and 5.8S rDNA sequences of this alga were amplified; and a length of 998 bp DNA fragment including 18S rDNA and 28S rDNA sequences was obtained. The changes of net photosynthetic O2evolution in IOAC689S under different culture conditions (including light intensity, temperature, pH, salinity, nitrate, phosphate and carbonate)were determined by an oxygen electrode. Optimized culture conditions were established (200 μmol/(m2·s) illumination, 30~35℃ in light and 24℃ in darkness, 30‰ salinity, pH 7~9, 75mg/L of NaNO3, 40 mg/L of NaH2PO4).NaHCO3as carbon-source showed no significant effect on net photosynthetic O2evolution. Under the optimized culture conditions, 3.8 times biomass increase per week and 0.210 d−1of average specific growth rate were observed for IOAC689S. In addition, the alga easily flocculated at the late cell culture stages when the culture pH was gradually adjusted to 10 or above. This flocculation can be used for biomass harvesting.
(本文编辑:张培新)
A biodiesel producing micro-algal strain IOAC689S and optimization of its culture parameters
LIU Qian1,2, HE Mei-lin2, LI Ling2, YU Wen-jun2, XU Nian-jun1, LIU Jian-guo2
(1. Faculty of Life Science and Biotechnology of NingBo University, 315211 Ningbo, China; 2. Institude of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China)
S963.21+1
A
1000-3096(2011)01-0029-07
2009-10-21;
2010-03-10
国家高技术研究发展计划(863计划)项目(2008AA09Z403);国家重点基础研究发展计划(973计划)项目(2011CB200904); 中国科学院知识创新工程重要方向项目(KGCX2-YW-373-3)
刘倩(1985-), 女, 硕士研究生, 研究方向: 藻类与藻类生物技术, E-mail: jgzqliu@126.com; 通信作者, 刘建国, E-mail: jgliu@qdio.ac.cn

