TLR4及TAK1表达与急性脑梗死炎性反应机制相关性研究
殷建瑞,谢富华,解龙昌,高 聪
(广州医学院第二附属医院,广东广州510260)
急性脑梗死后首先引起一系列炎症反应,释放大量细胞因子、趋化因子、黏附因子和蛋白水解酶等,加重脑组织损伤[1]。脑内固有免疫的激活需要TLRs、TLR4及TAK1来激活NF-κB等信号转导途径,表达许多炎性细胞因子,从而加重脑缺血性损伤[2-3]。本研究通过检测急性脑梗死患者TLR4及TAK1表达的变化探讨其与炎性反应机制的相关性。
1 资料与方法
1.1 临床资料
50例急性脑梗死病例均为我院2009年1月-2010年12月神经内科住院的首次发病患者,发病6 h~24 h入院,符合第4届全国脑血管病会议修订的急性脑梗死诊断标准,并经头颅CT或MRI证实,平均年龄(55.37±12.48)岁。另选健康体检者30例(均除外颈动脉粥样斑块形成)作为健康对照组,平均年龄(60.12±9.37)岁。
1.2 排除标准
两组病例均排除近4 w感染性、免疫性疾病,肿瘤,慢性阻塞性肺部疾病,外周血管性疾病,心力衰竭,心房颤动,肝肾功能不全等。除此之外,急性脑梗死组还应排除:①心源性脑栓塞或其他原因的脑栓塞;②复发的缺血性脑卒中;③瘤性脑卒中。
1.3 方法
所有病例均进行常规资料登记(包括病史、生命体征、既往病史),血常规及生化检查包括血糖、血脂、C-反应蛋白、血白细胞、分叶细胞比例、血小板、梗死病灶大小,其中梗死灶的测定方法采用有病灶的头颅 CT 进行测量,计算公式为(0.5×a×b×c),其中a为最大长径、b为最大横径、c为10 mm的梗死薄片切割值,所有的CT扫描均由神经专科医师进行双盲评估。在入院24 h内进行神经功能缺陷评分(采用NIHSS评分系统)。TLR4及TAK1检测:取血4 mL以密度梯度离心法获取外周血白细胞,以Trizol法提取外周血白细胞,总RNA为模板,以SYBRRGREE设计引物,由上海化工生物工程技术服务有限公司合成,逆转录酶为MMLV(美国Invitrogen公司)。合成的cDNA稀释后取适量以荧光定量PCR法进行TLR4、TAK1及β-actin检测。扩增产物取每个反应体系6 μL,于1.5%琼脂糖凝胶中电泳,电泳结果在凝胶成像分析系统中分析泳带的平均场密度面积值,以此值表示相应基因的表达强度。
1.4 统计学方法
所有数据均以均数±标准差表示,采用SPSS10.0软件进行统计学处理。各组间的两两比较通过t检验分析,并应用多元逐步回归分析确定各研究因素对TLR4的影响。
2 结果
2.1 两组病例一般临床特征比较
结果见表1。由表1可以看出,健康对照组与急性脑梗死组年龄、性别、吸烟史、糖尿病病史及高血压病史之间差异比较无统计学意义;急性脑梗死组患者血糖水平、CRP水平、白细胞计数、入院时NIHSS评分及脑梗死容积均比健康对照组高,差异比较均有统计学意义(P<0.05)。
2.2 两组病例外周血中不同发病时间TLR4及TAK1的含量变化比较
结果见表2。由表2可以看出,急性脑梗死患者外周血中TLR4及TAK1含量随病情变化呈增高趋势,以发病后第12小时升高最明显,与健康对照组比较,差异有统计学意义(P<0.05)。
2.3 各因素与急性脑梗死病灶容积的相关性分析
结果见表3。由表3可以看出,脑梗死病灶的容积与糖尿病史、CRP水平、外周血白细胞计数、入院时NIHSS评分均有相关性;另一方面,脑梗死病灶容积与 TAK1、TLR4(1 h)无显著相关性,而 TLR4(12 h、24 h)的表达与脑梗死病灶的容积有相关性,同时在校正糖尿病史、CRP水平、NIHSS评分、白细胞计数影响的基础上,TLR4(12 h、24 h)的表达与脑梗死病灶的容积仍存在独立相关性。
3 讨 论
脑梗死(cerebral infarction,CI)的发生及进程涉及到炎症反应,本研究发现急性脑梗死患者白细胞计数、CRP、血糖水平等均较健康对照组高,且上述指标与脑梗死的梗死灶容积成正相关,与既往研究结论相符。
表1 两组病例一般临床特征比较 (±s)
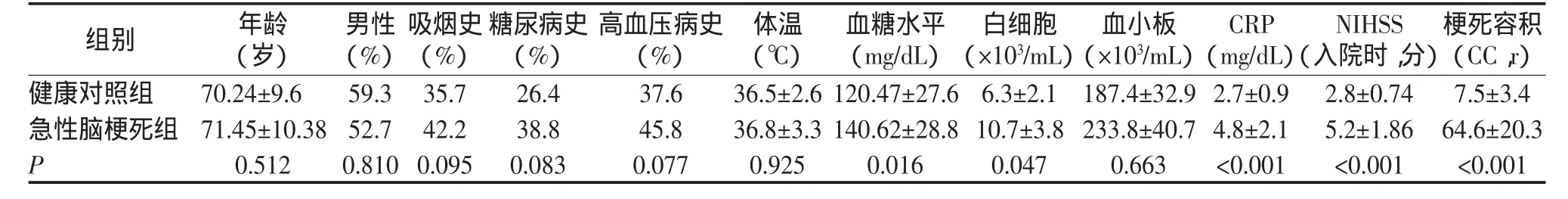
表1 两组病例一般临床特征比较 (±s)
梗死容积(CC,r)健康对照组 70.24±9.6 59.3 35.7 26.4 37.6 36.5±2.6 120.47±27.6 6.3±2.1 187.4±32.9 2.7±0.9 2.8±0.74 7.5±3.4急性脑梗死组 71.45±10.38 52.7 42.2 38.8 45.8 36.8±3.3 140.62±28.8 10.7±3.8 233.8±40.7 4.8±2.1 5.2±1.86 64.6±20.3 P 0.512 0.810 0.095 0.083 0.077 0.925 0.016 0.047 0.663 <0.001 <0.001 <0.001组别 年龄(岁)男性(%)吸烟史(%)糖尿病史(%)高血压病史(%)体温(℃)血糖水平(mg/dL)白细胞(×103/mL)血小板(×103/mL)CRP(mg/dL)NIHSS(入院时,分)
表2 两组病例外周血中不同发病时间TLR4及TAK1的含量变化比较 (±s)

表2 两组病例外周血中不同发病时间TLR4及TAK1的含量变化比较 (±s)
注:与本组 1h 比较,1)P<0.01
组别 TLR4 TAK1 1 h 12 h 24 h 1 h 12 h 24 h急性脑梗死组 4.57±1.21 7.23±2.541) 5.88±2.071) 20.38±4.56 37.40±6.851) 34.83±5.611)健康对照组 - 1.69±0.78 - - 13.27±4.29 -
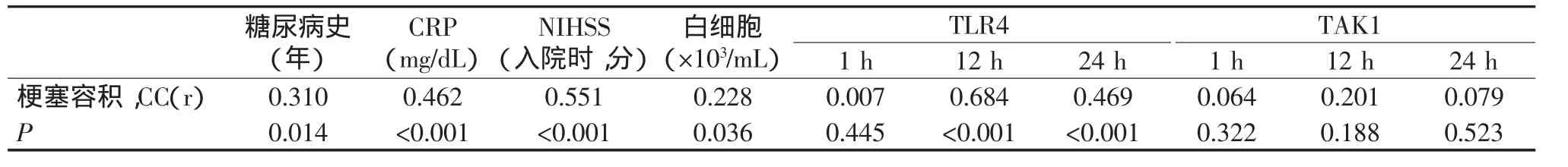
表3 各因素与急性脑梗死病灶容积的相关性分析
TLR4是细菌LPS的受体;在LPS诱导的信号传导中起重要作用,TLR4通过协同分子CD14、LPS结合蛋白LBP和MD2的共同作用经由MyD88、TRAF-6丝裂原活化的蛋白激酶MAPK等信号传导途径,将LPS传导通路的信号迅速传至核内,激活核因子NF-κB通路和相关细胞因子的表达,释放促炎性细胞因子,激活特异性免疫应答,在机体的先天性和获得性免疫中起重要作用[4]。近年来的研究显示免疫系统的介入和多种细胞因子的大量释放在急性脑梗死的病情演变过程中起着至关重要的作用[5]。本研究结果发现,在急性脑梗死的患者外周血可见TLR4表达明显升高,其表达随病情的严重程度呈现增高趋势。同时,TLR4表达在发病12 h、24 h与脑梗死病灶的容积有相关性,经校正糖尿病史、CRP、白细胞计数等影响因素后仍存在独立相关性。由此说明,TLR4参与了急性脑梗死的发病过程,至少能够成为急性脑梗死患者的一种生物标记物。
TAK1是一种激酶,是一种参与调节各种细胞活动的信号蛋白。TAK1能够激活两种特异性的蛋白质——NF-κB和JNK,这两种蛋白质与机体免疫、炎症、细胞程序性死亡以及癌症的发生有关[6]。最初对TAK1的描述是在骨发育过程中,TAK1在转化生长因子beta和骨形成蛋白(BMP)信号转导中起作用。但研究逐渐证明,它在TLR信号转导中也起着非常重要的作用。在IL-1信号传导研究中显示,TAK1与一个特殊的激活因子-TAK1结合蛋白(TAB1)共同激活 NF-κB 诱导激酶(NIK)和 IκB 激酶(IKK)[7]。实验已证明,在 TLR4 启动的 LPS 信号转导过程中,TAK1的重要作用不仅是激活NF-κB,而且通过激活p38MAPK和JNK,对MKKK具有调节作用,从而调节炎症反应过程下游因子的发生。本研究发现急性脑梗死患者TAK1含量明显升高,然而,并没有发现TAK1的含量与脑梗死的梗死容积有任何相关性。因此只能说明TAK1参与了脑梗死发病的炎症反应机制,作为一种新的治疗靶点仍不明确。
总之,TLR4及TAK1在急性脑梗死发病的炎性反应机制的病理生理过程中发挥了作用,TLR4可作为脑梗死的治疗靶点,然而寻找新的治疗药物仍需进一步研究。
[1]Vila N,Castillo J,Dávalos A,et al.Proinflammatory cytokines and early neurological worsening in ischemic stroke[J].Stroke,2000,31(10):2 325-2 329.
[2]Castellanos M,Castillo J,Garc M M,et al.Inflammation mediated damage in progressing lacunar infarctions:a potential therapeutic target[J].Stroke,2002,33(4):982-987.
[3]DeGraba T J.The role of inflammation after acute stroke:utility of pursuing anti-adhesion molecule therapy[J].Neurology,1998,51(S3):62-68.
[4]Brea D,Sobrino T,Ramos-Cabrer P,et al.Inflammatory and neuroimmunomodulatory changes in acute cerebral ischemia[J].Cerebrovasc Dis,2009,27(S1):48-64.
[5]Cao C X,Yang Q W,Lv F L,et al.Reduced cerebral ischemia-reperfusion injury in toll-like receptor 4 deficient mice[J].Biochem Biophys Res Commun,2007,353(2):509-514.
[6]Caso J R,Pradillo J M,Hurtado O,et al.Toll-like receptor 4 is involved in subacute stress-induced neuroinflammation and in the worsening of experimental stroke[J].Stroke,2008,39(4):1 314-1 320.
[7]Di Y,Li S,Wang L,et al.Homeostatic interactions between MEKK3 and TAK1 involved in NF-kappa B signaling[J].Cell Signal,2008,20(4):705-713.

