干扰素体外释放酶联免疫法在结核病诊断中的价值
刘佳文 康丽军 翁绳凤 朱新颖
目前我国结核病年发病人数约为130万,占全球发病人数的14.3%,位居世界第2位,结核分枝杆菌感染率高,人感染结核分枝杆菌后,大部分会成为无症状的潜伏性结核感染者(latent tuberculosis infection,LTBI)。然而当机体免疫力降低时,则会导致结核分枝杆菌大量增殖,引发临床疾病。尽早发现结核分枝杆菌感染是预防与控制结核病传播的重要手段之一。北京万泰生物药业股份有限公司研制的结核分枝杆菌相关γ-干扰素检测试剂盒(体外释放酶联免疫法)(Wantai quantitative diagnostic kit for Mycobacterium tuberculosis IFN-γrelease assay,WT-IGRA)(简称 WT 试剂)与澳大利亚Cellestis有限公司生产的QuantiFERON·-TB试剂盒 (QuantiFERON·-TB GOLD in tube,QFTGIT)(简称QFT试剂)的检测原理一致,均是检测结核特异性抗原介导的细胞免疫反应。抗原ESAT-6、CFP-10和 TB7.7为致病性结核分枝杆菌特有,而卡介苗没有的片段[1]。LTBI体内拥有针对这些抗原的特异性T淋巴细胞,能识别、递呈这些抗原,并刺激T淋巴细胞增殖、释放细胞因子,如γ-干扰素[1](IFN-γ)。而 QFT 试剂和 WT 试剂可以定量检测这些释放的特异性IFN-γ。为各级医疗单位的结核分枝杆菌感染诊断提供一种间接的检测方法,为临床医生提供一种结核病尤其是肺外结核的辅助诊断方法。笔者用2种试剂检测病区与门诊结核病患者(249例)及健康者(140例)的全血标本,评价干扰素体外释放酶联免疫法(quantitative diagnostic kit for Mycobacterium tuberculosis IFN-γrelease assay,TB-IGRA)在结核病诊断中的应用价值。
对象和方法
一、对象
249例结核病患者来自2010年10月12月北京老年医院感染门诊和感染病房;其中男性159例,女性90例,平均年龄44岁;痰菌阳性肺结核(痰抗酸杆菌涂片阳性或培养阳性)58例,痰菌阴性肺结核(痰抗酸杆菌涂片及培养均阴性)95例,痰菌阴性肺外结核(痰抗酸杆菌涂片及培养均阴性)14例,实验室结果不全结核病患者82例(无痰抗酸杆菌涂片及培养结果);菌阴肺结核的诊断主要是根据临床症状及影像检查并参照菌阴肺结核的诊断标准排除其他疾病后确诊为痰菌阴性肺结核[2]。普通人群140例,其中28例为北京老年医院检验科工作人员或其家属[其中LTBI人群(PPD 3+~4+)11例] ,男性64例,女性76例,平均年龄31岁;LTBI[无结核症状,但结核菌素试验(PPD)结果≥20mm,包括出现水泡的人群] 20例;正常对照(明确为非结核病患者,且PPD<3+,无水泡的普通人群)120例。
二、仪器和试剂
Mutiskan MK3型酶联免疫检测仪,赛默飞世尔(上海)仪器有限公司生产。WT试剂与QFT试剂。
三、方法(按说明书方法进行)
1.WT试剂试验步骤:首先,使用BD(美国BD公司)肝素锂抗凝采血管抽取超过5ml静脉血,马上轻柔地颠倒混匀3次以上,使抗凝剂充分溶解。采集到全血分装到3种不同的培养管中。“T”为添加了结核特异性抗原ESAT-6、CFP-10的测试培养管;“N”为本底对照培养管;“P”为添加了非特异刺激抗原植物血球凝集素(PHA)的阳性对照培养管。每种培养管分装1ml,分装前需要颠倒混匀3次以上。分装后轻柔颠倒培养管5次,立刻于37℃培养箱中静置培养(22±2)h。静置培养(22±2)h后取出,离心收集上清液。其次,用双抗体夹心法定量检测上清液中IFN-γ的含量。根据刺激培养系统中特异性升高的IFN-γ的量,来判定是否为结核分枝杆菌感染阳性。理论上每位受试者都能对非特异刺激抗原PHA产生反应。
2.QFT试剂试验步骤:QFT试剂新鲜全血标本采集,利用参考试剂中提供的3种不同的采血管,按照本底对照培养管、结核特异性抗原测试培养管、非特异刺激抗原阳性对照培养管的顺序分别采集1ml静脉血,马上轻柔的颠倒摇匀3次以上,使抗凝剂充分溶解。新鲜全血经刺激培养(22±2)h后,(1080~3130)×g离心10min,取上清液放于新的环氧树脂(EP)管中,完成酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测。
四、统计学处理
应用SPSS 11.5统计软件进行数据统计处理,计数资料组间比较,采用χ2检验,P<0.05认为差异有统计学意义。
结 果
一、TB-IGRA检出结核分枝杆菌感染的阳性率和特异度
结核患者249例,正常对照120例,LTBI 20例,检测结果见表1。140例普通人群中,28例为北京老年医院检验科的工作人员或其家属,WT试剂阳性率 46.4%(13/28),QFT试剂阳性率67.8%(19/28),PPD 3+~4+率为39.3%(11/28)。WT试剂特异度、QFT试剂特异度均为83.3%(100/120)。
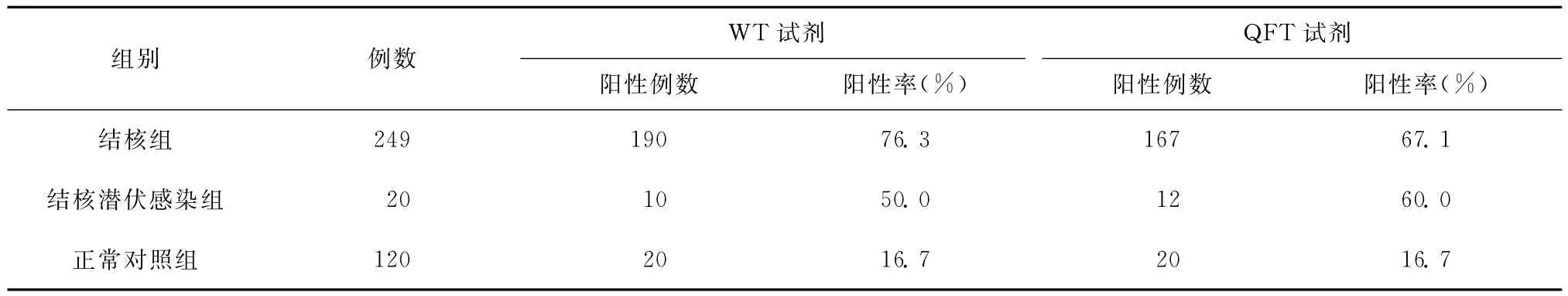
表1 结核组与正常对照组的WT试剂和QFT试剂TB-IGRA结果
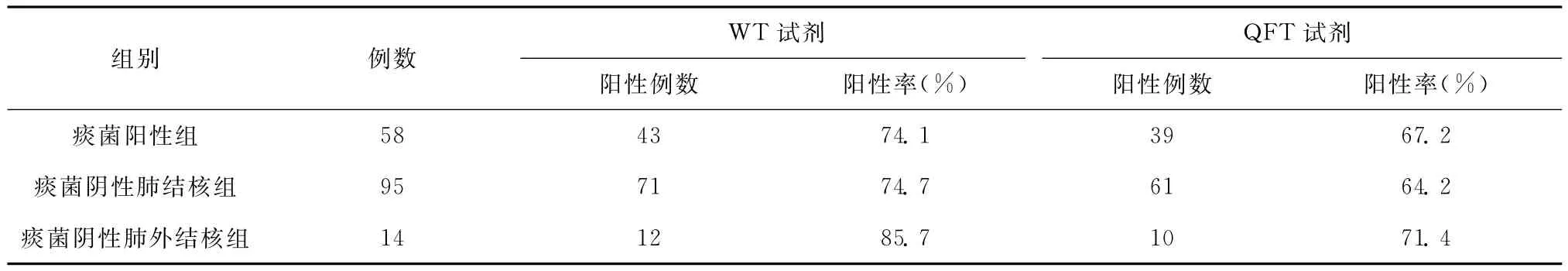
表2 痰菌阳性组与痰菌阴性组WT试剂和QFT试剂TB-IGRA结果
二、菌阳和菌阴结核病患者WT试剂和QFT试剂阳性率比较
无痰抗酸杆菌涂片及培养结果的82例结核病患者未进行统计。痰菌阴性结核病患者WT试剂阳性率为76.1%[(71+12)/(95+14)] ,痰菌阴性结核病患者 QFT试剂阳性率65.1%[(61+10)/(95+14)] (表2)。痰菌阳性组与痰菌阴性组比较,WT试剂χ2=0.082,P>0.05;QFT 试剂χ2=0.075,P>0.05,差异均无统计学意义。痰菌阴性肺结核组与痰菌阴性肺外结核组比较,WT试剂χ2=0.081,P>0.05;QFT 试剂χ2=0.280,P>0.05,差异均无统计学意义。
三、PPD结果与TB-IGRA结果之间的相关性
PPD与WT试剂、QFT试剂的相关性,由强到弱,呈明显递减趋势;PPD检测结果为3+~4+,WT试剂的检出阳性率77.9%(67/86),QFT试剂的检出阳性率68.6%(59/86);PPD检测结果为阴性,WT试剂的检出阳性率43.5%(10/23),QFT试剂的检出阳性率30.4%(7/23)(表3)。
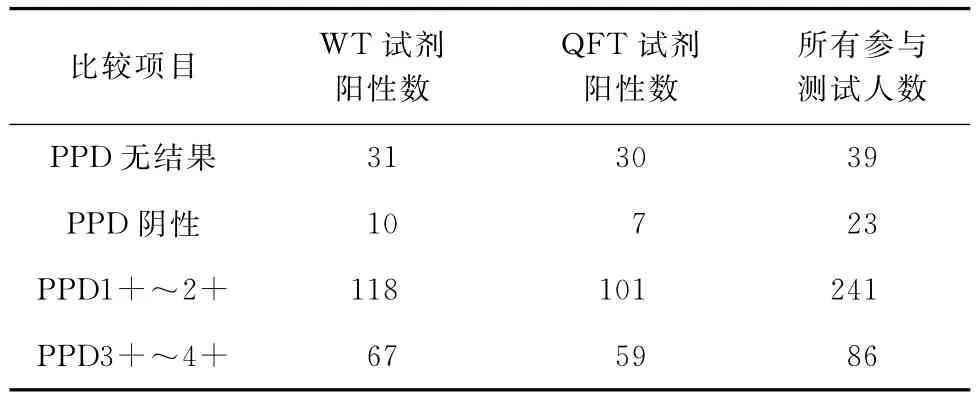
表3 WT试剂和QFT试剂TB-IGRA结果与PPD相关性(例)
四、WT试剂与QFT试剂符合率
WT试剂与QFT试剂阳性符合率为91.9%[181/(181+16+0)×100%] ,阴性符合率为77.0%[147/(44+147+0)×100%] ,总符合率为84.3%[(181+147+0)/(197+191+1)×100%] (表4)。
讨 论
目前常用的结核诊断方法有X线胸片、PPD试验、抗酸染色、结核(TB)-聚合酶链反应(PCR)检测等。传统的抗酸杆菌染色及结核杆菌培养都因其敏感度、特异度及检测速度等方面的问题而不能满足临床需要。近年来,针对结核杆菌特异性蛋白的TB-IGRA已普遍用于结核杆菌感染的诊断。TBIGRA的原理是检测机体对结核杆菌特异性蛋白ESAT-6、CFP-10和 TB-7.7的免疫反应。与PPD试验用的结核菌素不同,这些蛋白在所有结核分枝杆菌及致病性牛分枝杆菌中特异表达,而在卡介苗和大多数非结核分枝杆菌中不表达[1]。因此,TB-IGRA检出结核杆菌感染的特异度和敏感度都较高。

表4 WT试剂和QFT试剂TB-IGRA结果符合率(例)
一、TB-IGRA检出结核杆菌感染的特异度和敏感度
本试验中,在249例结核患者中,WT试剂阳性率76.3%,QFT 试剂阳性率67.1%,WT 试剂和QFT试剂特异度都是83.3%,与国内使用相同试剂所做的试验有差异。张华等[3]报道 WT试剂阳性率90.24%,特异度93.34%,李晓非等[4]报道WT试剂阳性率90.9%,特异度76.9%,分析其中的原因可能与标本量的大小、标本的来源有关。WT试剂盒于2010年在昆明市第三人民医院、北京老年医院、厦门市疾病预防控制中心同时使用,标本量扩大到786例,其中有637例阳性,阳性率为81.0%。本试验检测菌阳病区结核患者、菌阴肺外结核患者阳性检出率较高,WT试剂分别为88.2%(15/17)、85.7%(12/14)。也和国外报道接近[5]。
二、菌阳和菌阴结核病患者WT试剂和QFT试剂阳性率比较
菌阳和菌阴结核病患者WT试剂阳性率分别为74.1% (43/58),76.1% (83/109),χ2=0.082,P>0.05,QFT试剂阳性率分别为67.2%(39/58),65.1%(71/109),χ2=0.075,P>0.05,菌阴肺结核与菌阴肺外结核患者WT试剂阳性率分别为74.7%(71/95),85.7%(12/14),χ2=0.081,P>0.05,QFT试剂阳性率分别为64.2%(61/95),71.4%(10/14),χ2=0.280,P>0.05,上述差异均无统计学意义。对于TB-IGRA可作为评估抗结核治疗疗效的理想指标[6]的结论还需进一步论证。
三、TB-IGRA检测结核潜伏感染意义
由于目前缺乏检测结核潜伏感染特异性的黄金标准,以无结核症状,但PPD结果3+~4+的人群定义为结核分枝杆菌潜伏感染[7],从表1可以看到,QFT试剂 TB-IGRA 阳性率为60.0%(12/20);北京老年医院检验科28例工作人员和家属中,PPD 3+~4+率为39.3%(11/28),QFT试剂TB-IGRA阳性率为67.8%(19/28),北京老年医院检验科是结核病实验室,有大量的含结核分枝杆菌的痰标本,其工作人员或多或少接触结核分枝杆菌,均是结核分枝杆菌的密切接触者。Brodie等[8]报道TB-IGRA值与结核患者的密切接触程度相关,且不受机体免疫力及卡介苗接种的影响。此次研究发现,北京老年医院检验科工作人员工作时间长短(密接程度)与TB-IGRA值大小无正比例关系,其中1例工作时间最长,但TB-IGRA为阴性。即使这样,这项研究表明,TB-IGRA和PPD 2种检测方法对结核潜伏感染的检出都有一定的作用。当PPD检测结果为3+~4+,WT试剂阳性检出率为77.9%(67/86)。但 PPD 检测可能增加其后 TBIGRA中对干扰素的应答水平。南非一项研究显示,筛查结核潜伏感染可采用先PPD检测后TBIGRA的二步策略,但TB-IGRA须在PPD检测之后的3d内进行[9]。
四、WT试剂与QFT试剂符合率
这个研究采用2个厂商的试剂是为了更好评价TB-IGRA方法的真正价值。虽然原理相同,但2种试剂结果仍存在差别,389例中有61例结果不符(见表4);总的来说,WT试剂与QFT试剂符合率良好,达84.3%。但TB-IGRA方法在中国要应用到临床中还有很多工作需要做,特别是不同厂商试剂结果的可比性,方法学的标准化、规范化、临界值(cut off值)合理性等还需要做进一步的研究。
[1] Mahairas GG,Sabo PJ,Hickey MJ,et al.Molecular analysis of genetic differences between Mycobacterium bovis BCG and virulent M.bovis.Bacteriol,1996,178(5):1274-1282.
[2] 中华医学会.临床诊疗手册结核病分册.北京:人民卫生出版社,2005:122.
[3] 张华,黄圣文,罗振元.结核分枝杆菌γ-干扰素体外释放定量试验诊断结核感染的临床应用.中华医院感染学杂志,2009,19(14):1898-1899.
[4] 李晓非,赵琴,汪亚玲,等.两种结核分枝杆菌γ-干扰素定量检测试剂盒检测结核分枝杆菌感染结果比较研究.中国防痨杂志,2011,33(5):267-270.
[5] Diel R,Goletti D,Ferrara G,et al.Interferon-γrelease assays for the diagnosis of latent Mycobacterium tuberculosis infection:a systematic review and meta-analysis.Eur Respir J,2011,37(1):88-99.
[6] 杨智峰,周霞.利用结核分枝杆菌抗原特异性γ-IFN体外释放测定评估抗结核治疗疗效的临床应用价值.氨基酸和生物资源,2009,31(1):67-69.
[7] Lalvani A.Diagnosing tuberculosis infection in the 21st century:new tools to tackle an old enemy.Chest,2007,131(6):1898-1906.
[8] Brodie D,Lederer DJ,Gallardo JS,et al.Use of an interferongamma release assay to diagnose latent tuberculosis infection in foreign-born patients.Chest,2008,133(4):869-874.
[9] Richeldi L.Diagnosing latent tuberculosis infection:guess who’s coming to dinner?Am J Respir Crit Care Med,2009,180(1):1-2.

