结核病若干问题研究进展
成诗明 庄玉辉
结核病是由结核分枝杆菌引起的一种严重危害人类健康的慢性传染病。据世界卫生组织(World Health Organization,WHO)2010年全球结核病控制报告显示[1],2009年全球新发结核病患者940万,共有结核病患者1400万,死于结核病者130万。结核病给人类的健康带来了如此巨大的负担,人类一直致力于结核病诊断、治疗、预防等方面的研究。笔者将从以下5个方面来介绍结核病研究的一些进展。
结核分枝杆菌基因组和后基因组学的研究
随着人类基因组计划的成功完成,人类在破译生命密码的征程上迈出了坚实的一步。在此背景下,人类对模式生物如酵母、线虫、果蝇、小鼠等的基因测序也相继完成。1998年英国Sanger中心和法国Pasteur研究所的科学家合作完成了结核分枝杆菌H37Rv株的基因组测序工作,结核分枝杆菌H37Rv全基因组大小为4 411 529bp,G+C含量为65.6%,编码3988种蛋白质[2]。这标志着结核分枝杆菌的研究已经进入了基因组时代。
随着人类进入21世纪,人类基因组的研究正在逐渐跨入后基因组时代。后基因组学又称为功能基因组学[3],是在基因组学前期研究成果,主要是结构基因组学研究所获得的信息和产物的基础上,全面、系统的分析基因的功能,力图在基因组水平上对其基因的活动规律进行阐述。目前研究进展比较快的领域包括比较基因组学和蛋白质组学。比较基因组学是一种鉴定生物体间基因组差异,研究遗传变异,阐明生物体间生理、生化、毒力差异的有效方法。比较基因组学的研究结果表明结核分枝杆菌复合群各菌种在脱氧核糖核酸(deoxyribonucleic acid,DNA)水平上同源性大于99.95%[4]。熊志红等[5]用差异分析技术分析了结核分枝杆菌强毒株H37Rv和弱毒株H37Ra在体外培养条件下基因表达的差异,通过20种引物组合进行mRNA差异显示,克隆到了两菌株间的20余个差异表达基因,经序列分析及杂交鉴定发现其中2个基因仅在H37Rv中表达,而在H37Ra中没有表达。比较基因组分析的结果显示了不同结核分枝杆菌遗传的多样性,这可能与不同疫苗的效果不同有关[6]。
蛋白质组学可以全面分析细胞在稳定条件下产生的蛋白质的概况。应用蛋白质组可以检测到基因组中未能检测到的基因,是对基因组分析方面的补充。蛋白质组学研究主要技术有[7]:规模化蛋白质微量鉴定、二维或双向凝胶电泳分离蛋白质谱;“差异显示”蛋白质组学;应用质谱技术或酵母双杂交方法研究蛋白质与蛋白质的相互作用等。目前应用双向凝胶电泳-质谱分析技术,从细菌体外培养物中共检测到2600种蛋白斑点,如果这些蛋白斑点都是不同的蛋白质,则相当于基因组学中预测蛋白质总数的65%,进一步进行其功能学的研究将有极大的应用价值[8]。
宿主结核病易感基因的研究
结核病的发病是多因素作用的结果。在暴露于结核分枝杆菌的人群中,只有10%的人会发病[9]。这说明结核病的发病不仅与环境暴露有关,宿主自身的遗传因素对结核病的发病也起着重要作用。目前相关的研究主要集中在以下几种基因:自然抗性相关巨噬细胞蛋白1(natural resistanceassociated macrophage protein 1,NRAMP1)基因、维生素D受体(vitamin D receptor,VDR)基因,人类白细胞抗原(human leukocyte antigen,HLA)-DR基因、甘露糖结合凝集素(mannose binding lectin,MBL)基因等。
邵凌云等[10]通过病例对照研究明确了结核感染与NRAMP1基因多态性的关系。NRAMP1的不同基因多态性的协同作用导致了对结核病的易感性。
刘玮等[11]采用病例对照研究设计,用聚合酶链反应-限制性片段长度多态性分析检测VDR基因中T/C多态性位点,在多因素分析中调整卡介苗接种史和吸烟状况后,VDR-ff基因型与肺结核发病仍有显著性关联(调整OR=3.036,95%CI:1.117~8.253)。VDR-ff 基因型可能是中国汉族人群肺结核病的易感基因型。
刘志辉等[12]研究发现HLA-DR16等位基因与南方汉族部分人群的肺结核的发病明显关联,或与真正起作用的易感基因连锁,中国南方汉族部分人群DR1、DR13.3等位基因的表达对结核分枝杆菌感染者的发病可能具有拮抗作用。
刘玮等[13]采用病例对照的方法对MBL基因多态性与中国汉族人群肺结核发病的关联进行了分析,结果显示MBL基因XB组单倍体型与中国汉族人群肺结核发生的易感性显著相关(调整OR=1.60,95%CI:1.07~2.41)。
总而言之,目前的研究结果显示人类肺结核易感性与基因多态性存在关联,何种基因与结核病的易感性关系更为密切有待进一步的研究。相关研究的开展定能揭示结核病的遗传学基础,为结核病的基因治疗提供思路,最终会对结核病的控制和预防发挥重要的作用。
结核病疫苗的研究
自1921年以来,由牛结核分枝杆菌经过13年230次传代制成的减毒株-卡介苗(Bacille Calmette-Guérin,BCG)是目前世界上惟一批准用于结核病预防的疫苗。BCG对于儿童重症结核病如粟粒型结核、结核性脑膜炎具有良好的预防保护效果[14],但是其保护效力随年龄增长而下降,一般为10~20年。对于青少年和成年人,其保护作用差异较大。有研究显示BCG对成人肺结核的免疫保护作用为0%~80%[15]。鉴于BCG疫苗和单一的免疫方案的缺陷,对新型结核病疫苗和免疫接种方案的研究迫在眉睫。新型结核病疫苗不仅要对各年龄组未感染结核菌的人群提供良好的预防作用,同时要对已感染的人群提供消除体内残留的结核分枝杆菌,防止结核病复燃的保护作用。
目前正在研发的新型疫苗包括取代BCG的初免疫苗、增强BCG效果的加强疫苗、治疗性结核病疫苗。(1)取代BCG的初免疫苗:以基因重组的活疫苗为代表。基因重组的活疫苗通过将特定的基因导入BCG株内,使其表达结核分枝杆菌特异性抗原。以rBCG30为代表,该疫苗是已经进入Ⅰ期临床试验的第一个结核病新型疫苗,通过基因重组技术,使BCG株大量表达结核菌的重要保护性抗原Ag85B。(2)增强BCG效果的加强疫苗:以腺病毒或痘苗病毒为载体的疫苗属于该类疫苗,通过表达免疫优势区抗原,激活免疫应答;另一类加强疫苗是基因重组蛋白亚单位疫苗,是由2~3个结核分枝杆菌或BCG抗原优势区的抗原构成,引起的保护性免疫应答集中。但在体内滞留时间短,需采用佐剂[16]。结核分枝杆菌的免疫性保护抗原主要是分泌性蛋白,包括早期分泌 抗原靶-6(ESAT-6)、抗原 85 复 合 体(Ag85)、CFP10、MPT63、MPT64、热 休 克 蛋 白 HSP65、HSP70等。ESAT-6、Ag85是一些早期分泌抗原蛋白。近期一项研究显示以ESAT-6、Ag85和潜伏相关蛋白R2660C构建的H56疫苗,无论是在暴露前还是暴露后的预防中都表现出了良好的免疫效果[17]。R2660C在感染的早期和晚期均表达。在3种暴露前预防的小鼠模型中,H56对晚期感染的抑制效果要优于以ESAT-6、Ag85构建的H1疫苗及BCG疫苗。在结核菌潜伏感染的2种小鼠模型中,暴露后的H56接种能够显著降低疾病复发,并能显著降低细菌负担。(3)治疗性结核病疫苗:将灭活疫苗作为辅助治疗以缩短传统的化学治疗疗程,目前该类疫苗包括母牛分枝杆菌疫苗、草分枝杆菌菌苗和结核分枝杆菌多糖核酸等。
2006—2015年全球控制结核病计划中疫苗研发的主要目标是2010年有2个疫苗进入临床试验,2015年有一个安全有效的新型疫苗上市。
截止到2010年,已经有14个疫苗进入临床试验(表1),有6个结核病候选疫苗在临床前试验阶段,还有33个新一代候选疫苗在研发早期。
结核病疫苗的研发面临着许多挑战[16],如结核病疫苗的研发过程需要大量的资金投入,充实候选疫苗的产品线,同时建立大规模临床试验和生产能力,需要增强国家和社区对新型结核病疫苗需求的意识和支持等。
抗结核药物的研究
目前临床上使用的一线抗结核药物主要有异烟肼、利福平、吡嗪酰胺、乙胺丁醇、链霉素等,这些药物多数是在40多年前问世的,最晚的利福平也是在1965年问世的。结核病的治疗主要依赖化疗,但近40多年没有突破性新药问世,结核病化疗时间长,化疗方案复杂,同时结核分枝杆菌与艾滋病病毒双重感染,耐药结核病的产生使当前结核病防治陷入困境,亟需发展新的治疗药物。
新型抗结核药物工作组(The Working Group on New TB Drugs)制定的结核病药物的研发目标为:(1)缩短治疗疗程至2个月或更少;(2)有效地治疗耐多药结核病;(3)为结核菌潜伏感染者提供治疗服务。
目前处于临床试验阶段的新型抗结核药物包括[18]:一种是已经作为一线或二线结核病的治疗药物,包括利福霉素类、氟喹诺酮类和嗯唑烷酮类,另一种是具有全新抗结核作用机制的药物,包括硝基咪唑类、二芳基喹啉类、乙二胺四乙酸类和吡咯类。
目前处在临床试验阶段药物的研发进程见表2。
加替沙星和莫西沙星均属于喹诺酮类药物,目前正处于临床Ⅲ期的评价阶段。用于替换一线抗结核药物乙胺丁醇(加替沙星和莫西沙星)或异烟肼(莫西沙星),疗程从6~9个月可缩短为4个月。如果预期成功,提示这种方案将为缩短治疗疗程迈出重要一步[18]。OPC-67683和 PA-824均属于硝基咪唑类药物。PA-824目前正处于临床Ⅱ期的研究
阶段。PA-824在体外抑制活性试验中,对包括耐药菌株在内的多种结核分枝杆菌都表现出了较高的活性,它对目前临床使用的其他抗结核病药物没有表现出交叉耐药性,并对静止期的结核分枝杆菌表现出了体外抑制活性,是一个很有潜力的结核病治疗候选化合物[19]。TMC-207属于二芳基喹啉类药物,通过抑制ATP合成酶来发挥作用。SQ-109属于乙二胺四乙酸类药物,该化合物通过抑制细胞壁的合成来发挥作用。LL3858属于吡咯类药物,目前该药处于临床Ⅰ期评价阶段。
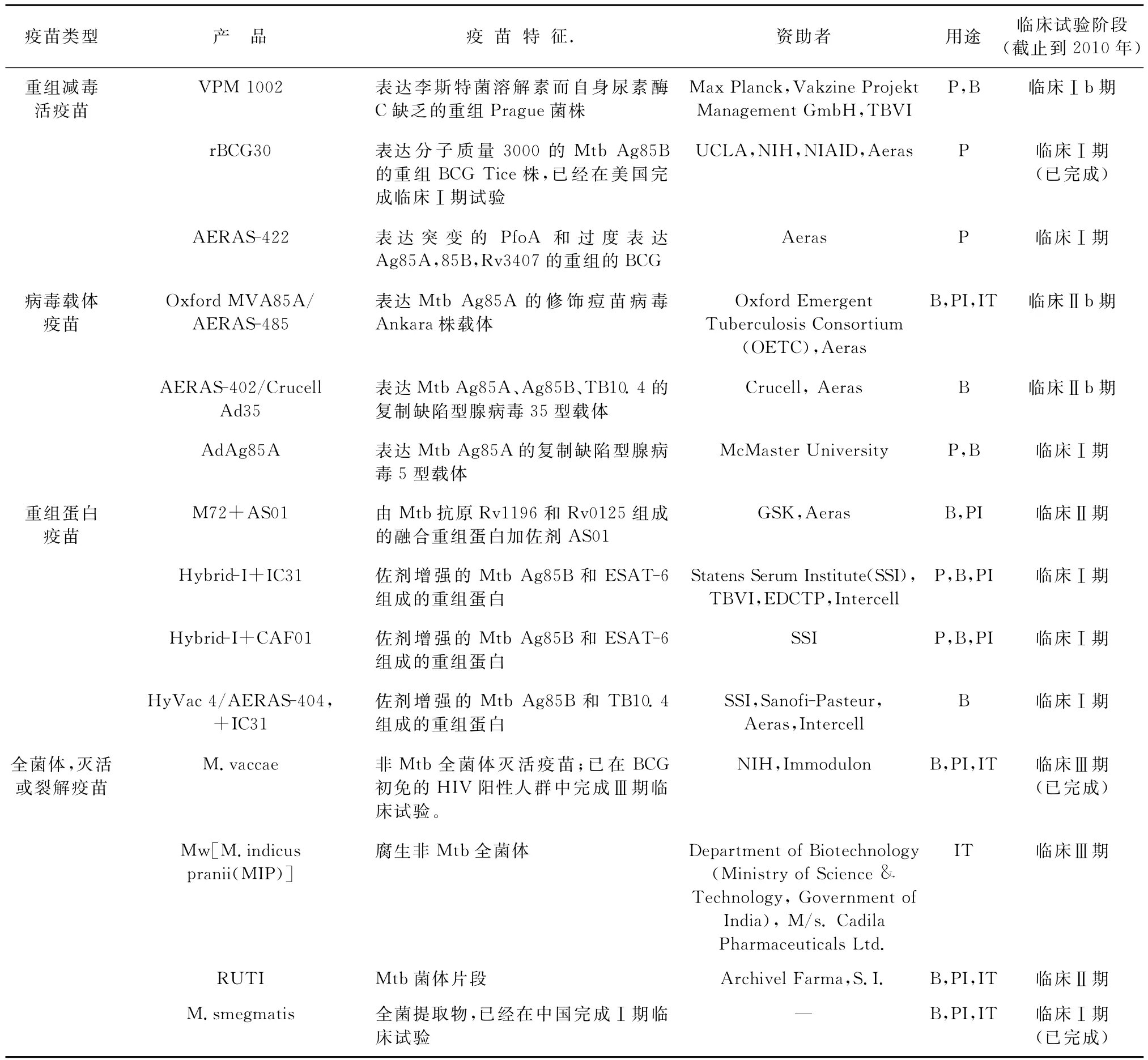
表1 临床试验阶段的疫苗
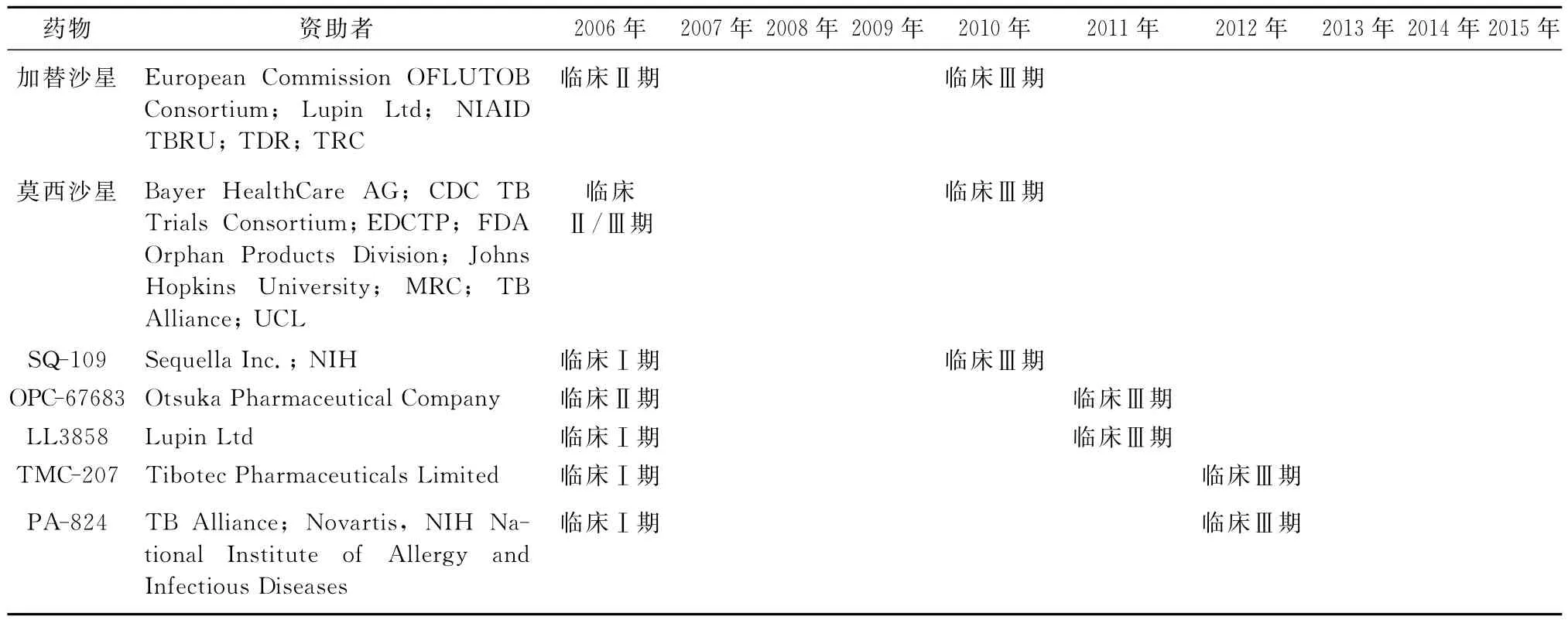
表2 临床试验阶段的药物2006—2015年的研发进程[25]
目前抗结核药物的研发过程同样也面临着重要的挑战:新药的研发成本投入非常高;临床试验耗时长;缺乏支持临床Ⅱ和Ⅲ期结核病药物试验的合格生物标记,也将使研发项目耗时较长、费用昂贵[18]。
结核病新型实验室诊断方法的研究
结核病的早期、特异性的诊断是控制结核病死亡率的重要前提之一。结核病的实验诊断的常规方法主要是痰涂片和痰培养。痰涂片镜检操作方便、廉价,但是阳性率较低,仅为30%~50%,其检出灵敏度为104~105/L,属于低灵敏度的方法[8]。荧光显微镜可以提高镜检的灵敏度,但是价格高,不适合基层使用。发光二极管(light-emitting diode,LED)显微镜价格优于现在的荧光显微镜,寿命长。Meta分析显示:LED显微镜的灵敏度比传统镜检方法高约10%[20]。同时该方法费用低,可广泛推广使用。
痰培养是诊断结核病的金标准,目前使用的培养基主要是固体罗氏培养基,需要4~6周的培养才能检测到细菌的生长,对患者的早期诊断非常不利。目前采用液体培养的方法阳性率高于固体培养约10%~20%,同时较固体培养缩短了2~3周。我国熊礼宽等[21]曾报道,分枝杆菌变色液体培养基阳性率高,污染率低,检出时间快。WHO推荐采用液体培养的方法用于艾滋病病毒感染者和病人合并肺结核的诊断。但是我国尚未全面推广使用,只是在部分地区开展试点工作。
随着分子生物学技术的发展,分子生物学的检测技术应用越来越广泛。目前分子生物学技术的检测方法包括DNA探针技术、聚合酶链反应(polymerase chain reaction,PCR)技术、DNA指纹图谱、DNA序列测定、DNA芯片技术等。其中PCR技术灵敏度在4%~80%之间波动,特异度为80%~100%[22]。该方法操作不严格易出现假阳性与假阴性。WHO目前推荐一种Cepheid Xpert的实验室诊断方法,该种方法是一种全自动核酸扩增试验,采用封闭的系统,2h即可获得结果,采用该检测方法可使耐药结核病患者的诊断阳性率提高3倍,在结核病和艾滋病高流行地区的确诊的TB/HIV患者数翻倍[23]。对5个检测点(秘鲁、阿塞拜疆、南非2个,印度)的1462例结核病的疑似患者进行检测[24],敏感度达到了97.6%(95%CI:96.2%~98.5%),特异度达到了98.0%(95%CI:96.6%~98.9%)[23]。但是由于该方法比较昂贵,限制了其在许多国家的推广使用。
据估计全球结核病患者中1/2由潜伏感染者发展而来,结核菌感染者的早期诊断同样是控制结核病的一项重要措施。目前各国致力于从结核分枝杆菌分离出的特异性抗原作为诊断试剂来识别结核分枝杆菌的早期感染。近年来,γ-干扰素(γ-IFN)释放试验(interferon-γrelease assays,IGRA)作为一种新型诊断结核感染的免疫学方法得到了越来越广泛的应用。该方法的设计原理是利用结核分枝杆菌特异性抗原会刺激致敏的淋巴细胞释放γ-IFN,利用酶联免疫吸附(ELISA)/酶联免疫斑点(ELISPOT)进行的γ-IFN的检测。ELISA检测抗原刺激后γ-IFN的含量,ELISPOT检测抗原刺激后产生γ-IFN的外周血单个核细胞数,根据斑点的数量来确定细胞分泌细胞因子的情况。从单细胞水平评价细胞免疫应答功能,从而判断结核分枝杆菌感染的情况。目前全血ELISA商品化的试剂盒有澳大利亚Cellestis公司的Quanti FERON-TB Gold(QFT-G)和 QuantiFERON-TB Gold In Tube(QFT-IT)。ELISPOT商品化的试剂盒是英国牛津公司的T-SPOT TB。
联合国的千年发展目标为到2015年结核病的发病率停止上升并逐渐下降;遏制结核病伙伴制定的相应的目标为到2015年,结核病患病率和死亡率在1990年基线上降低50%;到2050年,消除作为公共卫生问题的结核病。世界各国目前正朝着这个方向积极努力,希望随着各国政府承诺的增强,经费投入的增加,在结核病的诊断、治疗、预防等各个方面在未来都能取得突破,最终真正的实现一个无结核病世界的美好愿景。
[1] World Health Organization.Global tuberculosis control report 2010(WHO/HTM/TB/2010.7).Geneva:World Health Organization,2010.
[2] Cole ST,Brosch R,Parkhill J,et al.Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence.Nature,1998,393(6685):537-544.
[3] 刘洁,万康林.结核分枝杆菌基因组学和后基因组学研究进展.中国人兽共患病学报,2007,23(4):398-400.
[4] Sreevatsan S,Pan X,Stockbauer KE,et al.Restricted structural gene polymorphism in the Mycobacterium tuberculosis complex indicates evolutionarily recent global dissemination.Proc Natl Acad Sci U S A,1997,94(18):9869-9874.
[5] 熊志红,庄玉辉,李国利.差显技术分析结核杆菌H37Rv与H37Ra差异表达的基因.微生物学通报,2005,32(3):57-61.
[6] Brosch R,Gordon SV,Buchrieser C,et al.Comparative genomics uncovers large tandem chromosomal duplications in Mycobacterium bovis BCG Pasteur.Yeast,2000,17(2):111-123.
[7] 庄玉辉.结核分支杆菌基因组后时代的展望.中华结核和呼吸杂志,2001,24(7):391-393.
[8] 王陇德.结核病防治.北京:中国协和医科大学出版社,2004.
[9] Murray CJ,Lopez AD.Global mortality,disability,and the contribution of risk factors:Global Burden of Disease Study.Lancet,1997,349(9063):1436-1442.
[10] 邵凌云,翁心华,胡忠义,等.中国汉族人群结核易感相关基因多态性研究.中华传染病杂志,2004,22(5):302-305.
[11] 刘玮,张翠英,吴晓明,等.维生素D受体基因多态性与肺结核易感性的病例对照研究.中华流行病学杂志,2003,24(5):389-391.
[12] 刘志辉,罗一鲁,周琳,等.HLA-DR基因与中国南方汉族部分人群肺结核易感基因的研究.中华结核和呼吸杂志,2004,27(6):390-393.
[13] 刘玮,张芳,赵秋敏,等.甘露糖结合凝集素基因多态性与肺结核易感性的研究.中国热带医学,2006,6(3):387-389.
[14] Rodrigues LC,Diwan VK,Wheeler JG.Protective effect of BCG against tuberculous meningitis and miliary tuberculosis:a meta-analysis.Int J Epidemiol,1993,22(6):1154-1158.
[15] Colditz GA,Berkey CS,Mosteller F,et al.The efficacy of bacillus Calmette-Guerin vaccination of newborns and infants in the prevention of tuberculosis:meta-analyses of the published literature.Pediatrics,1995,96(1Pt 1):29-35.
[16] 季敏,章建康.遏制结核病全球合作伙伴组织及新型结核病疫苗研发现状和方向.国际生物制品学杂志,2011,34(2):97-103.
[17] Aagaard C,Hoang T,Dietrich J,et al.A multistage tuberculosis vaccine that confers efficient protection before and after exposure.Nat Med,2011,17(2):189-194.
[18] 吴小林.结核病药物研发的进展、挑战和展望.国外医药抗生素分册,2010,31(3):119-122.
[19] 康晓宇,高永清.临床开发中的新型抗结核药物.国际药学研究杂志,2009,36(3):230-233.
[20] Steingart KR,Henry M,Ng V,et al.Fluorescence versus conventional sputum smear microscopy for tuberculosis:a systematic review.Lancet Infect Dis,2006,6(9):570-581.
[21] 熊礼宽,杨应周,黄袆,等.一种新型快速检出分枝杆菌变色液体培养基的评价.中华检验医学杂志,2001,24(1):49.
[22] Abebe F,Holm-Hansen C,Wiker HG,et al.Progress in serodiagnosis of Mycobacterium tuberculosis infection.Scand J Immunol,2007,66(2-3):176-191.
[23] World Health Orangnization.WHO endorses new rapid tuberculosis test[EB/OL] .[2010-12-08] .http:∥www.who.int/mediacentre/news/releases/2010/tb _test _20101208/en/index.html
[24] Boehme CC,Nabeta P,Hillemann D,et al.Rapid molecular detection of tuberculosis and rifampin resistance.N Engl J Med,2010,363(11):1005-1015.

