颗粒显色指示技术快速检测结核分枝杆菌对吡嗪酰胺耐药性的价值
王冬敏 林健雄 彭东东 李进展 李耿聪 李鸿槟 陈蕊明
吡嗪酰胺是一种重要的一线抗痨药物,由于其可杀灭酸性巨噬细胞内的结核分枝杆菌(Mycobacterium tuberculosis,Mtb)和半休眠菌,可使结核病的复发率大大下降,在现代结核病控制策略中广泛应用于短程化疗方案,几乎100%的新发结核病患者开始治疗时都使用吡嗪酰胺,因此耐吡嗪酰胺的Mtb也越来越多,据文献[1]统计为5.8%~18.6%,特别是近年来吡嗪酰胺的耐药率明显上升,甚至有些国家和地区报道的吡嗪酰胺耐药率高达50.9%[2]。药物敏感度试验是实验室指导临床第一线科学用药的重要手段之一。大多数药敏试验都可以在pH中性的常规培养基上顺利进行,但吡嗪酰胺药敏试验例外,由于吡嗪酰胺仅在pH为5.5的酸性条件下才能转化为杀菌的吡嗪酸,而Mtb在酸性条件下生长很差,甚至不生长,从而导致吡嗪酰胺的敏感试验一直是实验室中的一个难题。过去吡嗪酰胺的敏感试验一直沿用酸罗氏法,但由于罗氏培养基中所含蛋白质对药物有吸附作用,且在酸性条件下,Mtb生长缓慢,甚至不生长,从而使酸罗氏法耗时长,需3~4周,而且结果不够稳定,可靠性差,已不能完全适应临床快速敏感试验的要求[3-4],因而目前我国的大多数结核病实验室没有常规开展吡嗪酰胺的药敏试验。国外经济发达国家通常使用BACTEC MGIT-960、BacT/ALERT 3D 仪器的快速培养方法,但成本昂贵,制约了其推广应用。为了更好地指导临床对吡嗪酰胺的使用,有必要研究开发一种准确、快速、廉价的吡嗪酰胺药敏试验方法,以解决这一长期困扰临床治疗的难题。本研究应用颗粒显色指示法测定102株Mtb的吡嗪酰胺耐药性,并与BACTEC MGIT-960法结果进行比较,现将结果报道如下。
材料和方法
一、材料
1.待测菌株:102株 Mtb临床分离株均选自汕头市结核病防治所2011年3—5月结核病患者的标本BACTEC MGIT-960初培养阳性菌株,经抗酸染色确认为抗酸杆菌,并经常规生化反应鉴定为Mtb。
2.细菌生长指示管(bacterial growth indicator tube,BGIT):含0.075g氧化还原指示颗粒,用于指示微生物的繁殖(专利申请号:201010242710.7),批号:20101026;通用增菌培养基:含有 Middlebrook7H9营养肉汤、牛血清白蛋白、触酶、多肽等特殊营养成分(注册号:沪食药监(准)2011第1400182号),为满足吡嗪酰胺药敏试验要求,通用增菌培养基的pH已调整至最佳(pH 6.0~6.1之间),批号:20101012;吡嗪酰胺药物:含量为2000μg/ml;由上海积彩医疗器械有限公司提供。
3.BACTEC MGIT-960吡嗪酰胺药敏专用分枝杆菌生长指示管、药敏试剂及960系统,由美国BD公司提供。
二、方法
对以上待测菌株同步进行颗粒指示显色法和BACTEC MGIT-960法吡嗪酰胺药敏实验,操作均在Ⅱ级生物安全柜中进行。
1.颗粒指示显色法:(1)取2支细菌生长指示管,在标签处标记标本号,其中1支标注为1/10参照,另1支标注为药敏管。(2)取1管4.9ml通用增菌培养基,用吸枪各精确吸取2ml培养液加入到细菌生长指示管中,余下含0.9ml培养液的管标注为稀释管。(3)吸0.1ml吡嗪酰胺药物加入药敏管,使药敏管中药物的最终浓度为100μg/ml。(4)菌液标本取自BACTEC MGIT-960仪器提示阳性不超过24h的培养管,用吸枪反复吹打均匀后,吸取0.1ml菌液加入稀释管,经充分混匀后吸0.1ml稀释液加入1/10参照管;吸0.1ml原菌液加入药敏管。(5)接种后置37℃培养,每天取出观察生长指示管。当参照管出现紫色颗粒时判断结果,药敏管无紫色颗粒或紫色颗粒少于对照管判定为敏感,药敏管中紫色颗粒多于或等同于参照管时判定为耐药。结果判定方法见图1。

图1 吡嗪酰胺的药敏试验结果判定示意图
2.BACTEC MGIT-960法吡嗪酰胺药敏实验按BACTEC MGIT-960操作手册进行,由仪器读取报告结果。
三、统计学分析
统计结果用SPSS 13.0统计软件进行分析,计量数据以±s表示,采用t检验,以P<0.05为有统计学意义。
结 果
一、颗粒显色指示法与BACTEC MGIT-960法检测吡嗪酰胺药敏结果比较(表1)
两种方法检测结果均为敏感67株,均为耐药30株,总符合率为95.1%(97/102)。5株菌株两种方法检测结果不符,其中3株颗粒显色指示法测定为敏感,BACTEC MGIT-960法测定为耐药;2株为颗粒显色指示法耐药,BACTEC MGIT-960法检测为敏感。如以BACTEC MGIT-960法测定吡嗪酰胺耐药性结果为考核标准,则颗粒显色指示法检测吡嗪酰胺耐药性的敏感度为90.9%(30/33),特异度 为 97.1% (67/69),阳 性 预 测 值 为 93.8%(30/32),阴性预测值为95.7%(67/70),准确性为95.1%(97/102)。
二、颗粒显色指示法与BACTEC MGIT-960法检测吡嗪酰胺药敏报告时间比较
结果显示颗粒显色指示法出现阳性结果的最早时间是7d,最晚时间为14d,平均(9.47±1.66)d;BACTEC MGIT-960法出现阳性结果的最早时间是6d,最晚时间为13d,平均(9.33±1.77)d,两者差异无统计学意义(t=0.573,P>0.05)。详见表2。

表1 颗粒显色指示法与BACTEC MGIT-960法检测吡嗪酰胺药敏结果比较(株)
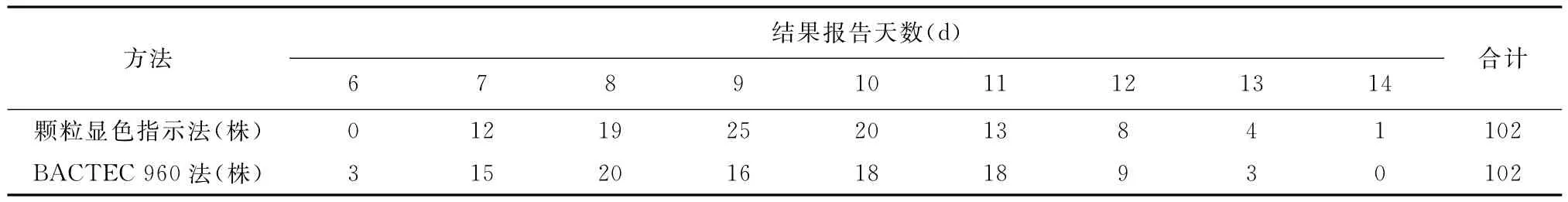
表2 颗粒显色指示法与BACTEC MGIT-960法检测吡嗪酰胺药敏报告时间比较
讨 论
吡嗪酰胺是治疗结核病最有效的一线药物中的重要药物,该药物于1940年由Hall等在合成氨基吡啶过程中作为一种中间化合物首次被合成[5],它的抗结核菌活性于1952年被Yeager等发现。但其与利福平和异烟肼联用治疗结核病显著缩短化疗时间的独特作用是在其用于治疗结核病29年之后的1981年才见报道[6]。吡嗪酰胺用于治疗结核病至今已有半个世纪,其抗菌机制为:吡嗪酰胺是一种烟酰胺类似物,与异烟肼相似也是一种抗Mtb的原药,但其发挥作用所要求的环境不同,吡嗪酰胺需要在酸性环境才表现抗菌活性且最低抑菌浓度(MIC)与pH值在7.0以下存在很好的正相关性[7]。吡嗪酰胺通过被动扩散进入Mtb细胞内,在Mtb细胞内由吡嗪酰胺酶(PZase)将其转化为具有抗Mtb活性形式的吡嗪酸,所以PZase活性对吡嗪酰胺表现抗Mtb活性是必需的,众多的研究结果支持pncA基因的突变造成PZase活性降低或丧失是Mtb产生对吡嗪酰胺耐药的主要原因,随着研究的深入,亦有很多研究结果表明,并不是所有耐药菌株都存在pncA基因突变,大约70%的吡嗪酰胺耐药菌株存在pncA基因突变,而且pncA基因存在突变但PZase还保持活性,因而目前通过基因检测的手段检测吡嗪酰胺耐药性的方法尚未成熟[8]。
目前,检测吡嗪酰胺耐药性的方法主要有用罗氏培养基的绝对浓度法药敏试验、快速培养仪检测法和分子生物学检测技术。由于吡嗪酰胺在体外酸性环境中才能表现出抗菌活性,而Mtb在酸性环境下生长不良,使得常规方法测定吡嗪酰胺的耐药性存在一定困难,而且耗时长、准确性差。从而导致吡嗪酰胺的敏感试验一直是实验室中的一个难题,中国防痨协会2009年出版的《结核诊断实验室检验规程》里亦没有颁布吡嗪酰胺的药敏试验方法。分子生物学检测技术快速,但操作繁琐,且突变检出率偏低,pncA基因检测法在3种方法中最快速,可弥补常规药敏试验的不足,但国内王金河等[4]的研究报道与酸罗氏法的符合率为75%,符合70%左右的吡嗪酰胺耐药株存在pncA基因突变这一耐药分子机制,但仍有30%左右的菌株不能用此方法正确地鉴定出。BACTEC MGIT-960快速培养仪具有美国FDA认证的一线抗结核药物药敏试验,在发达国家通常作为标准方法,但其吡嗪酰胺耐药性测定需要专用的培养基和配套试剂,费用特别昂贵,价格几乎相当于其他4种一线药物的总和,限制了它的推广应用。因此,快速、简便、灵敏的吡嗪酰胺耐药性测定技术研究是国内外学者所关注的课题,为了更好的指导临床对吡嗪酰胺的使用,有必要研究开发一种准确、快速、廉价的吡嗪酰胺药敏试验方法。国内匡铁吉教授在20世纪80年代研制的匡氏琼脂培养基吡嗪酰胺药敏试验,能在3周左右报告结果,与酸罗氏法符合率为100%[4];上海市结核重点实验室研究了吡嗪酰胺耐药性Mtb的噬菌体检测技术,可以在3d内报告结果,与酸罗氏法比较准确性达到91.7[9],因对比方法的不同,本研究未与上述方法进行比较。
建立Mtb的吡嗪酰胺耐药性的方法,必须解决2个关键问题,一是吡嗪酰胺作用所需的酸性环境与Mtb在酸性环境下生长不良的问题,二是如何快速简便指示细菌生长。本研究使用的手工操作的颗粒显色指示液体培养系统,通用液体培养基含有营养丰富Middlebrook7H9营养肉汤和牛血清白蛋白、触酶、多肽等特殊营养成分,并且使用0.1mol的盐酸调节pH至6.0~6.1之间,可以很好地解决Mtb生长和吡嗪酰胺作用的问题。细菌生长指示管(BGIT),采用新型的氧化还原反应显色指示剂,当有活的Mtb存在,则颗粒还原为紫红色,显色快,长时间保持颜色稳定不变,大大提高了结果的可靠性,具有简便、快速、准确的优点,可为临床及时提供结果。本研究中颗粒显色指示法最早报告结果的时间比BACTEC MGIT-960法稍晚一天左右,主要集中在第8、9、10天出结果,二者的生长速度经统计学分析差异无统计学意义,而且其耗材成本略高于酸罗氏法而远远低于BACTEC MGIT-960法。总之,本研究利用颗粒显色指示法检测Mtb临床分离株对吡嗪酰胺的耐药性,跟BACTEC MGIT-960法比较,有较高的敏感度和特异度,结果报告时间差异无统计学意义,是一种快速、敏感、操作简便,与标准方法符合率高的药敏试验方法。鉴于实验例数较少,笔者期盼着通过不同研究者的反复论证和不同实验室的反复试验,最终能为吡嗪酰胺的耐药性提供一种快速检测手段。
[1] Blanchard JS.Molecular mechanisms of drug resistance in Mycobacterium tuberculosis.Annu Rev Biochem,1996,65:215-239.
[2] Lu PL,Lee YW,Peng CF,et al.The decline of high drug resistance rate of pulmonary Mycobacterium tuberculosis isolates from a southern Taiwan medical centre,1996—2000.Int J Antimicrob Agents,2003,21(3):239-243.
[3] 金嘉琳,翁心华.分枝杆菌对吡嗪酰胺耐药机制的研究进展.国外医学微生物学分册,2004,27(3):31-33.
[4] 王金河,裴宁,匡铁吉,等.结核分枝杆菌吡嗪酰胺敏感试验方法的比较研究.第三军医大学学报,2004,26(10):932-933.
[5] Zhang Y,Scorpio A,Nikaido H,et al.Role of acid pH and deficient efflux of pyrazinoic acid in unique susceptibility of Mycobacterium tuberculosis to pyrazinamide.J Bacteriol,1999,181(7):2044-2049.
[6] Scorpio A,Lindholm-Levy P,Heifets L,et al.Characterization of pncA mutations in pyrazinamide-resistant Mycobacterium tuberculosis.Antimicrob Agents Chemother,1997,41(3):540-543.
[7] Salfinger M,Heifets LB.Determination of pyrazinamide MICs for Mycobacterium tuberculosis at different pHs by the radiometric method.Antimicrob Agents Chemother,1988,32(7):1002-1004.
[8] 敖军平,陈季武,习兵霞,等.结核分枝杆菌耐吡嗪酰胺机制研究进展.国外医药抗生素分册,2006,27(3):97-99.
[9] 敖军平,陈季武,胡忠义,等.吡嗪酰胺耐药性结核分枝杆菌的噬菌体检测技术研究.中华结核和呼吸杂志,2006,29(9):625-628.

