地塞米松和1,25-(OH)2 D3对EC1细胞增殖和细胞周期的影响*
张 震,付 聪,王冰一,窦蒙蒙,赵继敏,黄幼田,赵明耀#
1)郑州大学临床医学系郑州450001 2)郑州大学基础医学院病理生理学教研室郑州450001
(2010-12-31收稿 责任编辑 李沛寰)
地塞米松(dexamethasone,DEX)和活性维生素1,25-(OH)2D3是临床和实验中使用的肿瘤诱导分化剂,分属类固醇类激素和非类固醇类激素两大家族,前者的受体是在细胞质内,后者的受体是在细胞核内。它们作为配体在转录因子的基因表达调控上有明显的不同。作者观察了这2种药物单独及联合使用对食管鳞状细胞癌EC1细胞的增殖与细胞周期的影响,报道如下。
1 材料与方法
1.1 试剂和细胞 RPMI 1640培养基(美国Gibco公司),胎牛血清(天津 TBD 公司),DEX、1,25-(OH)2D3、RNase、MTT 和 DMSO(美国 Sigma公司),EC1细胞(郑州大学基础医学院病理生理学教研室惠赠)。DEX和1,25-(OH)2D3均采用无水乙醇溶解,配置成10-4mol/L储存液,使用时用培养液稀释成相应的工作浓度。
1.2 细胞培养和分组 EC1细胞在含体积分数为10% 胎牛血清、100 U/mL青霉素和100 mg/L链霉素的RPMI 1640完全培养基中,置于37℃、体积分数5%CO2及饱和湿度条件下培养。待细胞汇合至70%~80%时,用胰蛋白酶消化,制备成单细胞悬液。①溶剂对照组:体积分数0.1%的无水乙醇作用EC1细胞。②DEX组:用10-7mol/L DEX处理EC1 细胞。③1,25-(OH)2D3组:用 10-7mol/L 1,25-(OH)2D3处理EC1细胞。④联合用药组:10-7mol/L DEX 和 10-7mol/L 1,25-(OH)2D3处理 EC1细胞。各组细胞经药物作用48、72和96 h后,在倒置显微镜下观察并拍照。
1.3 EC1细胞增殖抑制实验 采用MTT法。将制成的单细胞悬液,按1.5×104L-1的密度分别接种到3块96孔培养板中,培养24 h;按1.2分组分别加药处理细胞,每组设3个复孔,再分别培养48、72和96 h;每孔加入5 g/L的MTT溶液20μL,继续培养4 h;吸去上清,加入200μL DMSO,室温下振荡10 min使紫色结晶全部溶解,在96孔酶标仪上以空白对照孔调零,570 nm处读取吸光度(A)值。
1.4 EC1细胞周期检测 应用流式细胞仪法。于3块6孔培养板每孔接种约2.5×105个细胞,无血清培养基培养24 h,弃去无血清培养基,PBS洗2遍,加入新RPMI 1640完全培养基,并进行实验分组,分别作用48、72和96 h。将各组细胞用2 g/L胰蛋白酶消化,1 000 r/min离心5 min,弃去上清;用PBS洗2遍,离心后弃上清,加入体积分数为70%的冰乙醇固定,4℃过夜;上机前1 000 r/min离心5 min,弃去乙醇,PBS洗3遍;加入1 mL PBS制成细胞悬液,加入5 g/L RNaseA 10μL,室温放置1 h;调整细胞浓度为1×106/管,加入100 mg/L碘化丙啶液50μL,避光30 min,上机每个样本检测10 000个细胞周期的改变,计算处于G0/G1期EC1细胞比率。
1.5 统计学处理 应用SPSS 10.0进行分析。采用2×2×3析因设计的方差分析比较各组EC1细胞增殖与细胞周期的差异,检验水准α=0.05。
2 结果
2.1 DEX和1,25-(OH)2D3及联合用药对 EC1细胞形态的影响 与溶剂对照组比较,药物作用96 h后,DEX组、1,25-(OH)2D3组及联合用药组 EC1细胞生长缓慢,均未见细胞死亡现象(图1)。
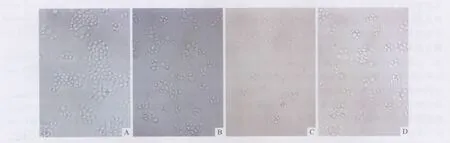
图1 药物作用96 h各组EC1细胞的形态(×200)A:溶剂对照组;B:DEX组;C:1,25-(OH)2 D3组;D:联合用药组。
2.2 DEX 和1,25-(OH)2D3对 EC1细胞增殖和细胞周期G0/G1期的影响 见表1。
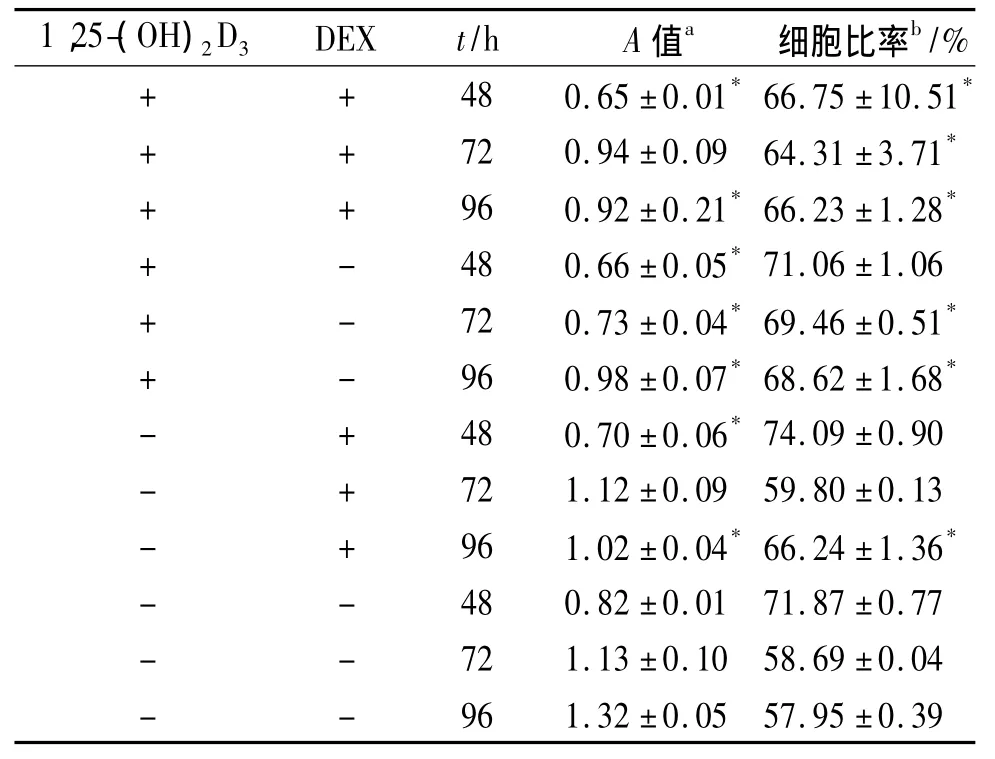
表1 DEX 和1,25-(OH)2D3对 EC1细胞增殖和细胞周期G0/G1期的影响(n=3)
3 讨论
根据肿瘤的正负信号调控理论,细胞癌变是因为调控细胞生长正信号分子过多而负信号分子过少,导致肿瘤细胞出现高增殖、低分化及低凋亡等生物学特征。而肿瘤的诱导分化治疗,是在诱导分化剂的作用下,使肿瘤细胞被诱导,重新向正常细胞方向分化,表现为细胞生长、形态、基因表达和生物标志物接近正常细胞状态。地塞米松通过细胞质内受体发挥作用,体内大多数组织存在地塞米松受体,因此地塞米松的作用非常广泛。临床上应用大剂量的糖皮质激素抗炎、抗过敏、抗免疫排斥反应和抗休克[1]。研究[2-3]表明糖皮质激素与肿瘤有着密切的关系,该激素对肝癌、卵巢癌等肿瘤细胞有抑制增殖和诱导分化作用。1,25-(OH)2D3除了具有钙磷代谢的功能之外,还是一种细胞周期调节剂,影响细胞的增殖、分化和凋亡,在前列腺癌、结肠癌等肿瘤治疗中表现出明确的诱导分化作用[4-5]。
作者采用1,25-(OH)2D3单独或与 DEX联合作用于EC1细胞,均显示对EC1细胞增殖的抑制效果。相关研究[6-9]显示,在细胞内 1,25-(OH)2D3首先与高亲和力的特异性受体VDR发生结合,与配体结合的VDR再与视黄酸X受体形成异源二聚体后,即可与靶基因上游的维生素D反应元件结合形成转录调控复合体,从而激活或抑制下游靶基因的转录、表达,从而调控 p53、pRb、p21、p27等肿瘤相关基因的表达。而糖皮质激素产生的抑制增殖,使细胞周期阻滞在G0/G1期的信号是通过p21/WAF1的表 达 完 成 的[10]。该 研 究 结 果 显 示,1,25-(OH)2D3单独或与DEX联合将EC1细胞周期阻滞于G0/G1期,并且2种药物在这两个作用上具有交互效应,提示这2药可能均通过p21/WAF1而发挥细胞周期G0/G1期阻滞作用。进一步探讨其中机制有助于提高细胞诱导分化剂抗肿瘤效应。
[1]杨国兴,苏永华.糖皮质激素与肿瘤的关系[J].中国民族民间医药,2009,18(8):3
[2]陈庆强,黄嘉瑜,陈力舟.地塞米松在晚期肝癌中的临床应用[J].中华现代中西医杂志,2004,2(3):265
[3]徐明娟,方国恩,崔英,等.地塞米松对人卵巢癌细胞糖皮质激素受体的调节[J].上海医学,2003,26(1):53
[4]辛星,万献尧,毕丽岩.维生素D3及其受体的临床意义[J].医学与哲学,2010,31(4):44
[5]尹贻贞,刘兆鹏.活性维生素D3的抗肿瘤信号转导作用[J].生命的化学,2009,29(4):552
[6] Swami S,Raghavachari N,Muller UR,et al.Vitamin D growth inhibition of breast cancer cells:gene expression patterns assessed by cDNA microarray[J].Breast Cancer Res Treat,2003,80(1):49
[7] Wang QM,Jones JB,Studzinski GP.Cyclin-dependent kinase inhibitor p27 as a mediator of the G1-S phase block induced by 1,25-dihydroxyvitamin D3 in HL60 cells[J].Cancer Res,1996,56(2):264
[8] Liu M,Lee MH,Cohen M,et al.Transcription activation of the Cdk inhibitor p21 by vitamin D3 leads to the induced differentiation of the myelomonocytic cell line U937[J].Genes Dev,1996,10(2):142
[9] van den Bemd GJ,Pols HA,van Leeuwen JP.Antitumor effects of 1,25-dihydroxyvitamin D3 and vitamin D3 analogs[J].Curr Pharm Des,2000,6(7):717
[10]Park JH,Oh EJ,Choi YH,et al.Synergistic effects of dexamethasone and genistein on the expression of Cdk inhibitor p21WAF1/CIP1 in human hepatocellular and colorectal carcinoma cells[J].Int J Oncol,2001,18(5):997

