复方大青叶注射液对体外培养HT-H9细胞CXCR4启动子活性的影响*
冷 弘,刘慧涛,臧玉翠,马云云,李 敏,靳 静,赵国强#
1)洛阳职业技术学院免疫学与病原生物学教研室洛阳471000 2)南阳油田总医院消化肾病科南阳473132 3)郑州大学基础医学院微生物学与免疫学教研室郑州450001 4)河南省职工医学院微生物学与免疫学教研室郑州451191
(2011-04-24收稿 责任编辑 王 曼)
大青叶是我国传统中药,属于十字花科草本植物,味苦、性寒,具有清热、解毒和凉血之功效,所含化学成分有靛蓝、靛玉红、色氨酮、3-羟苯基喹唑酮及有机酸类等。大青叶具有抗炎抗病毒和提高免疫力等作用[1],在抗流感、柯萨奇、乙型脑炎、单纯疱疹及扁平疣等病毒方面效果显著[2-6]。获得性免疫缺陷综合征(AIDS)是由人类免疫缺陷病毒(HIV)所引起的传染性疾病,在病毒感染过程中,CD4+T细胞是被攻击的主要靶细胞,而 CXCR4则是HIV感染CD4+T细胞的关键辅助受体[7]。近年来,以辅助受体为靶点的抗AIDS药物成为一个新的药物设计目标,在HIV感染的早期阶段起重要作用。作者以CXCR4启动子为靶点,构建其荧光素酶报告载体,转染人T淋巴细胞系HT-H9细胞,观察大青叶注射液对转染细胞表面CXCR4基因启动子活性的影响,为复方大青叶注射液在抗AIDS方面的应用提供实验依据。
1 材料与方法
1.1 材料 人T淋巴细胞系HT-H9细胞株购自中国典型培养物保藏中心。GloMax®96微孔发光检测仪、pGEM-T Easy克隆载体、荧光素酶报告基因载体 pGL4.17、4 ×dNTP、X-gal、IPTG、E4550 荧光素酶检测试剂盒购自Promega公司;T4 DNA连接酶、Taq DNA聚合酶、限制性内切酶 KpnⅠ、NheⅠ、Marker DL2000均购自TaKaRa公司;DNA提取试剂盒、胶回收试剂盒、小量质粒提取试剂盒购自Qiagen公司;G418、脂质体购自Invitrogen公司;复方大青叶注射液由山东华信制药集团股份有限公司生产,批号09081002,规格2 mL/支。
1.2 目的基因的克隆及鉴定 按照GenBank中 发表的FJ642475 CXCR4启动子序列设计引物,分别加入KpnⅠ和NheⅠ酶切位点,上游引物:5’-CGG TACCAAGCACTATTCGCGAATTGGTTAC-3’,下游引物:5’-TGCTAGCGGTAACCGCTGGTTCTCCAGA-3’。引物由上海生工生物公司合成。扩增产物大小为876 bp。取健康志愿者静脉血,Ficoll密度梯度离心法分离外周血单个核细胞,提取人基因组 DNA。PCR扩增体系:10×buffer 5μL,上、下游引物各0.5 mL,高保真 Taq酶 2 U,4×dNTP 2 μL,人基因组DNA 2μL,去离子水补足50μL;反应条件:95℃预变性3 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 40 s,循环25次;72℃延伸5 min。15 g/L琼脂糖凝胶电泳,验证片段大小。扩增产物纯化后直接与pGEM-T Easy载体进行连接,16℃连接过夜,转化感受态细菌DH5α,筛选阳性克隆,抽提重组质粒pGEM-T-CXCR4,经PCR和双酶切消化鉴定。
1.3 重组报告载体的构建 酶切报告基因载体pGL4.17和重组质粒pGEM-T-CXCR4,得到线性化的载体与目的基因,胶回收双黏片段,采用T4 DNA连接酶进行连接,将连接产物转化感受态细菌DH5α,接种于含氨苄的LB平板,筛选阳性菌落,获得阳性报告载体pGL4.17-CXCR4。经PCR和双酶切鉴定,并进一步测序确证。
1.4 细胞转染 用含体积分数10%胎牛血清的RPMI 1640培养基培养HT-H9细胞,转染前以3×105个/孔接种于24孔板上,用脂质体法分别将质粒pGL4.17及 pGL4.17-CXCR4转入 HT-H9细胞,于37℃、体积分数5%CO2和饱和湿度下培养,经800 mg/L G418筛选2周获得稳定转染细胞株,然后在200 mg/L G418压力下扩大培养。
1.5 实验分组 复方大青叶注射液作为成药,其原液含生药质量浓度为1 000 g/L,根据其成人推荐临床用量(2~4 mL/次,1~2次/d)折算出细胞培养对应的等效剂量,按照成人60 kg体质量折算,用注射用水稀释,分高剂量与低剂量,换算后细胞培养的剂量分别为100 mg/L和200 mg/L。分别以用高、低剂量复方大青叶注射液处理的转染细胞为高、低剂量实验组,以未加任何处理的转染细胞为空白对照组,以注射用水处理的转染细胞作为注射水对照组,同时以未转染的HT-H9细胞作为未转染对照组。每组各设10个复孔,在相应条件下处理24 h后进行荧光素酶活性测定。
1.6 荧光素酶活性检测 收集各组细胞,离心去培养液,PBS洗涤后收集细胞,按照E4550荧光素酶检测试剂盒操作说明,每孔加入150μL Cell Culture Lysis Reagent裂解细胞,室温作用15 min,吸取20 μL裂解后的液体至96孔板,用GloMax96微孔发光检测仪检测各组荧光素酶荧光值。每孔重复测3次,取平均值作为该孔细胞荧光素酶活性值。
1.7 统计学处理 用 SPSS 13.0处理数据,5组荧光素酶活性的比较采用单因素方差分析和LSD-t检验,检验水准 α =0.05。
2 结果
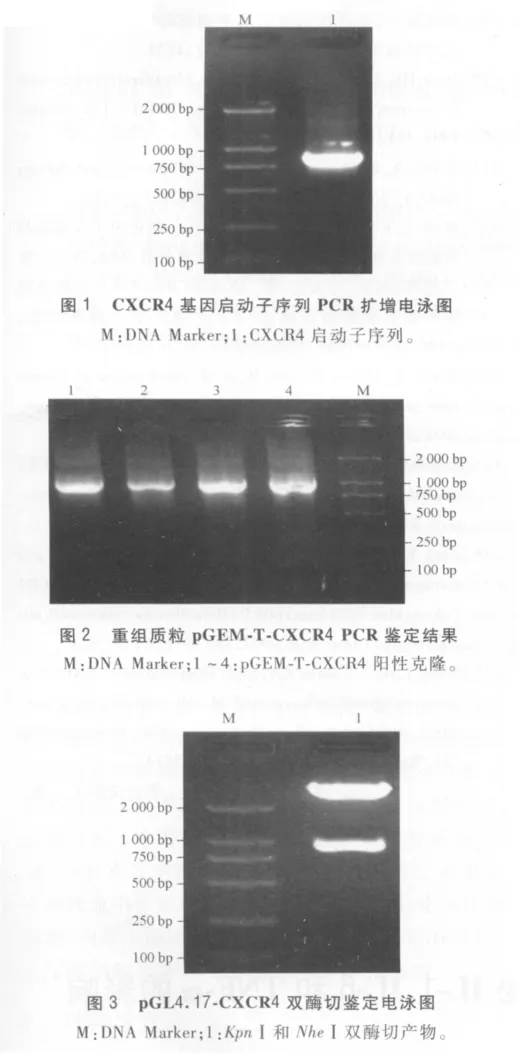
2.1 重组质粒p GEM-T-CXCR4的鉴定 CXCR4启动子序列的扩增产物琼脂糖凝胶电泳显示扩增片段与预期相符(图1)。将扩增产物插入pGEM-T Easy载体,转化宿主菌,获得阳性克隆,提取质粒进行PCR鉴定,电泳结果显示重组质粒大小与计算理论值大小一致(图2)。
2.2 p GL4.17-CXCR4的鉴定 将CXCR4启动子序列亚克隆入 pGL4.17载体,筛选阳性克隆采用KpnⅠ/NheⅠ双酶切鉴定,电泳结果符合预期大小,证实启动子序列正确插入(图3)。测序结果证明重组的pGL4.17-CXCR4序列与设计的寡核苷酸序列完全一致。
2.3 各组细胞荧光素酶活性检测 见表1。

表1 各组CXCR4荧光素酶活性检测结果
3 讨论
复方大青叶注射液属于中成药,以大青叶为主,辅以金银花、羌活、拳参、大黄配制而成,其药物活性成分及作用靶点众多,抗病毒效应的作用机制也十分复杂,是常用的清热解毒类中药。在已有的大青叶抗病毒研究中,刘盛等[2]发现大青叶注射液对流感病毒有直接抑制作用;李小青等[8]发现大青叶注射液对柯萨奇病毒引起的小鼠病毒性心肌炎效果明显,能够有效改善和保护心肌细胞;乔凤霞[9]采用大青叶注射液治疗单疱病毒性角膜炎,疗效显著;高巍[4]自制乙脑合剂(大青叶、石膏、知母等)联合西药治疗重症乙脑,疗效优于单纯西药治疗。上述研究结果表明大青叶注射液在抗病毒方面作用广泛。
CXCR4与CCR5属于趋化因子受体家族成员,与相应配体结合参与体内多种生理病理进程(如白细胞趋化、免疫调节及新生血管形成),参与细胞增殖和代谢等。CXCR4与CCR5是HIV-Ⅰ感染CD4+T细胞的关键辅助受体[10],在HIV-Ⅰ进入靶细胞过程中起重要作用。辅助受体拮抗剂的开发成为抗AIDS治疗的重大突破[11]。目前已有的 CXCR4拮抗剂中,AMD070正处于Ⅱ期临床研究阶段,KRH-1636在阻断HIV-Ⅰ的复制方面效果明显[12]。既然辅助受体的封闭能够达到阻止HIV感染及其在细胞间的传播作用,下调二者的表达理论上应能够阻止HIV入侵宿主细胞,达到有效防治AIDS的目的[13]。作者通过复方大青叶注射液对体外培养HT-H9细胞中CXCR4启动子活性作用的观察,了解其是否能够通过作用于CXCR4启动子,下调CXCR4蛋白的表达,进而发挥抗AIDS活性。
作者首先构建了含人CXCR4启动子的荧光素酶表达载体 pGL4.17-CXCR4,以其转染 HT-H9细胞,测定荧光素酶活性,以此来观察CXCR4启动子的表达。结果显示,空白对照组荧光素酶平均值均大于15 000,远高于未转染对照组,说明载体构建成功,且启动子调控后续基因表达,荧光素酶基因得以激活,检测荧光素酶活性可以代表CXCR4启动子活性。复方大青叶注射液高剂量实验组和低剂量实验组的荧光素酶荧光值明显低于空白对照组,提示复方大青叶注射液可以降低体外培养的HT-H9细胞CXCR4启动子活性,减少CXCR4启动子的表达,具有潜在的抗HIV-Ⅰ的作用。
在肿瘤研究领域,2001年 Muller等[14]首次报道CXCR4和肿瘤转移有关,随后越来越多的研究[15-17]表明CXCR4与多种肿瘤迁移、侵袭和转移过程密切相关。因此,复方大青叶注射液是否能通过降低CXCR4的表达,以达到抑制肿瘤生长以及减少转移的目的,也值得进一步探讨。
总之,复方大青叶注射液作为一种毒副作用小、价格低廉的传统中药,深入研究其作用机制,充分发挥其优势,在AIDS和肿瘤的防治上必将有非常广阔的发展前景。
[1]张淑杰,赵红,顾定伟,等.大青叶水煎剂对小鼠细胞免疫功能的体外研究[J].中国公共卫生,2003,19(9):1091
[2]刘盛,陈万生,乔传卓,等.不同种质板蓝根和大青叶的抗甲型流感病毒作用[J].第二军医大学学报,2000,21(3):204
[3]刘钊,杨占秋,肖红.中药大青叶有效单体抗柯萨奇病毒作用[J].中南民族大学学报:自然科学版,2009,28(2):41
[4]高巍.中西医结合治疗重症乙型脑炎43例[J].陕西中医,2002,23(2):116
[5]喻淑庆,陈湘漪,余凌.大青叶提取物抗单纯疱疹病毒Ⅱ型的体外实验研究[J].医药导报,2008,27(4):394
[6]朱玉双,孙步民,陈莉.大青叶汤治疗扁平疣100例[J].中医外治杂志,2005,14(2):23
[7] Bleul CC,Wu L,Hoxie JA,et al.The HIV coreceptors CXCR4 and CCR5 are differentially expressed and regulated on human T lymphocytes[J].Proc Natl Acad Sci USA,1997,94(5):1925
[8]李小青,张国成,许东亮,等.黄芪和大青叶治疗小鼠病毒性心肌炎的对比研究[J].中国当代儿科杂志,2003,5(5):439
[9]乔凤霞.大青叶注射液治疗单疱病毒性角膜炎[J].现代中西医结合杂志,2002,11(13):1224
[10]Deng HK,Liu R,Ellmeier W,et al.Identification of a major co-receptor for primary isolates of HIV-1[J].Nature,1996,381(6584):661
[11]Wilkin A,Feinberg J.New targets in antiretroviral therapy 2006[J]Curr Opin HIV AIDS,2006,1(5):437
[12]廖绍兰,王平.新的抗艾滋病药物——趋化因子受体拮抗剂的研究进展[J].国外医药:抗生素分册,2008,29(2):58
[13]卫艳萍,冯龙,马云云,等.以人 CCR5启动子为靶的药物筛选方法的初步建立[J].生物医学工程学杂志,2009,26(5):1043
[14]Muller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50
[15]Sun X,Cheng G,Hao M,et al.CXCL12/CXCR4/CXCR7 chemokine axis and cancer progression[J].Cancer Metastasis Rev,2010,29(4):709
[16]Arya M,Ahmed H,Silhi N,et al.Clinical importance and therapeutic implications of the pivotal CXCL12-CXCR4(chemokine ligand-receptor)interaction in cancer cell migration[J].Tumor Biol,2007,28(3):123
[17]Wang J,He L,Combs CA,et al.Dimerization of CXCR4 in living malignant cells:control of cell migration by a synthetic peptide that reduces homologous CXCR4 interactions[J].Mol Cancer Ther,2006,5(10):2474