刺五加注射液致敏性物质筛选的初步研究
冯宇飞,王艳宏,邢希旺,吕邵娃,刘筱清,李永吉
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
刺五加注射液具有扩张血管、增加冠状动脉血流量、减少心肌耗氧量、降低血黏度、改善血液循环、提高机体免疫力和应激功能等功效[1],并有良好的镇静作用,能明显地改善睡眠、增进食欲,还能清除氧自由基、提高人体过氧化物歧化酶、促进蛋白质合成和组织修复。临床用于治疗短暂性脑缺血发作、脑动脉硬化、脑血栓形成和脑栓塞、冠心病、心绞痛、神经衰弱、更年期综合征、颈椎病和糖尿病下肢血管病变等[2-3]。随着临床应用的日益广泛,对其所致的各种不良反应屡有报道,严重的可导致过敏性休克[4]。因此,查明刺五加注射液过敏原因,筛选出刺五加注射液的致敏物质,是解决刺五加注射液安全性的根本所在。本研究采用体内外方法同时对刺五加注射液的过敏性进行了评价,并对刺五加注射液的致敏部位进行了初步筛选,为本课题组的后续实验奠定基础。
1 材料
1.1 药品与试剂
临床有过敏反应的刺五加注射液(批号20100309、20100702、20100907);弗氏完全佐剂(sigma公司);弗氏不完全佐剂(sigma公司);生理盐水(哈尔滨三联药液有限公司,批号101124A5);组胺二盐酸盐(广州市齐云生物技术有限公司);Pereoll分离液(Amresco公司);台盼兰(Sigma公司);邻苯二甲醛(国药集团化学试剂有限公司);正丁醇(天津津东天正精细化工有限公司);正庚烷(天津市富宇精细化工有限公司);三氯乙酸(武汉市合中生化制造有很公司);伊文思兰(sigma进口分装);卵白蛋白(sigma进口分装)。
1.2 实验动物
SD大鼠,雄性,体质量(200±20)g,由黑龙江中医药大学药物安全性评价中心提供,合格证号为SCXK(黑)2008004号。
2 实验方法
2.1 PCA试验判断刺五加注射液的致敏性
2.1.1 分组
SD大鼠,随机分为5组,分别为阳性药卵白蛋白组、刺五加注射液组(批号 20100309、20100702、20100907)、生理盐水组,每组6只。
2.1.2 致敏及抗血清的制备
经本课题组对PCA试验的各影响因素进行优化后,建立了灵敏、可靠的PCA试验方法,采用优化后的PCA方法,将各组实验药物与弗氏佐剂混合后的乳剂分别注射于背部皮内四点,隔日1次;共免疫3次,末次致敏后 15天,大鼠眼眶取血,室温自然凝固,6 000rpm、离心20min,分离血清并按组合并,置-20℃冰箱备用。
2.1.3 激发
另取SD大鼠30只,按照被动致敏时注射的抗血清不同随机分为5组,每组6只,将其背部脱毛,同时准备各组血清的生理盐水稀释液(1∶2、1∶8、1∶32)和血清原液备用。在大鼠脊柱两侧各取两点,共四点,每点皮内注射一种血清原液或是血清生理盐水稀释液,每点注射0.1ml。24h后,静脉注射抗原药物和伊文思兰的混合液。抗原激发30min后,放血处死大鼠,剪取并翻转背部皮肤,测定蓝斑直径,并拍照留存,蓝斑直径在5mm以上者判定为试验阳性,5mm以下者判定为试验阴性。
2.2 致敏大鼠腹腔肥大细胞内外组胺总量的测定
2.2.1 肥大细胞的分离、纯化
将PCA试验中各组致敏大鼠,放血处死,制备腹腔肥大细胞悬液,在4℃实验条件下,根据密度梯度分离的原理,采用不同密度的细胞分离液Percoll对肥大细胞进行分离、纯化,镜下计数,调细胞浓度至1×105个/ml。
2.2.2 肥大细胞处理
离心管中加入450ul的肥大细胞悬液后分别加入台氏液200ul和对应抗原200ul。37℃下孵育10min,孵育完成将细胞离心取上清,得细胞外液。沉淀物加入0.8ml的台氏液混匀煮沸10min,使细胞破裂,离心取上清,得细胞内液。
2.2.3 肥大细胞组胺测定
取处理后的样品1.6ml置于已加NaCl的试管中,再加入正丁醇和NaOH溶液,立即混匀、震荡。然后取出正丁醇相加入到含HCl溶液和正庚烷的试管中,震荡。弃有机相,HCl相置入试管中。
HCl相用三蒸水稀释1倍,加入NaOH溶液,混匀并迅速加入邻苯二甲醛的甲醇溶液,立即混匀,并在21℃ ~22℃反应10min,加入HCl溶液酸化,以终止缩合反应并使荧光物质稳定,测荧光值(激发波长350un,发射波长442nm)。试剂空白以三蒸水代替处理后的样品。
2.3 PCA试验对刺五加注射液致敏物质的初步筛选
将批号为20100702的刺五加注射液采用85%乙醇进行沉淀,分别获得沉淀与上清两部分,另取空白SD大鼠12只,分为2组,每组6只,将2.1.2项下所得的抗血清按生理盐水稀释液(1∶2、1∶8、1∶32)和血清原液进行背部注射致敏,每点注射0.1ml。24h后,上述两组大鼠分别静脉注射刺五加注射液的醇沉产物与上清和伊文思兰的混合液进行激发。激发30min后,放血处死大鼠,剪取并翻转背部皮肤,测定蓝斑直径,并拍照留存,蓝斑直径在5mm以上者判定为试验阳性,5mm以下者判定为试验阴性。
3 实验结果
3.1 大鼠被动皮肤过敏实验(PCA)
大鼠被动皮肤过敏实验 实验数据见表1,图1~4。
表1 刺五加注射液大鼠被动皮肤过敏试验结果(±s)
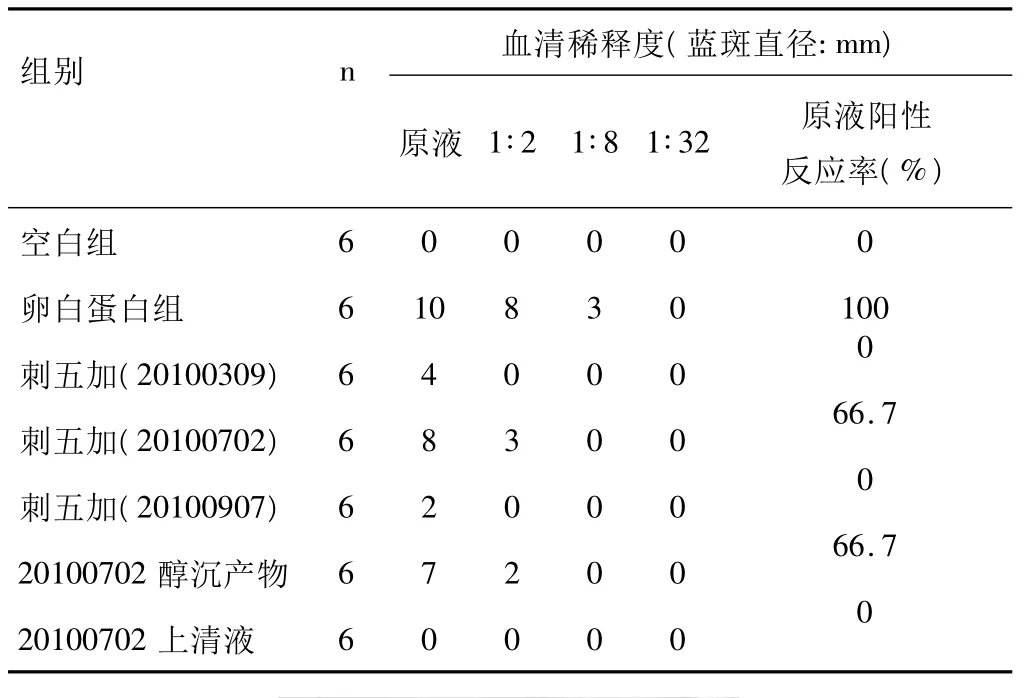
表1 刺五加注射液大鼠被动皮肤过敏试验结果(±s)
组别n 血清稀释度(蓝斑直径:mm)6 0 0 0 0 0卵白蛋白组 6 10 8 3 0 100刺五加(20100309) 6 4 0 0 0 0刺五加(20100702) 6 8 3 0 0 66.7刺五加(20100907) 6 2 0 0 0 0 20100702 醇沉产物 6 7 2 0 0 66.7原液 1∶2 1∶8 1∶32 原液阳性反应率(%)空白组20100702上清液 6 0 0 0 00
图1 空白组

图2 卵白蛋白阳性对照组

图3 刺五加批号20100702沉淀组

图4 刺五加批号20100702组
实验结果显示:刺五加注射液(批号20100702)、刺五加注射液85%醇沉产物,卵白蛋白组,原液斑点直径均大于5mm,呈现阳性结果,生理盐水组、刺五加注射液(批号20100309、20100907)均呈现阴性结果,经改良后的被动皮肤过敏试验可以较为灵敏的检测刺五加注射液的过敏性。
3.2 腹腔肥大细胞内外组胺量测定结果
不同批次刺五加注射液对致敏大鼠腹腔肥大细胞组胺量的影响见表2,经统计学分析表明,PCA试验中阳性过敏批次20100702与两空白对照组及批次20100309、20100907相比较均具有显著性差异(P<0.05)。
表2 刺五加注射液致敏后大鼠腹腔肥大细胞组胺释放量(±s)

表2 刺五加注射液致敏后大鼠腹腔肥大细胞组胺释放量(±s)
注:与空白组比较,*P<0.05;与 20100309和20100907比较,*P <0.05。
批次 20100309 20100702** 20100907空白组1 1.10 ±0.11 2.85 ±0.50*0.80 ±0.19 0.46 ±0.07 0.17 ±0.03 0.57 ±0.01 2 1.35 ±0.30 2.78 ±0.61* 0.25 ±0.05 0.57 ±0.02 3 1.38 ±0.01 2.42 ±0.74* 0.61 ±0.10 0.52 ±0.13 4 1.26 ±0.41 3.30 ±0.85* 0.38 ±0.08 0.51 ±0.09 5 2.44 ±0.52 2.76 ±0.63* 0.45 ±0.10 0.53 ±0.10 6 2.16 ±0.16 2.96 ±0.45*
4 讨论
建立一个灵敏、可靠的过敏实验判断方法是现阶段进行中药注射剂致敏物质筛选的前提条件,PCA是根据P-K试验原理发展而来,其基本原理:将致敏动物血清(内含丰富IgE抗体)皮内注射于正常动物。IgE与皮肤肥大细胞的Fcз受体结合,使之被动致敏。当致敏抗原激发时,引起局部肥大细胞释放过敏介质,从而使局部血管通透性增加,注入染料可渗出于皮丘,形成一个蓝斑。根据蓝斑范围,判定过敏反应程度。PCA是一种较佳的鉴定抗原抗体反应的体内法。目前有更多的体外法如酶联及放免等方法,然而在某些情况下,特别是动物实验条件下体内法是很有意义的,本研究将PCA试验进行改良后作为刺五加注射液过敏性实验体内试验方法,同时采用经典的组胺测定方法—荧光分光光度法测定致敏大鼠腹腔肥大细胞组胺量,从而判断刺五加注射液的过敏性,经优化后的PCA试验为进一步对刺五加注射液的致敏原因进行分析,查找其致敏物质,保证刺五加注射液在临床上的安全应用奠定了实验基础。
通过将刺五加注射液按照原有工艺进行醇沉所得的沉淀产物与上清液的致敏性进行判断,初步判断致敏物质可能存在于醇沉产物中,这与其他的文献[5-6]报道中表述抗原物质可能为大分子蛋白类物质相符,但目前还不能排除其他高分子物质以及小分子半抗原作为致敏物质存在的可能性,因此,本课题组在此研究基础上,将进一步对刺五加注射液的致敏物质进行筛选以及致敏机制进行深入研究,找到刺五加注射液的致敏原因,确保刺五加注射液的安全性,保障临床用药的需要。
[1] 王剑,廖林.158例刺五加注射液不良反应调查分析[J].中医中药,2009,6(21):91 -93.
[2] '范丽静,蒋晓红,姚国恩.刺五加注射液研究进展[J].中成药,2003,25(6):488.
[3] 董梅,李廷利.刺五加化学成分及药理作用研究进展[J].中医药学报,2011,39(3):98 -100.
[4] 刘宗昌,王德才.刺五加注射液的不良反应[J].中国中医药信息杂志,2002,9(1):68 -69.
[5] 于凤平,胡昌勤,崔生辉.刺五加注射液中过敏性杂志的分析[J].中国药学杂志,2008,43(5):384 -387.
[6] 范能全.刺五加注射液致敏物质检测及处理方法[J].重庆师范大学学报:自然科学版,2011,28(1):68 -70.

