混合拮抗菌防治葡萄白腐病培养基的优化
齐牧遥,赵 丹,王 芬,谢 云,陈五岭
(西北大学生命科学学院,陕西西安710069)
美国红提葡萄又名美国红提、晚红、大红球,是美国加州大学育成的优质葡萄新品种,晚熟[1-2],它以个大、色艳、肉厚、味甜、质优、耐贮等优良性状而著称,深受广大人民群众的喜爱。但是,红提葡萄属欧亚品种,抗病性较差,不抗多种病害,在多雨的年份或栽植在温暖湿润的地区,其主要病害尤其是真菌性病害发生严重,病害一旦蔓延,对产量、品质、效益影响较大,造成许多果园减产甚至面临毁园的危险,因此,防治病害至关重要[3-4]。
目前,红提葡萄的主要病害为葡萄黑痘病、葡萄霜霉病、葡萄白腐病,防治措施主要为套袋或者化学防治,但其往往会带来人力成本过高、用药盲目、超浓度用药等问题[5-6]。由于生物防治技术具有安全、无污染、无残留等特点,越来越受到人们的广泛关注。葡萄白腐病又称腐烂病,全世界均有分布,它是红提葡萄主要的真菌性病害之一。该病常年发生,一般年份会造成减产15%~20%,在流行年份达到60%以上,是红提葡萄病害中造成损失最重、危害最大的一种病害[7-8]。Guetsky等[9]证实,不同的拮抗微生物具有不同的功能,混合使用比单独使用效果更好。
本试验选取红提葡萄真菌性病害中发生频率最高、范围最广、病害严重性最强的白腐病的拮抗菌作为研究对象,将实验室已有的2种拮抗菌混合培养,从而获得拮抗能力更强的混合拮抗菌液,并尝试优化培养基配方,提高混合菌液的拮抗能力,旨在为进一步配制复合生防菌肥、无公害防治葡萄白腐病打下基础。
1 材料和方法
1.1 试验材料
1.1.1 菌种 枯草芽孢杆菌PT2′(由西北大学生命科学学院实验室诱变得到,保存于4℃冰箱),QM34(由西北大学胡青平博士筛选并予以鉴定),葡萄白腐病病原指示菌(为西北大学生命科学学院实验室保藏菌种)。
1.1.2 培养基 摇瓶种子培养基(g/L):蛋白胨10.0,葡萄糖 5.0,牛肉膏 5.0,NaCl5.0,MgSO4·7H2O 0.15,MnCl2·7H2O 0.01。
牛肉膏蛋白胨培养基(g/L):蛋白胨10.0,牛肉膏 3.0,NaCl15.0,琼脂 20.0。
玉米粉液体培养基:糖化酶(2 000单位),α-淀粉酶(2 000 单位),玉米粉,KH2PO4,CO(NH2)2。
牛肉膏蛋白胨液体培养基(g/L):牛肉膏3.0,蛋白胨 10.0,NaCl15.0。
以上培养基使用的试剂均为化学纯,调整pH值为7.0,121℃下灭菌30min。
1.1.3 仪器设备 超净台SW-CJ-1F,上海苏净实业有限公司;立式压力蒸汽灭菌锅LDZX-40BI,上海申安医疗器械厂;电热恒温干燥箱GZX-DH 400-BS-Ⅱ,上海跃进医疗器械厂;显微镜Eclipse E200,尼康公司;电子天平Sartorius BS210S,北京赛文利斯;培养箱MJ-160-Ⅱ,上海跃进医疗器械厂;分光光度仪UV-2401,PC。
1.2 试验方法
1.2.1 最佳发酵条件的确定
1.2.1.1 最佳培养基的选择 将菌种PT2′及QM34按照接种量各1%混合,分别接种于装有无菌牛肉膏蛋白胨培养基、无菌摇瓶种子培养基和无菌玉米粉液体培养基的锥形瓶中,做好标记。然后将3个锥形瓶置于30℃,200 r/min的摇床中振荡培养24 h。重复3次。
1.2.1.2 发酵培养基生物量测量 取1.2.1.1的3种发酵液各1mL,于5mL无菌水中稀释后,分别取1mL,在660 nm下测定吸光值,标记为A660,每种发酵液重复测定3次。以未接种的无菌培养基按照相同的取量作为空白对照。
1.2.1.3 发酵培养基抑菌能力的观察 于4℃,1 000 r/min离心10min得到1.2.1.1的3种发酵液的上清液,经过微孔滤膜过滤得到无菌发酵液,以葡萄白腐病致病真菌为拮抗对象,四点杯碟对峙法[8]做拮抗试验,每个平板试验重复3次,记录拮抗抑菌圈的大小。离心得到的3组发酵液试验互为对照。
1.2.2 工业发酵培养基的优化
通过查阅相关文献[10],在试验确定的最佳培养基的基础上,加入低浓度的MnS,以观察混合拮抗菌发酵液A660值以及抑菌能力的变化。
1.2.2.1 最佳培养基的优化 用SPSS 19.0设计6因素3水平的正交表,随机产生18组试验(表1)。30℃培养24 h后测定A660值,然后取拮抗菌株发酵液做拮抗试验,6 d后观察抑菌圈的大小,重复3次。

表1 L18(36)正交设计 g/L
1.2.2.2 统计分析 采用SPSS 19.0进行正交试验表格设计及方差分析。
2 结果与分析
2.1 3种培养基摇床培养菌数变化
将PT2′与QM34混合分别接入无菌牛肉膏蛋白胨培养基、无菌摇瓶种子培养基和无菌玉米粉液体培养基中,记为N组、Z组和Y组。振荡培养24 h,测定A660值,记录发酵液中菌数变化的结果(表2)。
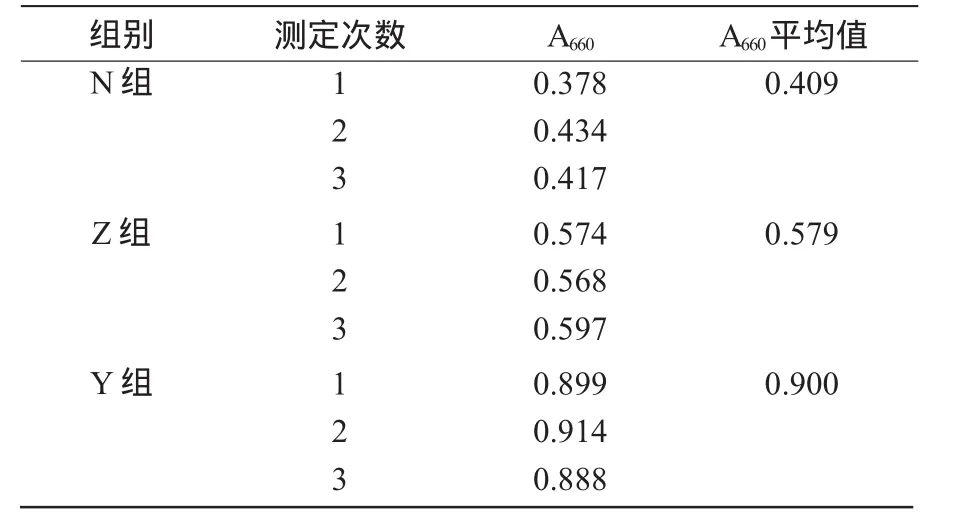
表2 3种培养基发酵液的A660值
从表2可以看出,经过液体摇床发酵,Y组的吸光度值A660明显高于Z组和N组,这说明在玉米粉液体培养基中,PT2′与QM34的混合发酵液含菌量最多。
以表2数据为基础,假设Y组培养基中,PT2′与QM34的混合发酵液含菌量最多为正确,经过SPSS数据分析,得到表3。
从表3可以看出,N,Z,Y这3组数据的P值均小于0.01,说明根据表2推理的假设成立,且Y组的A660较N组和Z组有显著差异,这说明Y组的发酵液中含菌量最多,即Y组较N组和Z组发酵液更适宜混合菌的生长。

表3 3种不同培养基发酵液A660值差异性检验
2.2 3种培养基抑菌效果观察
为了观察不同培养基对混合菌液拮抗能力的影响,将培养1 d以上的PT2′与QM34的混合培养液制成无菌发酵液,做拮抗试验,每种培养基3组重复,记录各组的抑菌圈直径大小(表4、图 1)。
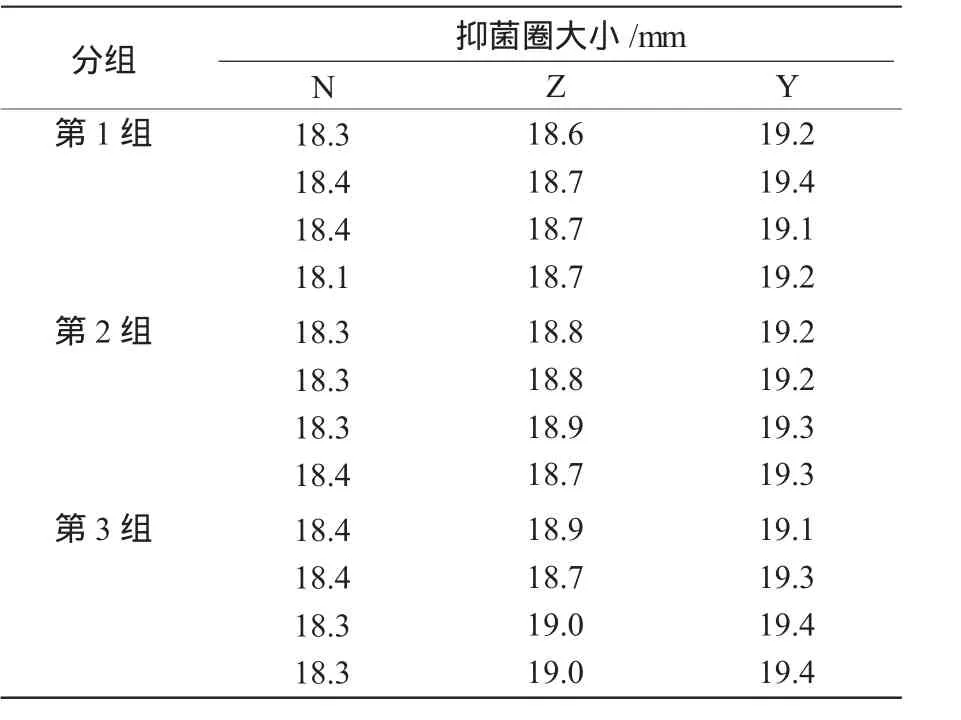
表4 不同培养基发酵液的抑菌效果

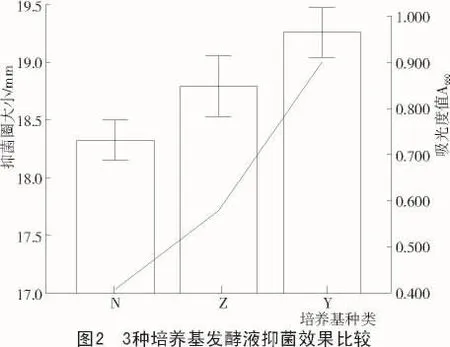
从表4和图1可以看出,Y组培养基发酵液的抑菌圈大小高于N组和Z组,说明其拮抗能力显著高于N组、Z组发酵液的拮抗能力。
由图2可知,Y组发酵液的抑菌圈大小和吸光度均高于N组和Z组,由此可得出结论:PT2′与QM34在玉米粉液体培养基中混合培养,产生发酵液与其他2种培养基的相比,拮抗能力更强,即本试验中玉米粉液体培养基为最优培养基,这为下一步培养基的优化提供了理论基础。
2.3 玉米粉液体培养基的优化
为了进一步提高试验确定的最优培养基——玉米粉液体培养基的抑菌效价,我们在培养基中加入少量的MnS,并用SPSS软件对试验数据进行正交极差分析。
2.3.1 正交结果极差分析 从表5可以看出,当极差分析中以吸光度值为指标时,各因素的影响顺序为:B>A=C=D>E>F;以抑菌圈大小为指标时,各因素的影响顺序为:A>F>B>E>D>C,但仅以此数据还不能分析确定各因素的影响大小,所以需对其再进行方差分析来确定。
2.3.2 正交结果方差分析 分别以吸光度值A660和抑菌圈大小为标准,用SPSS软件进行方差分析,统计各因素对优化培养基配比影响的显著性结果。方差分析结果如表6和表7所示。
由表6、表7分析比较得知,以吸光度A660为衡量指标,各因素水平之间并没有显著性差异;相比较,各因素水平对抑菌圈的影响较大,因此,在选择水平的时候,将对抑菌圈的影响作为主要因素考虑。
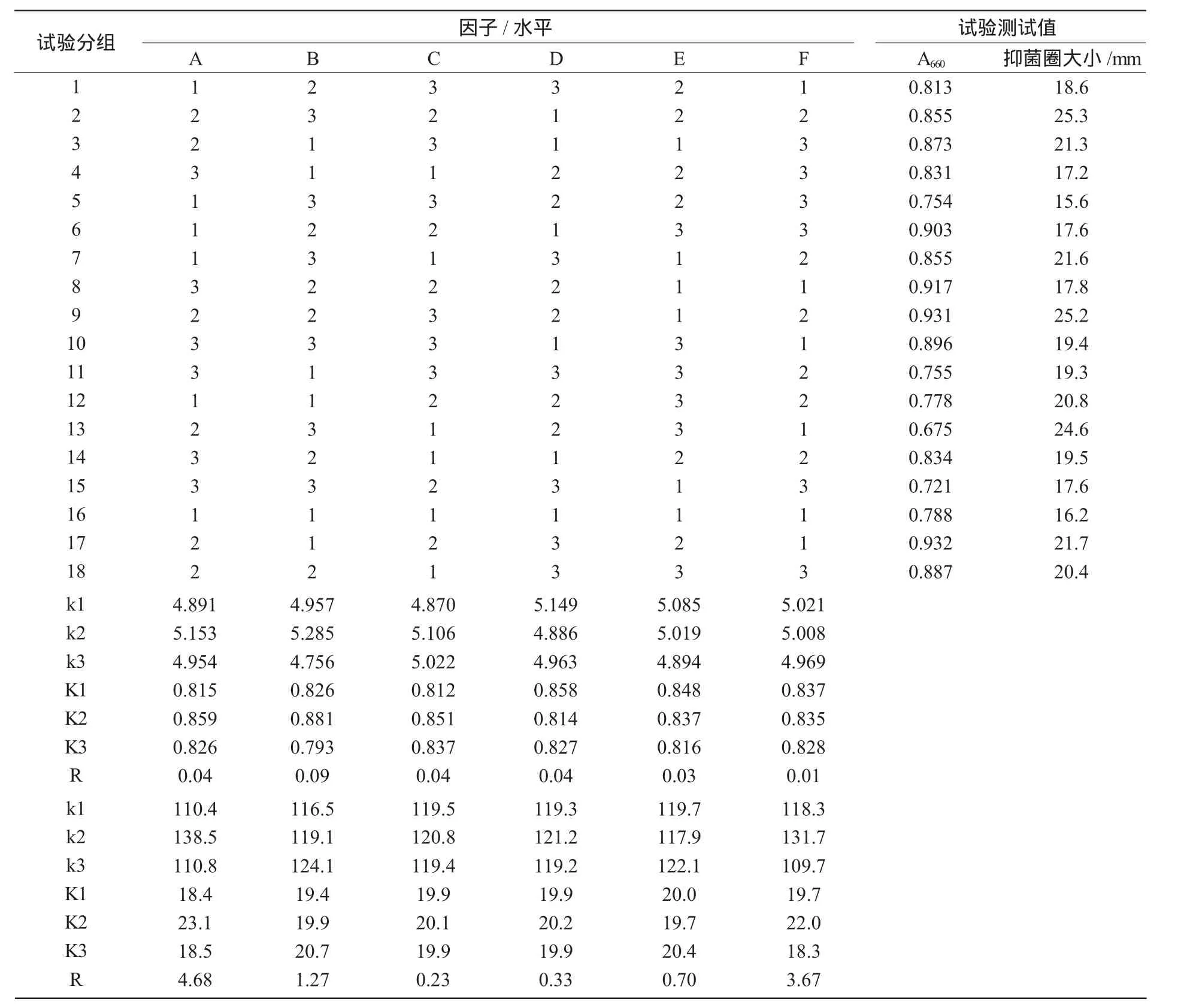
表5 正交结果的极差分析
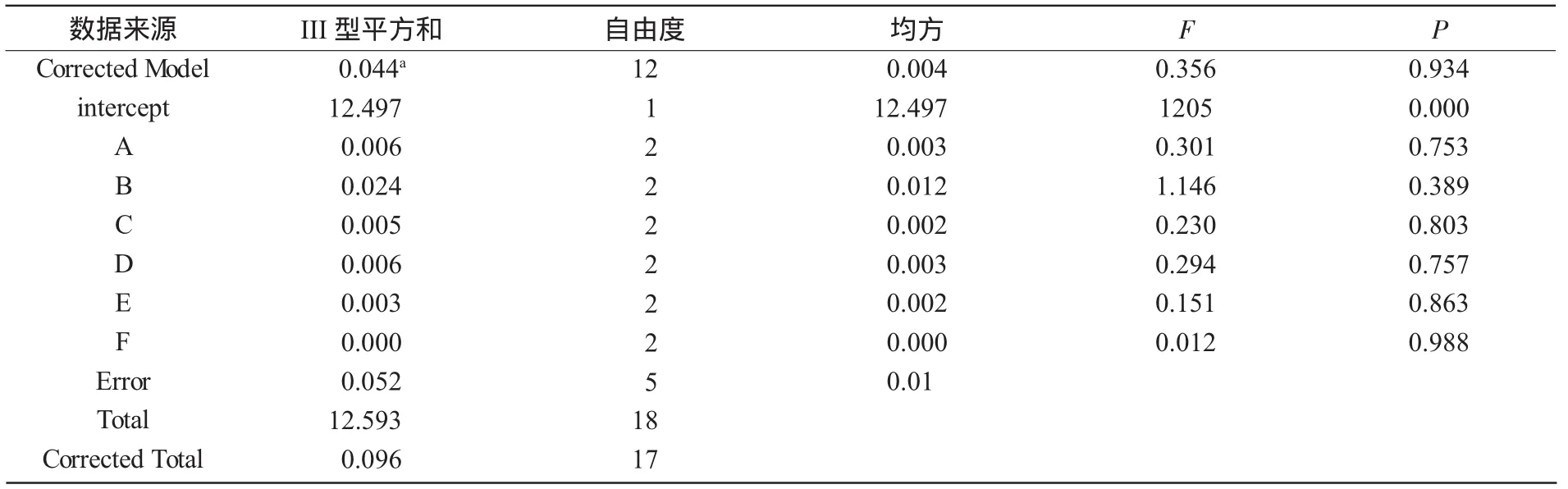
表6 依靠A660的方差分析结果
由表7可知,以抑菌圈大小为指标,因素A对拮抗菌的生长有显著性的影响,各因素影响大小顺序为:A>F>B>E>D>C,极差表中分析得到最优组合为A2B2C2D1E1F1;表6中反映的影响顺序为:B>A>D>C>E>F,分析得到最优组合为:A2B3C2D2E3F1。综合极差分析及方差分析可以得出,因素A,B,D无论是对拮抗菌的吸光度值,还是抑菌圈大小都产生了较为稳定的影响,同时,因素A,B表现出了显著的促进作用,而因素C,E则无显著影响,从而确定玉米粉液体培养基的最优组合为A2B3C2D2E1F1,即玉米粉150.0 g/L、糖化酶1.1 g/L、α-淀粉酶1.5 g/L、CO(NH2)25.0 g/L、KH2PO45.0 g/L。
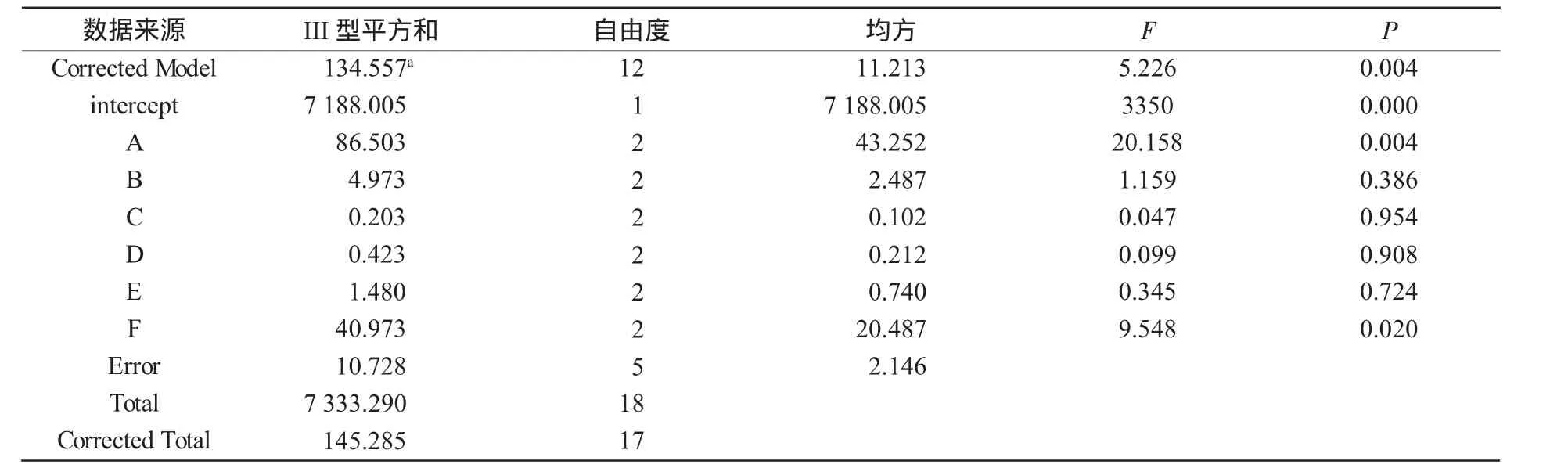
表7 依靠抑菌圈大小的方差分析结果
3 结论与讨论
本试验通过对比,筛选出红提葡萄白腐病拮抗菌PT2′与广谱拮抗菌株QM34混合培养的最佳培养基,并且利用SPSS软件的分析,确定了最佳培养基的最优组合,这为今后工业上大规模生产发酵打下了基础。
同时通过查阅文献,在混合菌株的培养基中加入少量的MnS,以期提高混合菌株的拮抗能力。试验结果表明,MnS确实可以提高混合菌液的抑菌能力,但是对其中的菌量并没有显著影响,具体原因还有待进一步深入研究。
[1]晓雪.美国红提葡萄栽培技术[J].致富之友,2005(4):45.
[2]郝云风,史有国,樊俊峰,等.美国红提葡萄快速育苗技术[J].内蒙古农业科技,2001(4):9.
[3]王森.红地球葡萄主要病原菌的发生与综合防治[J].中外葡萄与葡萄酒,2002(1):43-44.
[4]Pearson RC,Goheen AC(美).葡萄病害防治[M].陈捷,杨伟纲,译.沈阳:辽宁科学技术出版社,1992:37-41.
[5]张中山.红提葡萄栽培技术及病害防治 [J].河南农业,2009(1):36.
[6]杜东奇.红提葡萄病害防治中存在的问题及对策[J].山西果树,2007,3(2):34-35.
[7]刘志恒.葡萄白腐病[J].新农业,2003(10):36-37.
[8]赵奎华,陶承光,刘长远.葡萄病虫害原色图鉴[M].北京:中国农业出版社,2006.
[9] Guetsky R,Shtienberg D,Elad Y,et al.Improving biological control by combiningbiocontrolagentseach with severalmechanisms of disease suppression[J].Phytopathology,2002,92:976-985
[10]吴艳,陶晶.芽孢杆菌组合CL-8发酵条件优化及其防病效能研究[J].农业工程学报,2008,24(7):204-208.

