三种阿尔茨海默病小鼠模型的建立和比较
程 欣 马刘红 徐建兵 陈 彦 罗焕敏 (暨南大学医学院组胚系,广东 广州 50632)
阿尔茨海默病(Alzheimer's disease,AD)是一种与衰老相关、以认知功能下降为特征的渐进性脑退行性疾病。AD患者大脑皮质弥散性萎缩,神经元丢失,突触减少,细胞外β淀粉样蛋白(amyloid β-protein,Aβ)沉积形成老年斑(senile plaque,SP)和细胞内tau蛋白异常磷酸化导致神经原纤维缠结(neurofibrillary tangle,NFT)形成是其特征性病理变化。由于AD是多因素引起的、涉及多种病理机制的多因异质性疾病,建立精准复制AD病理特征和临床症状的动物模型有一定困难,从而影响AD的深入研究。模型是评价实验结果的重要依据,因此,确立合适的AD模型是实验的基础。本实验分别采用侧脑室注射Aβ25-35、AlCl3和海马物理损伤三种方法复制出不同的AD小鼠模型,旨在建立并比较这几种常用模型的特点。
1 材料与方法
1.1 实验动物 SPF级雌性昆明小鼠90只,体重25.0~30.0 g,购自广东省医学实验动物中心,合格证2009A022。
1.2 试剂和仪器 Aβ25-35(Sigma,Cat:A4559)。Aβ25-351 mg溶于 100 μl灭菌生理盐水中,浓度为 10 μg/μl,4℃ 冰箱保存,使用前封口置于37℃孵育96 h。AlCl3(天津市福晨化学试剂厂)。2.5 g AlCl3溶解于100 ml灭菌生理盐水中,4℃冰箱贮存备用。兔抗 β1-40多克隆抗体、SABC免疫组化试剂盒(均Boster),DAB(福州迈新)。自制针头(取9号注射针头,于距针尖1 mm处弯折90°)。通用型Morris水迷宫自动实验记录仪器(上海吉量公司),DY-1型脑立体定位仪(天津市医疗器械研究所),微量注射器(宁波市镇海玻璃仪器厂)。
1.3 方法
1.3.1 动物分组 90只小鼠分6组,每组15只。①正常对照组:动物未经任何处理。②Aβ25~35损伤模型组:小鼠经3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,固定于脑立体定位仪,暴露前囟,参照小鼠脑立体定位图谱,每只小鼠右侧脑室注射3 μl Aβ25-35(浓度2 μg/μl);坐标为前囟后1.2 mm,矢状缝右侧旁开1.2 mm,即为侧脑室的体表部位(图1),进针深度为颅骨表面向下3.2 mm;注射时进针1 μl/min,注射后留针8 min,拔针时速度为1 mm/min,动物清醒后归笼饲养。③AlCl3损伤模型组:小鼠右侧脑室内注射3 μl AlCl3溶液(浓度2.5%),注射坐标、方法同上组。④海马物理损伤模型组:小鼠固定于脑立体定位仪,坐标为前囟后2.4 mm,矢状缝右旁开2.0 mm,使用自制尖端弯曲的9号针头垂直插入两侧海马,顺时针转一周,进针深度为颅骨表面向下3 mm。⑤空白对照组:注射部位、方法同②,注射等体积的无菌生理盐水。⑥假手术组:小鼠固定于脑立体定位仪,坐标同④,使用自制尖端弯曲的9号针头垂直插入两侧皮层,进针深度为颅骨表面下1.5 mm,不旋转,插入即拔出(排除皮层损伤对小鼠行为学的影响)。
1.3.2 行为学检测 术后14 d,水迷宫检测小鼠学习记忆能力。Morris水迷宫直径100 cm、高50 cm,水深30 cm。水温(24±1)℃。池壁标记 E、S、W、N 4个入水点,在 E、S象限中央、距池壁约30 cm处,放置一高约29 cm、直径9 cm的水下平台。测试共5 d,包括:①定位航行试验(place navigation training):将小鼠依次从4个入水点面向池壁放入水中,记录小鼠从入水至找到并爬上平台的时间即逃避潜伏期。测试时间60 s,上台15 s后系统自动关闭。60 s内小鼠未找到平台,逃避潜伏期记录为60 s,随后将小鼠置于平台上停留15 s。室内安静、参照物位置固定。完成4个象限测试为1次,每天上下午各训练1次,连续4.5 d,统计第5天上午的逃避潜伏期,逃避潜伏期越短说明其学习记忆能力越好。②空间探索试验(spatial probe training):第5天下午撤平台,将小鼠于S点置于水中,记录其90 s内穿越原平台所在位置的次数,穿台次数越多说明小鼠学习记忆能力越好。
1.3.3 组织学切片观察海马形态 实验用小鼠完成水迷宫测试后,4%多聚甲醛灌注固定,取小鼠全脑,后固定24 h后梯度蔗糖脱水,OCT包埋,海马区冠状连续冰冻切片,片厚20 μm,每3张取1张裱片,HE染色,观察各组小鼠海马结构变化。
图1 侧脑室注射染料后体视镜图(×10),依此确定侧脑室的体表体置
1.3.4 Aβ1-40免疫组化染色 海马区冠状连续切片每3张取1张行Aβ免疫组化染色。切片抗原微波修复10 min,一抗为兔抗 Aβ1-40多克隆抗体(1∶200),4℃冰箱过夜,DAB 显色,苏木素复染。
1.4 统计学处理 行为学检测结果用SPSS16.0处理,采用单因素方差分析。方差齐同用LSD检验各组间显著性差异,方差不齐用Tamhane's法。数据以±s表示,α=0.05。
2 结果
2.1 不同造模方法对小鼠学习记忆的影响 定位航行和空间探索实验结果显示(表1):与正常对照组、空白对照组和假手术组比较,海马物理损伤组小鼠逃避潜伏期显著延长、穿越平台次数明显减少(P<0.01),AlCl3侧脑室注射组小鼠逃避潜伏期也延长、跨越平台次数也减少(P<0.05),但均不及海马物理损伤组明显,Aβ25-35侧脑室注射组小鼠逃避潜伏期和穿越平台次数变化不明显(P>0.05)。3个模型组间比较,Aβ25-35注射组小鼠逃避潜伏期和穿台次数与海马物理损伤组和AlCl3注射组均有显著性差异(P<0.05)。可见海马物理损伤组、侧脑室注射AlCl3组小鼠空间学习记忆能力受到一定影响,但一次性侧脑室注射Aβ25-35对小鼠空间学习记忆影响不大。侧脑室注射生理盐水及伤及皮层的物理损伤对小鼠的学习记忆能力无影响。见表1。
2.2 各组小鼠海马Aβ1-40免疫组化染色结果 正常对照组、空白对照组、假手术组和海马物理损伤模型组小鼠海马Aβ1-40反应均呈阴性;侧脑室注射AlCl3和Aβ25-35模型组的小鼠,在海马区和皮层都可见呈Aβ1-40弱阳性反应的细小的棕黄色斑块,阳性反应物积聚在神经元胞体和突起的周围,以星星点点的“弥散状斑块”为主,未见较大的阳性斑块聚集。其中侧脑室注射AlCl3组Aβ1-40阳性物略多。见图2。
表1 各组小鼠第5天定位航行与空间探索实验结果比较(± s,n=15)
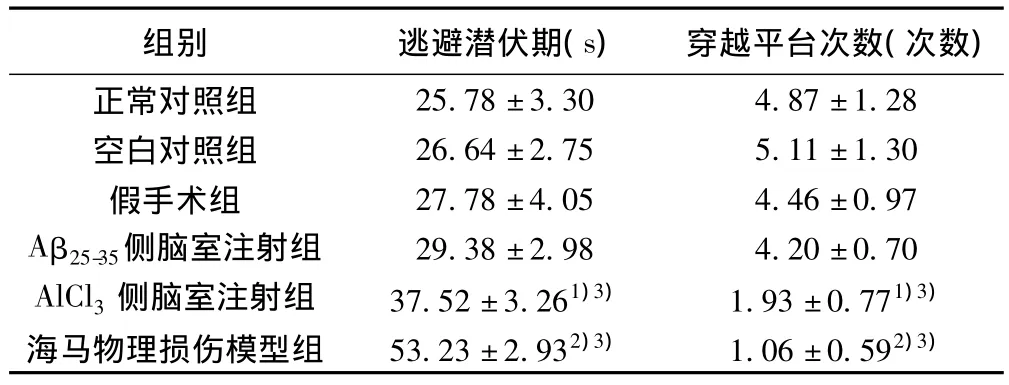
表1 各组小鼠第5天定位航行与空间探索实验结果比较(± s,n=15)
与正常对照组、空白对照组和假手术组比较:1)P<0.05;2)P<0.01;与Aβ25-35侧脑室注射组比较:3)P<0.05
组别 逃避潜伏期(s) 穿越平台次数(次数)正常对照组25.78±3.30 4.87±1.28空白对照组 26.64±2.75 5.11±1.30假手术组 27.78±4.05 4.46±0.97 Aβ25-35侧脑室注射组 29.38±2.98 4.20±0.70 AlCl3侧脑室注射组 37.52±3.261)3) 1.93±0.771)3)海马物理损伤模型组 53.23±2.932)3) 1.06±0.592)3)

图2 各组小鼠海马Aβ1-40免疫组化染色结果(×100)

图3 各组小鼠海马CA1区病理学改变(HE,×200)
2.3 各组小鼠海马形态学变化 如图3所示,正常对照组小鼠海马CA1区锥体形神经元有1~3层,细胞形态规则,层次清晰,排列整齐密集,胞核浅染、核仁清楚。海马物理损伤模型组小鼠海马CA1~CA3区的锥体形神经元及DG颗粒神经元数量明显减少,CA1区神经元多为单层分布,排列松散,有些部位细胞层不连续,细胞间有空隙。有的细胞核浓染,出现核固缩,有些细胞核有水肿。手术进针的皮层表面有组织缺损,针道附近可见较明显的毛细血管增生。AlCl3损伤模型组海马CA1区形态介于正常对照组和海马物理损伤模型组之间,但更接近正常组,神经元排列较整齐,有些部位偶见细胞稀疏、核固缩、核内染色体边集等现象。侧脑室注射Aβ25-35模型组海马区结构与正常对照组差异不明显,有些部位神经元层次结构松散。空白对照组和假手术组小鼠海马形态同正常对照组无差异,假手术组小鼠皮层表面尚见浅凹形缺损。
3 讨论
理想的AD模型应具备以下条件:①记忆和认知功能障碍;②能复制引起损伤的病理特点:SP、NFT及神经元丢失;③胆碱能系统功能低下。一个动物模型如能反映出上述3个方面,可认为是成功的AD动物模型。动物模型是药物研究的前提,选择合适的模型对药物临床前研究的成败至关重要。目前常把学习和记忆障碍的动物模型作为AD的动物模型。
Aβ是SP的主要成分,但Aβ注射制作AD模型的可行性报道差别较大。Aβ常见注射部位有Meynert核、海马等,造模方式有一次性注射致急性中毒和持续性注射致慢性中毒〔1~4〕。基于AD是脑组织弥漫性损伤性疾病,经侧脑室给予更利于Aβ弥散而造成较大范围的损害,同时依据Aβ神经毒性的特点,本实验采用Aβ核心毒性片断25-35肽段侧脑室注射制作AD模型。结果显示Aβ25-35一次性侧脑室注射后第3周末,小鼠穿越平台次数和逃避潜伏期与对照组均无明显差异,即对小鼠记忆能力无影响。此与上述文献结果有差异,究其原因可能与Aβ蛋白的活性受温度、pH、浓度、分子构象等多因素影响有关;并且本实验选用Aβ25-35,有可能因片段较短致使毒性降低而损伤较轻。由于小鼠机体本身存在自净和修复作用,一次性给予Aβ有可能可制备记忆损伤模型,但损伤持续时间较短,且未形成明显形态学改变。因此,支持Aβ注射造模需多次注射的观点,如多次给药一般需要埋管处理,显著增加造模难度和成本。
铝毒性作用在AD形成中引起高度关注。流行病学资料显示:长期高铝暴露致认知能力下降,尸检结果也发现AD患者大脑中Al含量为正常人的1.5~3.0倍,提示Al和AD发病的潜在关联〔5〕。慢性铝中毒可导致小鼠神经原纤维变性,出现胆碱能系统损伤症状,大脑皮质萎缩、端脑皮质和海马神经元损伤丢失等,这些变化与AD病理改变有一定相似性〔6〕。慢性铝中毒致AD模型多采用腹腔或皮下注射,鉴于经验,长期腹腔或皮下注射易感染,反复灌胃给药也易引发胃黏膜损伤严重甚至穿孔,同时影响动物食欲致体重明显降低,故本实验采用了侧脑室一次性注射AlCl3的方法。文献报道铝积聚激活反应性星形胶质细胞,引发炎性反应,促使Aβ以不溶形式沉积于脑组织,形成老年斑〔7〕。本实验观察到造模后小鼠海马和皮层呈Aβ1-40免疫组化阳性反应,而Aβ1-40是老年斑的主要成分,与报道一致;另有研究表明铝可与钙调蛋白结合,改变该蛋白结构,影响钙调蛋白依赖的各种蛋白激酶活性,从而影响体内磷酸化和去磷酸化的过程及信号转导,如PKC异常激活导致tau蛋白异常磷酸化〔8〕,因此本模型能较好地模拟AD的特征性病理改变。该模型的优点有:①模拟AD程度高,造模成功率高;②价格低廉,造模成本低。缺点在于:由于酸碱度、AlCl3的神经毒性等原因,动物体重下降明显。
1970年代人们发现AD患者脑内Ach含量低于正常水平,提出胆碱能缺陷学说,认为突触末端胆碱能缺损是导致记忆障碍的主要原因之一。Meynert核是前脑皮层Ach的重要来源,其产生的Ach经穹窿转移至海马被利用,而海马在维持记忆方面扮演重要角色。针对这条通路产生各种记忆损伤模型,如真空抽吸、横断、电灼伤等物理方法。Xuan等〔9〕在前囟定位后插进刀片并反复抽提,离断SD大鼠一侧穹窿-海马伞外侧缘纤维,复制出痴呆大鼠模型。笔者在预实验中发现:实验动物的选择对结果有一定影响,应用该方法制备小鼠AD模型,操作中因横切抽动出血量大,术后动物死亡率高、造模成功率低;同时很难保持每次提拉刀片时进刀角度和深度一致,极易损伤周边脑组织。此法造模后行为学测试结果确有记忆减退,但难以说明完全是由损伤胆碱能通路所致。针对这点,笔者采取旋转的办法特异性地破坏海马组织,操作中容易定位,损伤强度和范围相对易于控制,小鼠术后存活率高。与上述2种化学损伤模型相比,物理损伤模型的优势在于:①造模时间短,记忆下降明显,持续时间久;②造模成本低;③损伤机制清楚;④无药物残留,若用于药物治疗研究,不会造成造模药物与治疗药物相互影响,造模后短时间内即可给药。劣势有:①损伤局限,无全脑弥漫性损伤,模拟AD程度低,无特征性病理改变形成;②操作难度大,损伤范围有时不易控制;③水迷宫中发现物理损伤后不游泳或游泳不灵活小鼠增加,可能与术后未完全康复有关。
因AD发病机制复杂,目前所有动物模型只能模拟其部分特征,且各种模型虽均可使动物记忆下降或出现行为学改变,机制却不尽相同。多因素复合损伤制作的AD模型,同样存在技术复杂、损伤机制不甚清楚等缺陷。研究AD模型的意义是为探明其发病机制和药物治疗提供平台,本实验使用的3种造模方法,旨在制作急性记忆下降的模型,可用于研究急性或亚急性指标的改变,或用于AD的预防给药及治疗药物的临床前研究。在不同的实验研究中,只有选择最合适的模型,才可达到事半功倍的效果。
1 Fabrício AP,Pablo P,Filipe SD,et al.Altered emotionality leads to increased pain tolerance in amyloid β (Aβ1-40)peptide-treated mice〔J〕.Behav Brain Res,2010;212:96-102.
2 张晓裕,何利明,侯军代,等.去痴灵对AD模型小鼠学习记忆及脑内突触体素表达的影响〔J〕.中国老年学杂志,2010;30(2):495-8.
3 Amaral FA,Resk Lemos MT,Dong KE,et al.Participation of kinin receptors on memory impairment after chronic infusion of human amyloid-β 1-40 peptide in mice〔J〕.Neuropeptides,2010;44:93-7.
4 姚柏春,袁 华,赵涓涓.Aβ25-35诱导阿尔茨海默病模型大鼠海马神经元HSP70的表达〔J〕.中国老年学杂志,2005;6(25):680-2.
5 Perl DP,Moalem S.Aluminum and Alzheimer's disease,a personal perspective after 25 years〔J〕.J Alzheimers Dis,2006;9(3 Suppl):291-300.
6 Kaizer RR,Corrêa MC,Spanevello RM,et al.Acetylcholinesterase activation and enhanced lipid peroxidation after long-term exposure to low levels of aluminum on different mouse brain regions〔J〕.J Inorg Biochem,2005;99(9):1865-70.
7 Lin R,Chen X,Li W,et al.Exposure to metal ions regulates mRNA levels of APP and BACE1 in PC12 cells:blockage by curcumin〔J〕.Neurosci Lett,2008;440(3):344-7.
8 Walton JR.An aluminum-based rat model for Alzheimer's disease exhibits oxidative damage,inhibition of PP2A activity,hyperphosphorylated tau,and granulovacuolar degeneration〔J〕.J Inorg Biochem,2007;101(9):1275-84.
9 Xuan AG,Luo M,Ji WD,et al.Effects of engrafted neural stem cells in Alzheimer's disease rats〔J〕.Neurosci Lett,2009;(450):167-71.

