左归丸与右归丸对EAE大鼠APP及GAP-43表达的影响1)
王义周,寇 爽,闫翠翠,郑 琦,张 琪,赵 晖,王 蕾
多发性硬化(multiple sclerosis,MS)是中枢神经系统脱髓鞘的自身免疫性疾病。其病理特点是炎症引起的脱髓鞘和轴突损伤等[1]。实验性变态反应性脑脊髓炎(experimental autoimmuneencephalomyelitis,EAE)是目前公认的研究MS较为理想的动物模型[2]。前期临床和实验研究发现,左归丸与右归丸对MS病人及EAE大鼠具有较好的作用[3-6]。本实验利用Western-blot和实时荧光定量RT-PCR检测技术,进一步观察了两方对EAE大鼠脑白质和脊髓组织中与神经轴突损伤和再生相关的淀粉样前体蛋白(amyloid precursor protein,APP)及神经生长相关蛋白(growth associated protein-43,GAP-43)的蛋白水平与mRNA水平表达的影响,深入探讨左右归丸治疗EAE的可能机制,并比较两方药作用的异同,为临床中医药辨证论治MS及其相关神经退行性病变提供科学依据。
1 材料与方法
1.1 实验动物 225只SPF级雌性 Lewis大鼠,体重150 g~180 g,由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(京)2006-0009。
1.2 药品及试剂 醋酸泼尼松片:天津太平洋制药有限公司生产;左归丸与右归丸:河南省皖西制药股份有限公司生产;豚鼠MBP68-86(YGSLPQKSQRSQDENPV):北京中科亚光生物科技有限公司合成;不完全福氏佐剂(Incomplete Freund’s Adjuvant,IFA)和结核分枝杆菌病(Mycobacterium Tubercusis,H37Ra,MTB):美国Difco公司生产;APP、GAP-43和 GAPDH抗体:美国 Epitomics公司生产;Western-blot试剂盒:北京康为世纪生物技术有限公司提供;实时荧光定量RT-PCR相关试剂:美国 Takara及Invitrogen公司提供;引物由上海生工生物有限公司合成;Fermentas K1622 RT逆转录试剂盒购自MBI公司;SYBR Green PCR Master Mix试剂盒购自美国应用生物公司。
1.3 模型制备 将大鼠随机分为正常组、模型组、激素组、左归丸组和右归丸组。每组45只。模型组和各治疗组按下述方法制作EAE模型,用戊巴比妥钠(40 mg/kg)腹腔注射麻醉,两后足垫多点一次性注射 200μL抗原(含50μg MBP68-86、100μL IFA及2 mg MTB)免疫,诱导大鼠产生 EAE。正常组只注射等量生理盐水。
1.4 处理方法 左归丸组和右归丸组在大鼠造模后给予左归丸(2 g/kg)和右归丸(3 g/kg)灌胃,正常组、模型组、激素组(发病前)灌服相应剂量的生理盐水,激素组(发病后)给予醋酸泼尼松(0.006 g/kg)。各组均为1次/日,共28 d。分别在免疫后第7天(疾病初期)、第14天(急性期)、第28天(缓解期)取大鼠脑白质与脊髓组织,每组各5只,进行APP和GAP-43蛋白和基因的检测。其他动物另做其他指标的测定。
1.5 指标检测
1.5.1 Western-blot检测大鼠脑白质与脊髓中APP和GAP-43蛋白的表达 蛋白提取、定量及制备蛋白上样样品均按试剂盒说明书操作。进行SDS-PAGE电泳,90V通过浓缩胶,120 V通过分离胶,300 mA转膜80 min,立春红染色,5%脱脂奶粉摇床封闭1 h,加 APP(1∶10 000)、GAPDH(1∶8 000)、GAP-43(1∶10 000)抗体,4℃过夜,洗膜 5 min×4次,入山羊抗兔 IgG(1∶12 000),室温摇床孵育1 h,洗膜 5 min×6次,ECL孵育 5 min后,暗室胶片曝光,显影,定影。YLN-2 000凝胶影像分析系统扫描照片,Image J处理图片,Image Quant TL读取条带的积分光密度值,半定量分析各组蛋白表达。
1.5.2 实时荧光定量RT-PCR法检测大鼠脑白质与脊髓中APP和GAP-43m RNA的表达 RNA的提取和cDNA的合成均按试剂盒说明书操作,PCR引物序列见表1。PCR总体系12 μL,其组成为 RNA样品量2μg,OligoDT 1μL,DEPC水补至12μL。Real Time反应体系为:REAL SYBRMixture(2×)10μL,上游引物(10μmol/L)和下游引物(10μmol/L)各0.5μL,模板1.5μL,加入DEPC水量至20μL。反应条件为APP:95℃预变性5 min,95℃变性35 s,54℃退火35 s,每两个循环降1℃,72℃延伸60 s,循环40次,反应结束后,72℃延伸8 min,4℃保存。GAP-43和GAPDH:95℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸90 s,循环40次。反应结束后,72℃延伸10 min,4℃保存。实验数据数据采用△△Ct分析法。

表1 各项检测指标引物序列
2 结 果
2.1 各组大鼠脑白质和脊髓中APP的表达(见表2) 在脑白质中,免疫后第7天,其他各组EAE大鼠APP表达显著高于正常组(P<0.01),组间比较,差异无统计学意义;第 14天,模型组APP表达明显高于正常组(P<0.05),各治疗组APP表达较模型组有所降低,但差异无统计学意义;第28天,各组EAE大鼠APP表达显著低于正常组(P<0.01),且激素组APP水平低于模型组(P<0.05)。在脊髓中,免疫后第7天,模型组大鼠APP表达显著低于正常组(P<0.01),激素组与左归丸组显著提高 APP表达(P<0.01),且作用优于右归丸组(P<0.05);第14天、28天,各组之间比较差异无统计学意义。
表2 各组大鼠脑白质和脊髓中不同时间APP的变化( ±s)

表2 各组大鼠脑白质和脊髓中不同时间APP的变化( ±s)
组别 剂量g/kg第7天脑白质 脊髓第14天脑白质 脊髓第28天脑白质 脊髓正常组 - 1.00 1.00 1.00 1.00 1.00 1.00模型组 - 1.56±0.352) 0.48±0.132) 1.32±0.221) 1.13±0.30 0.40±0.112) 1.23±0.52激素组 0.006 1.67±0.322) 1.45±0.504)5) 1.14±0.22 1.19±0.34 0.22±0.092)3) 1.07±0.30左归丸组 2 1.69±0.722) 1.34±0.424)5) 1.01±0.18 0.98±0.27 0.24±0.152) 1.38±0.48右归丸组 3 1.83±0.722) 0.60±0.43 1.01±0.23 0.91±0.19 0.32±0.152) 0.95±0.33与正常组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05,4)P<0.01;与右归丸组比较,5)P<0.05
2.2 各组大鼠脑白质和脊髓中不同时间APP mRNA的变化(见表3) 在脑白质中,免疫后第7天,模型组大鼠APPmRNA表达显著低于正常组(P<0.01),各治疗组APP mRNA表达均高于模型组(P<0.05或P<0.01);第14天,模型组APPmRNA水平明显高于正常组(P<0.05),激素组和左归丸组APP m RNA表达均明显低于模型组(P<0.05),且左归丸组APP mRNA表达低于右归丸组(P<0.05);第28天,模型组APP mRNA显著高于正常组(P<0.05),左归丸组与右归丸组APP mRNA水平接近正常水平。在脊髓中,免疫后第14天,模型组APP m RNA表达显著低于正常组(P<0.01),左归丸组APP mRNA表达显著高于模型组和右归丸组(P<0.05或P<0.01)。
表3 各组大鼠脑白质和脊髓中不同时间APP m RNA的变化( ±s)
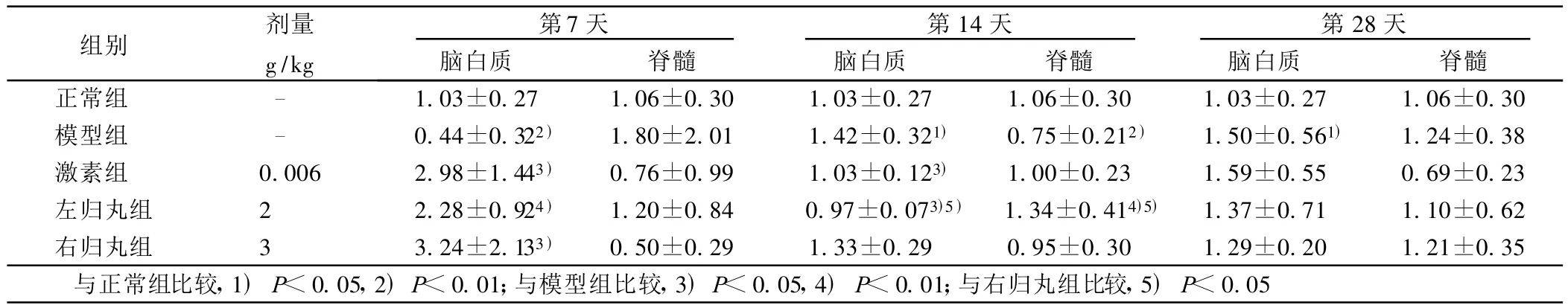
表3 各组大鼠脑白质和脊髓中不同时间APP m RNA的变化( ±s)
组别 剂量g/kg第7天脑白质 脊髓第14天脑白质 脊髓第28天脑白质 脊髓正常组 - 1.03±0.27 1.06±0.30 1.03±0.27 1.06±0.30 1.03±0.27 1.06±0.30模型组 - 0.44±0.322) 1.80±2.01 1.42±0.321) 0.75±0.212) 1.50±0.561) 1.24±0.38激素组 0.006 2.98±1.443) 0.76±0.99 1.03±0.123) 1.00±0.23 1.59±0.55 0.69±0.23左归丸组 2 2.28±0.924) 1.20±0.84 0.97±0.073)5) 1.34±0.414)5) 1.37±0.71 1.10±0.62右归丸组 3 3.24±2.133) 0.50±0.29 1.33±0.29 0.95±0.30 1.29±0.20 1.21±0.35与正常组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05,4)P<0.01;与右归丸组比较,5)P<0.05
2.3 各组大鼠脑白质和脊髓中GAP-43的表达(见表4) 免疫后第7天,在脑白质中,模型组GAP-43表达降低(P<0.05),各治疗组均能升高GAP-43表达水平,激素组与左归丸组作用最为明显(P<0.05);第14天,模型组GAP-43表达显著高于正常组(P<0.01),激素组与左归丸组能显著抑制GAP-43的过高表达(P<0.05);第28天,模型组GAP-43水平均低于正常组(P<0.05),激素组与左归丸组GAP-43水平显著低于模型组(P<0.01),且显著低于右归丸组(P<0.01)。在脊髓中,免疫后第7天,模型组GAP-43水平显著降低(P<0.01),激素组与左归丸组GAP-43表达水平显著高于模型组与右归丸组(P<0.05或 P<0.01);第28天,模型组、激素组和右归丸组GAP-43表达均显著低于正常组(P<0.01),左归丸组GAP-43表达水平与正常组比较无统计学意义。
表4 各组大鼠脑白质和脊髓中不同时间GAP-43的变化( ±s)
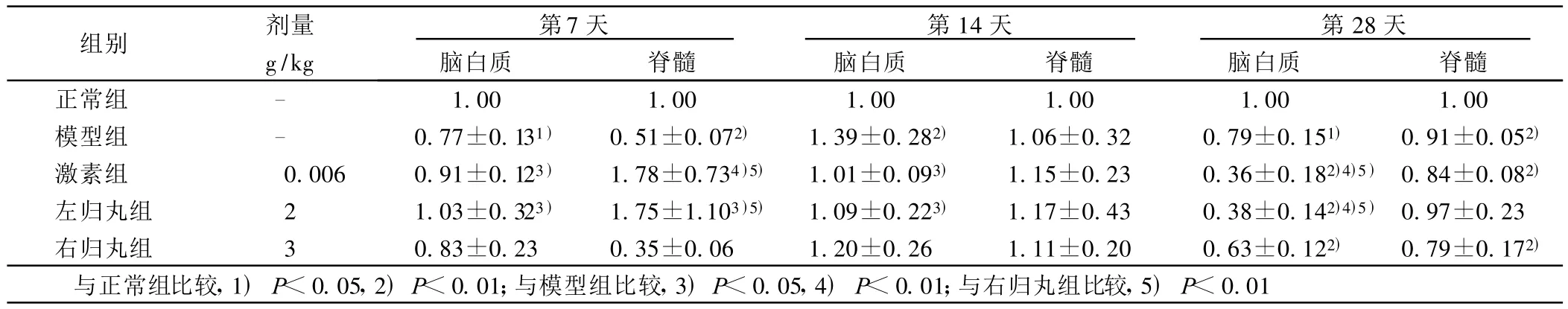
表4 各组大鼠脑白质和脊髓中不同时间GAP-43的变化( ±s)
组别 剂量g/kg第7天脑白质 脊髓第14天脑白质 脊髓第28天脑白质 脊髓正常组 - 1.00 1.00 1.00 1.00 1.00 1.00模型组 - 0.77±0.131) 0.51±0.072) 1.39±0.282) 1.06±0.32 0.79±0.151) 0.91±0.052)激素组 0.006 0.91±0.123) 1.78±0.734)5) 1.01±0.093) 1.15±0.23 0.36±0.182)4)5) 0.84±0.082)左归丸组 2 1.03±0.323) 1.75±1.103)5) 1.09±0.223) 1.17±0.43 0.38±0.142)4)5) 0.97±0.23右归丸组 3 0.83±0.23 0.35±0.06 1.20±0.26 1.11±0.20 0.63±0.122) 0.79±0.172)与正常组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05,4)P<0.01;与右归丸组比较,5)P<0.01
2.4 各组大鼠脑白质和脊髓中不同时间GAP-43 mRNA的变化(见表5) 在脑白质中,免疫后第 7天,模型组与激素组GAP-43 mRNA水平较正常组显著升高(P<0.05或P<0.01),右归丸组GAP-43 mRNA表达水平显著低于模型组(P<0.05);第14天,模型组GAP-43 m RNA表达显著低于正常组(P<0.05);第28天,各组 GAP-43 mRNA水平无明显变化。在脊髓中,各组在不同时间点GAP-43 mRNA水平无显著性的变化。
表5 各组大鼠脑白质和脊髓中不同时间GAP-43 m RNA的变化( ±s)

表5 各组大鼠脑白质和脊髓中不同时间GAP-43 m RNA的变化( ±s)
组别 剂量g/kg第7天脑白质 脊髓第14天脑白质 脊髓第28天脑白质 脊髓正常组 - 1.17±0.68 1.09±0.47 1.17±0.68 1.09±0.47 1.17±0.68 1.09±0.47模型组 - 2.07±0.621) 1.54±1.14 0.72±0.221) 0.94±0.19 0.86±0.41 1.33±0.18激素组 0.006 2.39±0.982) 1.14±1.57 0.65±0.25 0.88±0.38 1.05±0.29 1.04±0.09左归丸组 2 1.51±1.12 1.39±1.31 0.60±0.30 0.92±0.23 1.29±0.49 1.23±0.43右归丸组 3 0.88±0.233) 0.89±0.86 0.90±0.29 0.87±0.13 1.09±0.36 1.06±0.20与正常组比较,1)P<0.05,2)P<0.01;与模型组比较,3)P<0.05
3 讨 论
MS及EAE在疾病早期就有广泛的轴突损害,持续性轴突的损伤导致了不可逆性神经功能障碍[7],现有的各种治疗手段仅能起到延缓而不能阻止其发展。近年来研究发现中医药能改善MS患者神经症状,调节免疫功能,减少复发率,弥补西医治疗的不足[8]。中医学认为本病与“痿证”中的“骨痿”极为相似,病位在脑髓,肾虚是MS的根本病机。周莉等[9]发现MS早期或急性期以肝肾阴虚为主,晚期或晚发型MS以脾肾阳虚或阴阳两虚为主。因此补肾为治病大法,滋阴可选用左归丸,温阳可选右归丸[10],二方均有益髓填精之功。现代药理研究表明左右归丸对中枢神经系统具有调节作用,且左归丸能促进骨髓再生[11]。前期实验研究发现,二方对EAE大鼠的中枢神经系统的神经生长因子(nerve growth factor,NGF)、GAP-43和轴突生长抑制因子NogoA等均具有调节作用,有利于神经再生[5,6]。本实验重点观察左归丸和右归丸对EAE大鼠APP与GAP-43蛋白与基因表达的作用,探讨左归丸和右归丸对EAE保护的可能机制及比较两方药作用的异同。
APP是轴突损伤后的一种快速反应性蛋白[12],并以前体蛋白及多种裂解产物的形式在神经组织损伤、修复中发挥重要作用[13]。研究发现,EAE小鼠在发病急性期大脑APP强阳性表达[14]。本课题组前期研究发现,EAE大鼠在免疫后第14天脑白质中APP表达升高,第28天表达下降且低于正常水平[15]。本次研究发现,APP和APPmRNA在EAE大鼠脑白质和脊髓中呈动态变化,且蛋白和基因的表达不同步。APP表达升高可能与炎症产生的白细胞介素-1刺激 APP蛋白表达增多有关[16],或是由于轴突损伤后轴浆中APP运输中断导致其堆积。APP蛋白表达降低可能与细胞膜构象的改变有关[15]。经药物治疗后,激素与左归丸均对升高或降低的APP和APP m RNA具有一定的调节作用,且左归丸对其的调节作用明显优于右归丸。由于APP的生理功能很复杂,APP的过高或过低表达对机体可能是不利的,目前对APP在不同类型及不同损伤程度的神经损伤模型中的研究报道还较少,左右归丸对其调节的机制还有待深入探讨。
GAP-43在神经元发育和轴突生长时高水平表达[17],神经元损伤后,其周围的神经元可通过侧支发芽和反应性轴突再生进行功能代偿,这些区域GAP-43水平表达再次升高[18,19],当轴突到达相应的靶组织时,突触重塑完成,GAP-43水平迅速降低,乃至消失,轴突生长停止[20]。有报道称GAP-43 m RNA在EAE小鼠脊髓中高表达[21]。GAP-43的表达与GAP-43 mRNA的表达存在不同步性[22]。本实验也发现GAP-43 m RNA在疾病初期明显升高,GAP-43的升高滞后于GAP-43 mRNA。GAP-43 mRNA的过高表达可导致细胞凋亡[23],而发生细胞凋亡的区域神经元中GAP-43水平显著降低[24]。本实验发现,EAE模型大鼠脑白质和脊髓中GAP-43在疾病初期表达降低,急性期升高,缓解期又有所下降,而脑白质中GAP-43 mRNA的表达在疾病初期升高,急性期降低。治疗组对GAP-43和GAP-43 m RNA的表达具有一定的调节作用。激素与左归丸能显著调节脑白质和脊髓中GAP-43的过低或过高表达。缓解期GAP-43水平的快速回落,提示激素与左归丸治疗有利于损伤后轴突再生修复,缩短突触重塑时间。右归丸能明显抑制疾病初期脑白质中GAP-43 mRNA的过高表达。以上结果表明,激素、左归丸和右归丸均能在不同时间点对GAP-43和GAP-43 m RNA的表达具有一定调节作用,但调节靶点存在差异,左归丸在调节GAP-43表达方面作用明显优于右归丸。可能与二方中所含滋阴药与温阳药的比例不同有关。右归丸对EAE的防治机制可能通过其他途径实现的。今后还需要深入研究其促进轴突再生的信号转导通路,为临床运用滋阴补肾或温阳补肾法治疗MS提供科学内涵。
[1] Herz J,Zipp F,Siffrin V.Neurodegeneration in autoimmune CNS inflammation[J].Exp Neurol,2010,225(1):9-17.
[2] Mix E,Meyer-Rienecker H,Hartung HP,et al.Animal models of multiple sclerosis-potentials and limitations[J].Prog Neurobiol,2010,92(3):386-404.
[3] 宋丽君,樊永平.补肾为主辨证论治对急性期多发性硬化患者血浆细胞因子的影响[J].中华中医药杂志,2010,25(5):745-748.
[4] 樊永平,王平,张星虎,等.二黄方治疗多发性硬化急性发作的临床观察[J].北京中医药大学学报,2006,29(4):273-276.
[5] 王蕾,樊永平,龚海洋,等.左归丸和右归丸对实验性变态反应性脑脊髓炎大鼠髓鞘及轴突再生的影响[J].中国实验方剂学杂志,2008,14(4):42-45.
[6] Wang L,Zhao H,Fang YP,et al.Research on the mechanism of Zuogui Pill and Yougui Pill in promoting ax onal regeneration in model rats of autoimmune encep halomyelitis[J].Chin J Integr Med,2010,16(2):167-172.
[7] Vogt J,Paul F,Aktas O,et al.Lower motor neuron loss in multip le sclerosis and experimental autoimmune encephalomyelitis[J].Ann Neurol,2009,66(3):310-322.
[8] 中华医学会神经病学分会神经免疫学组,中国免疫学会神经免疫分会.中国多发性硬化诊断和治疗专家共识[J].中华神经科杂志,2010,43(7):516-521.
[9] 周莉,樊永平,叶明.59例多发性硬化患者不同中医证型的免疫学研究[J].中国中西医结合杂志,2007,27(4):599-601.
[10] 樊永平.中医药辨证治疗多发性硬化的优势与不足[J].北京中医,2005,24(4):209-211.
[11] 王义周,刘妍,王蕾.左归丸与右归丸的药理研究进展[J].浙江中医药大学学报,2010,34(1):116-117;119.
[12] Hortobágyi T,Wise S,Hunt N,et al.Traumatic axonal damage in the brain can be detected using beta-APP immunohistochemistry within 35 min after head injury to human adults[J].Neuropathol Appl Neurobiol,2007,33(2):226-237.
[13] Herrero-Herranz E,Pardo LA,Gold R,et al.Pattern of axonal injury in murine myelinoligodendrocytegly coprotein induced experimental autoimmune encephalomyelitis,implications for multip le sclerosis[J].Neurobiol Dis,2008,30(2):162-173.
[14] Shang XL,Gao Y,Yin L,et al.Effects of Yishendaluo decoction on axonal degeneration,inflammatory reaction,and neurological function in a mouse model of ex perimental autoimmune encephalomyelitis[J].Neural Reg Res,2009,4(11):928-934.
[15] Wang YZ,Kou S,Tang JC,et al.Amy loid precursor protein and growth-associated p rotein 43 expression in brain brain and spinal cord tissues in a rat model of experimental autoimmune encephalomyelitis[J].Neural Reg Res,2011,6(2):102-106.
[16] Yang Y,Quitschke WW,Brewer GJ.Upregulation of amyloid precursor protin gene p romoter in rat primary hippocampal neurons by phorbol cster,IL-1 and retinoic acid,but not by reactive oxygen species[J].Brain Res Mol Brain Res,1998,60(1):40-49.
[17] Casoli T,Stefano GD,Fattoretti P,et al.GAP-43 mRNA detection by in situ hybridization,direct and indirect in situ RT-PCRin hippocampal and cerebellar tissue sections of adult rat brain[J].Micron,2003,34(8):415-422.
[18] 杜秀民,张笛,刘广义.局灶性脑缺血再灌注损伤后存活素与生长相关蛋白-43表达抑制神经细胞凋亡的实验[J].中国组织工程研究与临床康复,2007,11(25):4927-4930.
[19] Gómez M,Hernández ML,Pazos MR,et al.Colocalization of CB1 receptorswith L1 and GAP-43 in forebrain white matter regions during fetal rat brain development:Evidence for a role of these receptorsin axonal growth and guidance[J].Neurosci,2008,153(3):687-699.
[20] Jutapakdeegul N,Afadlal S,Polaboon N,et al.Repeated restraint stress and corticosterone injections during late pregnancy alter GAP-43 exp ression in the hippocampus and prefrontal cortex of rat pup s[J].Int J Dev Neurosci,2010,28(1):83-90.
[21] Garay L,Deniselle MC,Meyer M,et al.Protective effects of progesterone administration on ax onal pathology in mice with experimental autoimmune encephalomyelitis[J].Brain Res,2009,1283:177-185.
[22] Van der Zee CE,Nielander HB,Vos JP,et al.Expression of growth-associated p rotein B-50(GAP43)in dorsal root ganglia and sciatic nerve during regenerative sprouting[J].J Neurosci,1989,9(10):3505-3512.
[23] Aigner L,Caroni P.Absence of persistent spreading,branching,and adhesion in GAP-43-depleted growth cones[J].J Cell Biol,1995,128(4):647-660.
[24] Callahan LM,Coleman PD.Neurons bearing neurofibrillary tangles are responsible for selected synaptic deficits in Alzheimer’s disease[J].Neurobiol Aging,1995,16(3):311-314.

