氨氮胁迫对三疣梭子蟹消化酶活力的影响
徐武杰,潘鲁青**,岳 峰,李 健
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.中国水产科学研究院黄海水产研究所,山东青岛266071)
氨氮胁迫对三疣梭子蟹消化酶活力的影响
徐武杰1,潘鲁青1**,岳 峰1,李 健2
(1.中国海洋大学海水养殖教育部重点实验室,山东青岛266003;2.中国水产科学研究院黄海水产研究所,山东青岛266071)
以三疣梭子蟹(Portunus trituberculatus)为研究对象,研究氨氮胁迫对中肠腺、胃、肠组织消化酶活力的影响。实验设计对照组(自然海水)、1、5、20 mg/L处理组,分别于氨氮胁迫后0、6、12、24、48 h取样进行消化酶活力的测定。结果表明:氨氮胁迫对三疣梭子蟹类胰蛋白酶、胃蛋白酶、脂肪酶和淀粉酶活力影响显著(P<0.05),而对照组无明显变化。各处理组3种消化器官中类胰蛋白酶、胃蛋白酶活力在48 h内呈峰值变化,其中3种消化器官中类胰蛋白酶活力在48 h时恢复至对照组水平,而中肠腺胃蛋白酶活力在24 h后趋于稳定,且与氨氮浓度呈明显正相关,胃和肠的胃蛋白酶活力分别于48和24 h时恢复至对照组水平。各处理组中肠腺和胃的脂肪酶活力在24 h内均呈现明显的峰值变化,24 h后中肠腺中脂肪酶活力趋于稳定,且与氨氮浓度呈明显正相关,而胃中脂肪酶活力逐渐下降,至48 h时恢复至对照组水平。各处理组中肠腺和肠的淀粉酶活力在12 h内呈逐渐下降趋势,12 h后趋于稳定,且与氨氮浓度呈明显负相关;各处理组胃的淀粉酶活力呈现先升高后降低趋势,24 h后趋于稳定。同时在氨氮胁迫48 h时,对中肠腺和胃的胃蛋白酶、脂肪酶活力均表现为明显的诱导作用,而对3种消化器官中淀粉酶活力表现为明显的抑制作用。由此说明,三疣梭子蟹在氨氮胁迫下中肠腺中胃蛋白酶、脂肪酶活力和3种消化器官中淀粉酶活力可作为消化吸收能力的评价指标。
氨氮胁迫;三疣梭子蟹;消化酶活力
氨氮是养殖水环境中重要的污染胁迫因子,它不仅能直接损害甲壳动物的器官组织[1-2],并能渗入血淋巴中产生毒害作用[3],严重影响甲壳动物的生理代谢功能[4-8]。三疣梭子蟹(Portunus trituberculatus)属大型底栖蟹类,是我国沿海重要的养殖种类,在养殖过程中主要以投喂新鲜的小杂鱼虾为主,易污染水质,近年来由于养殖密度加大、投食过多,积累的残饵、代谢废物等有机物在微生物的氨化作用下不断形成氨氮,导致氨氮浓度逐渐增大,已成为三疣梭子蟹生长、存活的重要胁迫因子。甲壳动物中肠腺是主要的消化和解毒代谢器官,已有研究表明甲壳动物在氨氮胁迫下中肠腺通过分泌大量的解毒代谢酶类来降低氨氮的毒害作用[8-10],同时氨氮胁迫也引起中肠腺细胞组成、数量发生变化,对细胞结构产生损伤效应,严重影响了消化酶分泌等生理功能[1,11]。动物消化酶活力的高低直接反映了其对营养物质消化吸收利用的能力,从而决定动物的生长发育的速度,目前有关氨氮对甲壳动物消化酶活力的影响尚未见报道。本文研究了氨氮胁迫对三疣梭子蟹消化器官中类胰蛋白酶、胃蛋白酶、脂肪酶和淀粉酶活力的影响,探讨了氨氮胁迫对三疣梭子蟹消化生理的影响机制,旨在筛选三疣梭子蟹在氨氮胁迫下消化吸收能力的评价指标,为三疣梭子蟹健康养殖的水环境管理技术提供科学依据。
1 材料与方法
1.1 实验材料
实验所用三疣梭子蟹购自青岛市沙子口码头,全甲宽为(12.2±0.58)cm,甲长为(5.7±0.19)cm,体质量为(104.8±9.6)g,体色正常,健康活泼。实验前暂养10 d,海水盐度为31,p H=8.2,温度为(15± 0.5)℃,氨氮为(0.08±0.02)mg·L-1,连续充气,日换水2次,换水量为1/2~2/3,并按体质量的10%投喂新鲜的菲律宾蛤仔。
1.2 实验梯度设置
根据Chen和钟硕良等[12-13]测定海水养殖池塘底层水的氨氮浓度分别为0~46 mg·L-1和0.01~29.3 mg·L-1,实验设置4个氨氮梯度,分别为0(对照组,自然海水)、1、5、20 mg·L-1,各梯度采用10 g·L-1的氯化铵溶液进行调节。实验在136 cm×90 cm×70 cm的塑料水槽内进行,将暂养在自然海水中健康的三疣梭子蟹饥饿48 h后,随机移入各实验梯度中,每个水槽分别放三疣梭子蟹15只,每个梯度均设3个平行组,实验期间不投喂饵料,并且养殖管理与暂养期间完全相同,换水时分别加入相应氨氮浓度的养殖用水。在实验过程中每隔6 h采用次溴酸盐氧化法[14]测定1次氨氮浓度,实测值分别为(0.08±0.01)、(1.20± 0.08)、(5.37±0.10)、(21.26±0.35)mg·L-1。实验期间三疣梭子蟹无死亡现象,取样时间为0、6、12、24和48 h。
1.3 样品的采集与制备
每个水槽随机取3只蟹,置冰盘内解剖,取出完整的中肠腺、胃和肠,分别剪开胃和肠,用预冷超纯水(0~4℃,p H=6.8)将内容物冲洗掉,用滤纸轻轻吸干水分,分别保存于-80℃冰箱中。
分别取湿质量为100 mg左右的中肠腺、胃、肠样品,加入10倍体积(质量浓度)预冷超纯水,置于冰浴中用匀浆机以转速10 000 r/min匀浆5 min,取部分匀浆液直接用于测定脂肪酶活力,其余匀浆液用高速冷冻离心机(0~1℃)以10 000 r/min离心30 min,取上清液用于类胰蛋白酶、胃蛋白酶、淀粉酶活力的测定。
1.4 酶活力的测定
类胰蛋白酶和胃蛋白酶活力测定:参照文献[15]的方法。加入以0.2 mol·L-1磷酸盐缓冲液(p H= 8.4)配置的0.5%酪蛋白2.0 mL,0.04 mol·L-1EDTA-Na20.1 mL,酶液0.4 mL,并加入超纯水0.5 mL,使总体积为3.0 mL,混匀,置于55℃水浴中反应15 min,然后加入30%三氯醋酸1.0 mL终止反应;离心(0~1℃,3 000 r/min)15 min,取上清液1 mL,加入0.55 mol·L-1碳酸钠溶液2.5 mL,再加入福林试剂0.5 mL,37℃水浴中显色15 min,在680 nm波长下测定光密度(O.D.)值,得生成酪氨酸质量。类胰蛋白酶活力定义为:在55℃下,每分钟水解酪蛋白所产生的1μg酪氨酸作为1个酶活力单位U(μg/min)。
胃蛋白酶活力测定基本上同类胰蛋白酶,所用缓冲液改为0.2 mol·L-1柠檬酸缓冲液(p H=3.0)。
脂肪酶活力测定:参考文献[16]的方法并作适当改进。取1.5 mL 0.066 7 mol·L-1磷酸盐缓冲溶液(p H=7.38)和0.5 mL橄榄油,放入37℃水浴恒温磁力搅拌器中预热5 min,加入0.5 mL酶液,磁力搅拌10 min,立即加入4 mL甲苯,继续搅拌2 min,终止反应;然后在4 000 r/min下离心10 min,取上层有机相2 mL于小锥形瓶中,加入5%(质量浓度)醋酸铜溶液0.5 mL,磁力搅拌3 min,4 000 r/min下离心10 min,取上层含有绿色脂肪酸铜的甲苯溶液,在710 nm波长下测定光密度(O.D.)值,并计算脂肪酸浓度。脂肪酶活力单位定义为:在37℃下,每分钟催化橄榄油释放出1μmol脂肪酸作为1个酶活力单位U(μmol/min)。按下式计算酶活力:
X=(c·V)/(t·V′)
式中:X为脂肪酶活力(U),c为脂肪酸浓度(μmol·mL-1),V为脂肪酸萃取液的体积(mL),V′为酶液的用量(mL);t为作用时间(min)。
淀粉酶活力测定:参照文献[15]的方法。加入用0.066 7 mol·L-1磷酸盐缓冲液(p H=7.5)配制的1%淀粉溶液0.5 mL,置于65℃恒温水浴中,加入超纯水0.3 mL,酶液0.2 mL,摇匀,保温3 min后立即加入3,5-二硝基水杨酸指示剂溶液2.0 mL,摇匀后置于沸水浴5 min,取出进行流水冷却,用超纯水定容至10 mL,在540 nm波长下测定光密度(O.D.)值,计算生成麦芽糖质量。淀粉酶活力单位定义为:在65℃下,每分钟催化淀粉生成1 mg麦芽糖作为1个酶活力单位U(mg/min)。
酶液蛋白浓度测定:以牛血清蛋白为标准物,采用考马斯亮蓝法测定[17]。
1.5 数据处理与分析
所有实验数据均以平均值±标准误(mean±S. E.)表示,并用SPSS11.0软件进行单因素方差分析(ANOVA)和Duncan检验法统计分析。
2 结果
2.1 氨氮胁迫对三疣梭子蟹类胰蛋白酶和胃蛋白酶活力的影响
由图1、2可看出,氨氮胁迫对三疣梭子蟹类胰蛋白酶和胃蛋白酶活力影响显著(P<0.05),而对照组无明显变化。各处理组中肠腺的类胰蛋白酶、胃蛋白酶活力在48 h内呈峰值变化,分别于24和12 h时达到最小值和最大值,其中类胰蛋白酶活力在48 h时恢复至对照组水平,而胃蛋白酶活力在24 h后趋于稳定,且与氨氮浓度呈明显正相关;各处理组胃和肠的类胰蛋白酶、胃蛋白酶活力在48 h内也呈明显的峰值变化,均于12 h时达到最大值,2种消化器官中类胰蛋白酶活力于48 h时恢复至对照组水平,而胃蛋白酶活力分别于48、24 h时恢复至对照组水平。
2.2 氨氮胁迫对三疣梭子蟹脂肪酶活力的影响
图3表明,氨氮胁迫对三疣梭子蟹中肠腺和胃的脂肪酶活力的影响显著(P<0.05),而对照组无明显变化;肠中脂肪酶活力很低,实验未检出。各处理组2种消化器官中脂肪酶活力在24 h内均呈现明显的峰值变化,均于12 h达到最大值,24 h后中肠腺的脂肪酶活力趋于稳定,且与氨氮浓度呈明显正相关;而胃的脂肪酶活力逐渐下降,至48 h时恢复至对照组水平。
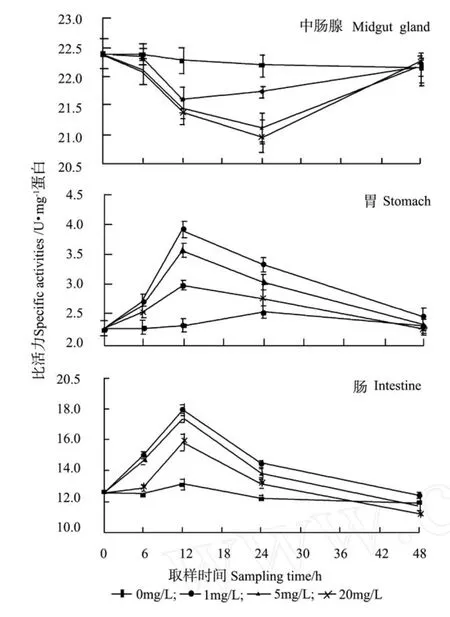
图1 氨氮胁迫对三疣梭子蟹类胰蛋白酶活力的影响Fig.1 Time course changes of Trypsin-like enzyme activities of swimming crabPortunus trituberculatus exposed to ambient ammonia

图3 氨氮胁迫对三疣梭子蟹脂肪酶活力的影响Fig.3 Time course changes of lipase activities of swimming crabPortunus trituberculatusexposed to ambient ammonia
2.3 氨氮胁迫对三疣梭子蟹淀粉酶活力的影响
由图4可知,氨氮胁迫对三疣梭子蟹淀粉酶活力影响显著(P<0.05),而对照组无显著变化。各处理组中肠腺和肠的淀粉酶活力在12 h内呈逐渐下降趋势,在12 h时降至最低值,12 h后趋于稳定,且与氨氮浓度呈明显负相关;各处理组胃的淀粉酶活力呈现先升高后降低趋势,于12 h达到最大值,在24~48 h内酶活力被抑制,且趋于稳定,1、5与20 mg·L-1处理组差异显著。
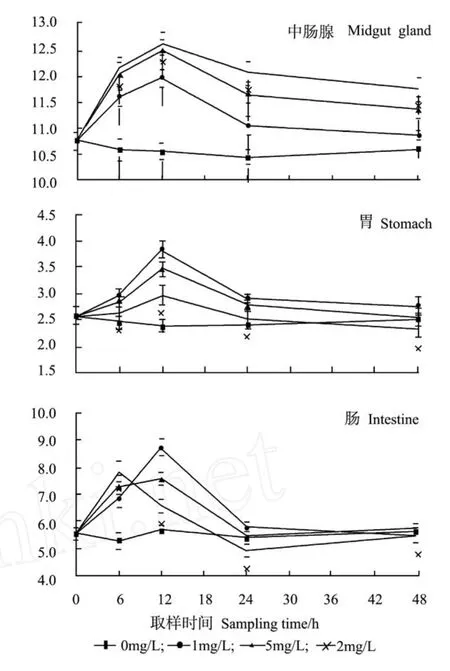
图2 氨氮胁迫对三疣梭子蟹胃蛋白酶活力的影响Fig.2 Time course changes of pepsin activities of swimming crabPortunus trituberculatusexposed to ambient ammonia
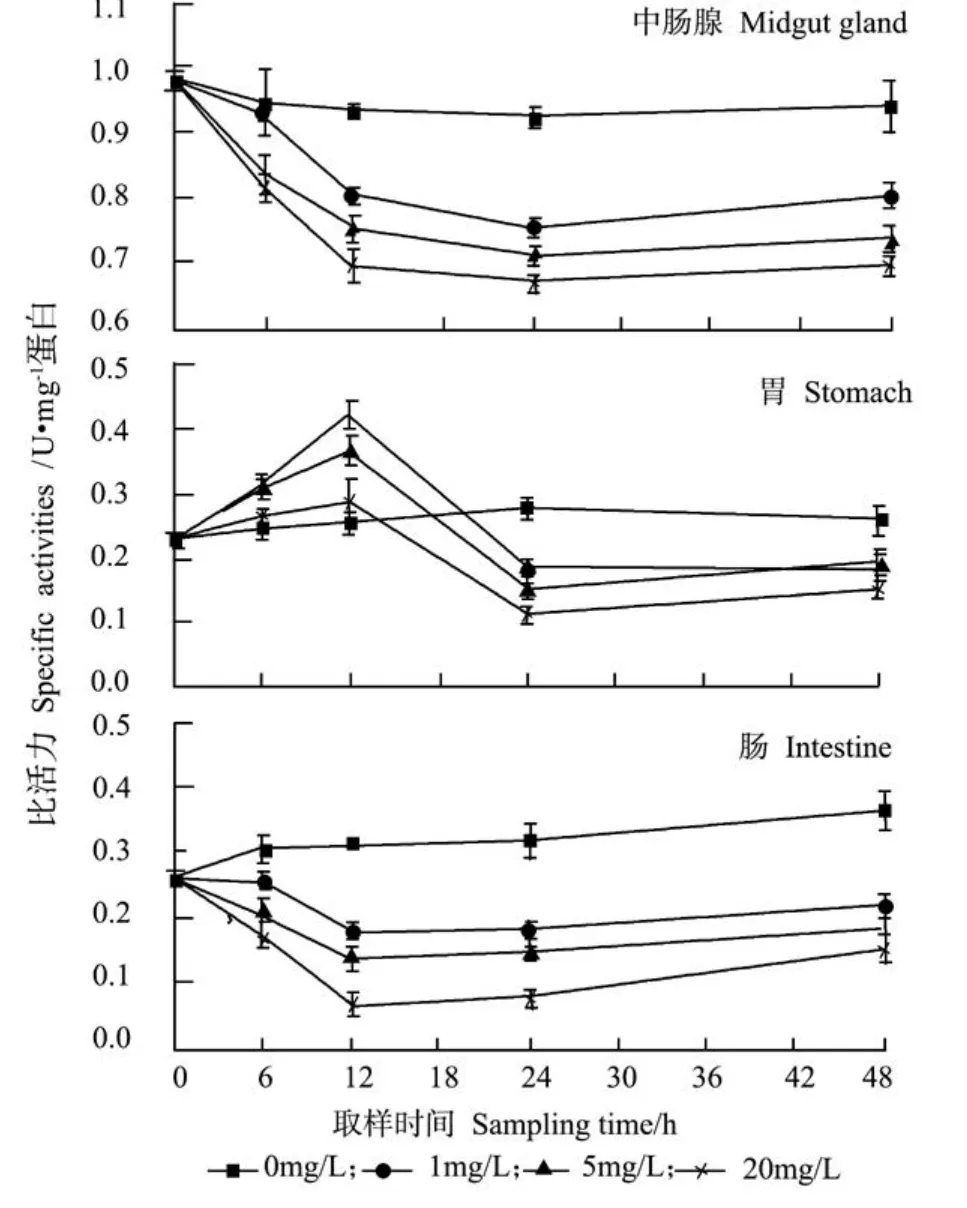
图4 氨氮胁迫对三疣梭子蟹淀粉酶活力的影响Fig.4 Time course changes of amylase activities of swimming crabPortunus trituberculatusexposed to ambient ammonia
2.4 三疣梭子蟹在氨氮胁迫下消化酶的活性分布
由表1可见,三疣梭子蟹不同消化器官中消化酶活力不同,3种消化器官中类胰蛋白酶、胃蛋白酶和淀粉酶活力大小均为:中肠腺>肠>胃,而中肠腺、胃的脂肪酶活力大小相近;在氨氮胁迫48 h时,对中肠腺和胃的胃蛋白酶、脂肪酶活力影响显著,均表现为明显的诱导作用,而对3种消化器官中淀粉酶活力均表现为明显的抑制作用。
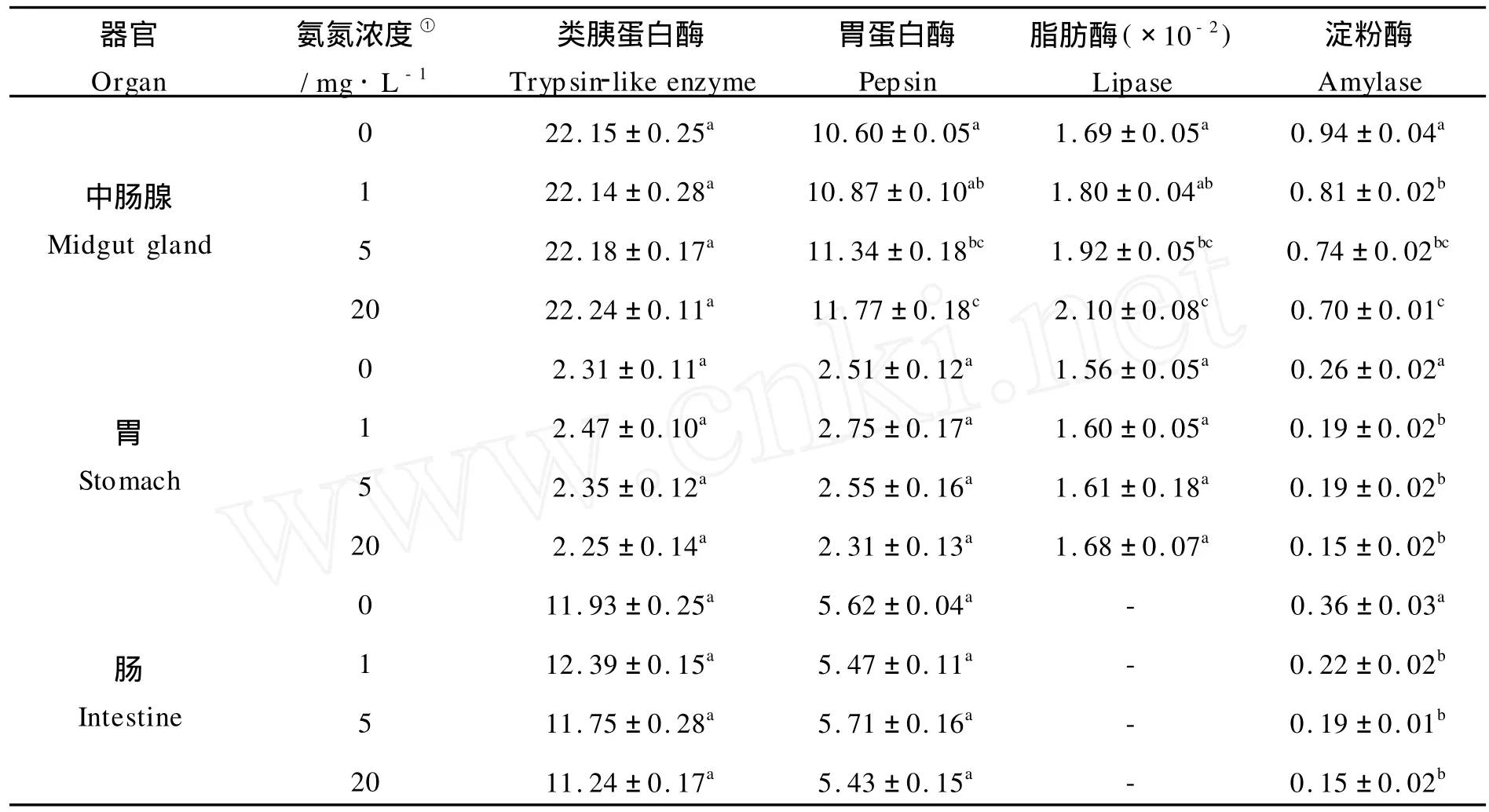
表1 在氨氮胁迫48 h时三疣梭子蟹消化器官中消化酶的活性分布Table 1 Distribution of the digestive enzymes of different digestive organs ofPortunus trituberculatus exposed to ambient ammonia for 48 h(mean±S.E)
3 讨论
3.1 氨氮胁迫对三疣梭子蟹消化酶活力的影响
据王维娜等[18]报道在不同p H(7.6~9.8)水环境中饲养14 d时,日本沼虾(Macrobrochium nipponense)中肠腺类胰蛋白酶和胃蛋白酶活力随着p H值升高而升高,均于p H为9.8时达到最大值;杨志彪等[19]研究发现在Cu2+(0.01~5.00 mg·L-1)作用10 d后,中华绒螯蟹(Eriocheir sinensis)中肠腺类胰蛋白酶、胃蛋白酶和淀粉酶活力随Cu2+浓度升高均有不同程度降低,而脂肪酶活力随着Cu2+浓度升高而显著升高。据Antoine[20]报道欧洲海鲈(Dicentrarchus labrax)在氨氮(0.53~16.11 mg·L-1)慢性胁迫下饲料转化率随着氨氮浓度升高而升高。本研究表明三疣梭子蟹在氨氮胁迫下3种消化器官中消化酶活力均呈现明显的峰值变化,至24和48 h时趋于稳定或恢复至对照组水平,稳定后各处理组中肠腺胃蛋白酶、脂肪酶活力和3种消化器官淀粉酶活力分别与氨氮浓度呈明显正、负相关性,表现出明显的时间、剂量效应关系,这与上述环境胁迫对甲壳动物消化酶活力影响的研究结果基本类似。同时本实验中1 mg·L-1氨氮处理组(相当于非离子氨浓度0.033 mg·L-1)接近《国家标准渔业水质标准》(GB11607-89)非离子氨浓度允许范围上限0.020 mg·L-1,对消化酶活力也产生显著性影响,这说明消化酶活力可以灵敏地反映出三疣梭子蟹在氨氮胁迫下消化吸收能力的变化。因此,作者认为三疣梭子蟹在氨氮胁迫下中肠腺中胃蛋白酶、脂肪酶活力和3种消化器官中淀粉酶活力可作为消化吸收能力的评价指标。
3.2 氨氮胁迫对三疣梭子蟹消化生理的影响机制
甲壳动物因环境胁迫或刺激产生一系列的生理防御反应,当超出机体自身特定的生理代谢机能时,可启动机体的代谢补偿功能以适应外界环境的变化,最终产生应激适应。本研究显示在氨氮胁迫范围内,除中肠腺类胰蛋白酶活力表现为明显的抑制作用外,三疣梭子蟹3种消化器官中类胰蛋白酶、胃蛋白酶和脂肪酶活力在12 h时均达到最大值,表现出明显的诱导作用,而且胃、肠中蛋白酶的诱导作用随胁迫浓度增大而降低,而脂肪酶呈现相反的趋势。已有研究表明甲壳动物受到氨氮胁迫产生应激反应,耗氧量增多,能量需求增加,生理代谢发生相应的变化[4-8];Stebbing[21]认为在毒物作用下生物酶出现的这种增益现象,是在无毒情况下的1种刺激反应,并把这一现象称为“毒物兴奋效应”。这说明三疣梭子蟹因氨氮胁迫短时间内消化酶活力升高,提高了机体的消化吸收利用能力,可能是用于补偿因环境应激所需的能量消耗,满足机体应激代谢的能量需求,同时这种“毒物兴奋效应”在胃、肠中对不同消化酶的诱导表现不同,这主要是因为“毒物兴奋效应”不仅与氨氮胁迫浓度有关,而且不同消化酶对氨氮胁迫的生理适应程度也有差异,由此在生理代谢补偿适应机制方面有待进一步研究。
据Kleber等[22]报道圣保罗对虾(Farf antepenaeus paulensis)幼虾在低浓度氨氮(0.016~0.287 mg·L-1)长期暴露下,能量代谢同样发生显著改变,表现为机体脂质含量显著减少,碳水化合物含量显著增多;Hong等[8]研究表明暴露于氨氮(20~80 mg·L-1)48 h时,中华绒螯蟹幼蟹会通过减少碳水化合物的代谢,同时增加脂质利用来满足机体代谢需求,这与Racotta等[7]将凡纳滨对虾(L itopenaeus vannamei)幼虾置于氨氮(0.36~2.14 mmol/L)暴露24 h时的代谢反应是一致的;Chen等[23]研究发现在氨氮(0.994~20.728 mg· L-1)胁迫24 h时,斑节对虾(Penaeus monodon)血淋巴中总蛋白浓度也会显著下降。本实验表明在氨氮胁迫48 h时,三疣梭子蟹中肠腺胃蛋白酶、脂肪酶活力表现为明显的诱导作用,而3种消化器官淀粉酶活力呈现显著的抑制作用,这与上述研究结果是相符的。另有Chen等[10]研究显示随着氨氮胁迫时间的延长(24 h后),斑节对虾可能会通过中肠腺等组织的解毒代谢来降低氨氮的毒害作用;张克俭[1]研究发现在不同浓度氨氮(2.44~11.44 mg·L-1)作用7.5 d时,中国对虾(Fenneropenaeus chinensis)肝胰脏最明显的变化就是肝管的吸收细胞部分或全部转变成分泌细胞,致使肝管壁中的分泌细胞增多,分泌细胞内出现很多的分泌小泡,而分泌小泡内含有多种酶类,具有分解消化有机大分子物质和部分解毒代谢作用。由此说明甲壳动物在氨氮胁迫下可以通过调节消化酶和解毒代谢酶的合成与分泌,提高对蛋白质和脂质的消化吸收能力,降低对糖类的消化利用,从而满足机体的能量代谢和解毒代谢的需求。作者认为氨氮胁迫对甲壳动物中肠腺、胃和肠3种消化酶活力产生不同的影响,不仅与甲壳动物对氨氮的解毒代谢有关,也与消化酶的酸碱特性相关,如许多学者研究表明随着水环境中氨氮浓度升高,甲壳动物血淋巴及中肠腺中氨氮浓度增加,氨氮排泄减少,从而导致血淋巴或中肠腺等组织中p H出现变化[9-10,24-25],由此引起消化酶活力出现相应变化,其影响机制尚需进一步研究。
[1] 张克俭.锌和氨氮对对虾肝胰脏的毒性作用[J].水产学报, 1993,17(1):52-59.
[2] Rebelo M F,Rodriguez E M,Santos E A.Histopathological changes in gills of the estuarine crabChasmagnathus granulate (Crustacea-Decapoda)following acute exposure to ammonia[J]. Comparative Biochemistry and Physiology,2000,25C:157-164.
[3] Rebelo M F,Santos E A,Monserrat J M.Ammonia exposure of Chasmagnathus granulata(Crustacea,Decapoda)Dana,1851:accumulation in haemolymph and effects on osmoregulation[J]. Comparative Biochemistry and Physiology,1999,122A:429-435. [4] Chen J C,S H Lai.Oxygen consumption and ammonia nitrogen excretion ofPenaeus-japonicusadolescents exposed to ambient ammonia[J].Comparative Biochemistry and Physiology,1992, 102C(1):129-133.
[5] Chen J C,F H Nan.Effects of ammonia on oxygen consumption and ammonia-nitrogen excretion ofPenaeus chinensisafter prolonged exposure to ammonia[J].Bulletin of Environmental Contamination and Toxicology,1993,51(1):122-129.
[6] Chen J C,Lin C Y.Responses of oxygen consumption,ammonia-N excretion and urea-N excretion ofPenaeus chinensisexposed to ambient ammonia at different salinity and pH levels[J].Aquaculture,1995,136:243-255.
[7] Racotta I S,R Hernandez-Herrera.Metabolic responses of the white shrimp,Penaeus vannamei,to ambient ammonia[J].Comparative Biochemistry and Physiology,2000,125A(4):437-443.
[8] Chen J C,Chen J M.Arginase specific activity and nitrogenous excretion of Penaeus japonicus exposed to elevated ambient ammonia[J].Marine Ecology Progress Series,1997,153:197-202.
[9] Hong M L,Chen L Q,Sun XJ,et al.Metabolic and immune responses in Chinese mitten-handed crab(Eriocheir sinensis)juveniles exposed to elevated ambient ammonia[J].Comparative Biochemistry and Physiology,2007,145C:363-369.
[10] Chen J M,Chen J C.Study on the free amino acid levels in the hemolymph,gill,hepatopancreas and muscle ofPenaeus monodonexposed to elevated ambient ammonia[J].Aquatic Toxicology,2000,50(1-2):27-37.
[11] 洪美玲,陈立桥,顾顺樟,等.氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响[J].中国水产科学,2007,14(3): 412-418.
[12] Chen J C,Liu P C,Lin Y T.Super intensive culture of red-tailed shrimpPenaeus penicillatus[J].Journal of World Aquaculture Society,1988,19:127-131.
[13] 钟硕良,陈月忠,林克冰,等.虾池底质中NH4+-N、S2-和异养细菌含量的变化及其相关性研究[J].台湾海峡,1997,16(4): 449-454.
[14] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.海洋监测规范GB17378.4-2007[S].北京:中国标准出版社,2008.
[15] 潘鲁青,王克行.中华绒螯蟹幼体消化酶活力与氨基酸组成的研究[J].中国水产科学,1997,4(2):13-20.
[16] 江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.
[17] Bradfor M M.A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry,1976,72:248-254.
[18] 王维娜,孙儒泳,王安利,等.环境因子对日本沼虾消化酶和碱性磷酸酶的影响[J].应用生态学报,2002,13(9):1153-1156.
[19] 杨志彪,赵云龙,周忠良,等.水体铜对中华绒螯蟹体内铜分布和消化酶活性的影响[J].水产学报,2005,29(4):496-501.
[20] Antoine D,Jeanine P R,Denis C,et al.Effect of chronic exposure to ammonia on growth,food utilization and metabolism of the European sea bass(Dicentrarchus labrax)[J].Aquatic Living Resources,2003,16:509-520.
[21] Stebbing A R D.Hormes is the stimulation of growth by low levels of inhibitors[J].The Science of The Total Environment, 1982,22(3):213-234.
[22] Kleber Campos Miranda-Filho,Grasiela Lopes Le es Pinho,Wilson Wasielesky Jr.,et al.Long-term ammonia toxicity to the pink-shrimpFarf antepenaeus paulensis[J].Comparative Biochemistry and Physiology,2009,150 C:377-382.
[23] Chen J C,Cheng S Y.Hemolymph PCO2,hemocyanin,protein levels and urea excretions ofPenaeus monodonexposed to ambient ammonia[J].Aquatic Toxicology,1993,27:281-292.
[24] Chen J C,Cheng S Y,Chen C T,et al.Changes of oxyhemocyanin,protein and free amino acid levels in the hemolymph of Penaeus japonicusexposed to ambient ammonia[J].Comparative Biochemistry and Physiology,1994,109A:339-347.
[25] Chen J C,Kou Y Z.Accumulation of ammonia in the haemolymph ofPenaeus monodonexposed to ambient ammonia[J]. Aquaculture,1993,109:177-185.
Abstract: To study the effects of ammonia-N stress on the activities of digestive enzymes in the midgut gland,stomach and intestine ofPortunus trituberculatus,groups in different ammonia-N concentrations (0,1,5 and 20 mg·L-1)were setup in laboratory condition for comparison among the groups.Results showed that ammonia-N stress had significant effects on the activities of trypsin-like enzyme,pepsin,lipase and amylase(P<0.05).The activities of trypsin-like enzyme and pepsin in the three digestive organs showed peak changes within 48 h,and trypsin-like enzyme recovered to the control level at 48 h; while pepsin related to the ammonia concentration positively in the midgut gland became stable from 24 h; pepsin in the stomach and intestine restored to the control level at 48 h and 24 h.The activity of lipase in the midgut gland and stomach also showed peak changes within 24 h,and lipase related to the ammonia concentration positively in the midgut gland became stable;while lipase in the stomach decreased gradually and returned to the control level at 48 h.The activity of amylase in the midgut gland and intestine decreased gradually within 12 h,reached the minimum which was related to the ammonia concentration negatively at 12 h and then kept stable;while amylase in the stomach increased firstly and then decreased. Moreover,ammonia-N stress induced the activities of pepsin and lipase in the midgut gland significantly and had a significant inhibition effect on the activity of amylase in the three digestive organs at 48 h.The present study suggested that the activities of pepsin and lipase in the midgut gland and amylase in the three digestive organs could be used as evaluation indexes for the abilities of digestion and absorption of the crabs during ammonia-N stress.
Key words: ammonia-N stress;Portunus trituberculatus;digestive enzyme activity
责任编辑 于 卫
Effects of Ammonia-N Stress on Digestive Enzyme Activities of Swimming Crab Portunus trituberculatus
XU Wu-Jie1,PAN Lu-Qing1,YUE Feng1,LI Jian2
(1.Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China;2.Yellow Sea fisheries Research Institute,CAFS,Qingdao 266071,China)
S917
A
1672-5174(2011)06-035-06
国家高技术研究发展规划项目(2006AA10A406);教育部新世纪优秀人才支持计划项目(NCET-06-0597)资助
2010-07-27;
2010-11-08
徐武杰(1984-),男,博士生,主要从事对虾环境生理学的研究。E-mail:phy@ouc.edu.cn
E-mail:panlq@ouc.edu.cn

